牛传染性鼻气管炎病毒LAMP检测方法的建立
高 峰,王建峰,于伯华,张 丹,刘向阳,张 琳,秦志军,唐泰山
(1. 盐城出入境检验检疫局,江苏盐城 224002;2. 宁波检验检疫科学技术研究院,浙江宁波 315100;3. 江苏出入境检验检疫局,江苏南京 210001)
牛传染性鼻气管炎(IBR)是由牛传染性鼻气管炎病毒(IBRV)引起牛的一种急性、热性、接触性传染病,以鼻气管炎、眼结膜炎、高热、流产、传染性脓疱性外阴道炎为主要特征[1],为世界动物卫生组织(OIE)法定报告动物疫病。IBRV可通过空气、媒介物,以及与病牛直接接触传播,20~60日龄犊牛对其最易感,对6周龄以下犊牛的病死率可达85%~100%[2]。目前针对IBR的病原学检测有包涵体检查、病毒分离、PCR、qPCR和荧光定量PCR等[3];血清学诊断方法有中和试验、琼脂扩散试验、间接血凝试验、ELISA试验和变态试验等[4]。但这些方法不是操作繁琐,就是需要高昂的设备和试剂。环介导等温扩增(Loop-mediated isothermal ampli fi cation,LAMP)是一种新型的核酸等温扩增技术,最早由日本 Notomi 等[5]报道,具有条件简单、操作方便等突出优点,是近年来发展起来的一种快速临床疾病诊断方法[6]。与其它分子生物学方法相比,LAMP 具有方便、简捷、灵敏等优点。本研究以IBRV为研究对象,基于LAMP技术,建立了可视化LAMP检测方法,有效缩短了检测时间,加快了通关速度,便于口岸、基层等特殊场所动物疫病检测的开展。
1 材料与方法
1.1 病毒株
牛传染性鼻气管炎病毒(IBRV)、蓝舌病病毒、赤羽病病毒、牛病毒性腹泻病毒、牛白血病病毒、小反刍兽疫病毒和伪狂犬病病毒,由江苏出入境检验检疫局动检实验室提供。
1.2 主要试剂、仪器及耗材
病毒株病毒基因组DNA/RNA提取试剂盒(货号DP315)、 DNA纯化回收试剂盒(货号DP214-02):购自天根生化科技(北京)有限公司;反转录试剂盒(D2680A):购自TaKaRa公司。其他:甜菜碱(Sigma 公司)、Bst DNA大片段扩增酶(NEB公司)、SYBR Green I(Invitrigen 公司)
1.3 LAMP引物设计及合成
根据GenBank中发表的IBRV全基因序列,利用MEGA 3.1进行同源性比对;选择基因中的高保守区域,采用Primer explorer V4网上在线软件(http∶//primerexplorer.jp/elamp4.0.0/index.html) 设计3对针对靶基因的引物,包括2条外引物F3和B3、2条内引物FIP和BIP,以及引物LF和LB。引物序列如表1所示。

表1 RT-LAMP引物序列
1.4 病毒核酸提取及反转录
RNA和DNA病毒核酸的提取,参照病毒基因组DNA/RNA提取试剂盒说明书进行。其中对RNA,再利用反转录试剂盒,将RNA反转录为cDNA,-20 ℃ 保存。
1.5 LAMP检测体系优化
在LAMP基本反应体系基础上设置不同内引物浓度(0.2、0.4、0.8、1.6、2.0、2.4 µmol/L),dNTP 浓度(0、0.2、0.4、0.8、1.0、1.2、1.4、2.0和2.4 mmol/L),Mg2+浓度(2、4、6、8、10和12 mmol/L)和反应温度(45、50、55、57、60、63、65、67和70 ℃),然后分别进行单因素实验,探索各因素对LAMP的影响,获得最佳反应参数。
1.6 LAMP 灵敏性试验
提取IBRV核酸,按照107~100copies/µL进行10倍比梯度稀释;以此为模板分别进行LAMP扩增,分析检测体系的灵敏度。
1.7 LAMP 特异性试验
提取IBRV、蓝舌病病毒、赤羽病病毒、牛病毒性腹泻病毒、牛白血病病毒、小反刍兽疫病毒和伪狂犬病病毒核酸,并以此为模板进行LAMP扩增,分析检测体系的特异性。
1.8 LAMP 反应时间
分别反应 5、10、15、20、25、30、40、50和60 min,评估反应时间。
2 结果与分析
2.1 内引物浓度梯度试验
分别用 0.2、0.4、0.8、1.6、2.0、2.4 µmol/L 引物进行内引物浓度优化,发现最佳引物浓度为2.4µmol/L。其中,黄绿色为阳性结果,浅橙色为阴性结果(图1)。

图1 内引物优化结果
2.2 dNTP浓度梯度试验
分 别 用 0、0.2、0.4、0.8、1.0、1.2和 1.4 mmol/L dNTP浓度进行试验摸索,发现最佳dNTPs浓度为1.0 mmol/L。其中,黄绿色为阳性结果,浅橙色为阴性结果(图2)。

图2 dNTP优化结果
2.3 Mg2+ 浓度梯度试验
分别用 2、4、6、8、10、12 µmol/L 浓度进行试验摸索,发现Mg2+最佳浓度浓度为8 µmol/L。其中,黄绿色为阳性结果,浅橙色为阴性结果(图3)。

图3 Mg2+优化结果
2.4 温度梯度试验
分别采用 67、65、63 、60、57、55、50、45 ℃进行试验摸索,发现佳反应温度为65 ℃。其中,黄绿色为阳性结果,浅橙色为阴性结果(图4)。
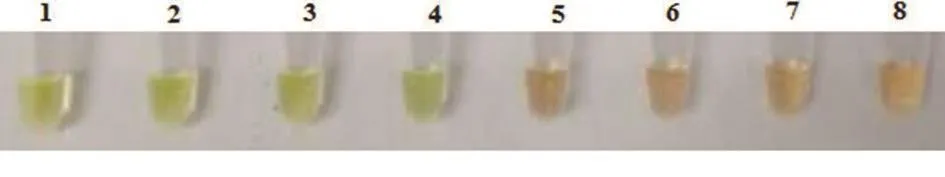
图4 温度优化结果
2.5 LAMP特异性试验
特异性试验结果显示,蓝舌病病毒、赤羽病病毒、牛病毒性腹泻病毒等6种其他病原全为阴性,仅IBRV为阳性,说明所建立的LAMP技术特异性较好(图5)。

图5 特异性实验结果
2.6 LAMP灵敏度试验
分别采用不同核酸浓度106、105、104、103、102、101copies/µL进行试验摸索,最终确定IBRV灵敏度为103copies/µL。其中,黄绿色为阳性结果,浅橙色为阴性结果(图6)。
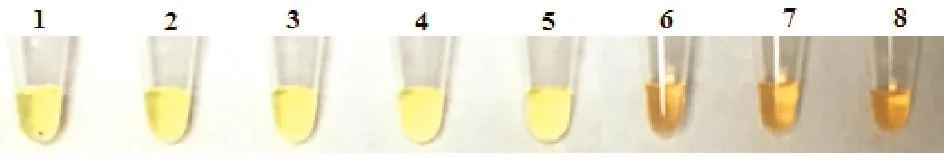
图6 灵敏度结果
3 讨论
IBR是由牛疱疹病毒I型引起的一种急性、热性、接触性传染病。此病在全球范围内广泛分布,主要损害牛的呼吸系统及生殖系统,给养牛业带来巨大经济损失[8]。目前,我国口岸动物检疫部门已明确规定凡是进境的牛及其制品必须检测IBRV。近年来,我国进境种(奶)用牛数量和种类不断增加,待检疫病种类较多,在实际检验检疫工作中,每进口一批活动物,往往要做上万次检测,因而需要花费大量时间和试剂,以及复杂的人工操作。因此,必须寻找一种高通量、高灵敏度、省时省力、经济且操作简单的检测方法,以加速口岸通关速度,提高口岸检测水平,并能有效防控外来动物疫病入侵。
可视化的逆转录环介导等温扩增(LAMP)方法相比其他方法,具有快速、高效、高敏感及高特异的特点[9]。冯蒙等[10]也建立了IBRV LAMP 方法。该法可在50 min内检出标准阳性质粒,且不发生交叉反应,通过肉眼直接观察即可判断结果。本研究以IBRV核酸作为研究对象,寻找该病毒的特异性保守基因序列,利用LAMP在线软件,设计筛选出特异性引物,利用具有链置换作用的Bst DNA聚合酶进行靶序列的识别和延伸,对待测靶序列进行超指数扩增,以验证引物的特异性和敏感性。在LAMP基本反应体系基础上,设置不同内引物浓度(0.2、0.4、0.8、1.6、2.0、2.4 µmol/L),dNTP 浓 度(0、0.2、0.4、0.8、1.0、1.2、1.4、2.0、2.4 mmol/L),Mg2+浓度(2、4、6、8、10、12 mmol/L)和反应温度(45、50、55、57、60、63、65、67 ℃)分别进行试验,探索各因素对LAMP的影响,以获得最佳反应参数,最终建立了灵敏度高的IBRV LAMP检测方法,灵敏度可达到103拷贝/µL。本研究对牛白血病病毒等6种牛主要疫病病原进行特异性分析,结果仅IBRV为阳性,特异性良好。本研究在反应体系中添加了碱土金属离子指示剂羟基萘酚蓝(HNB)。由于反应副产物焦磷酸根离子和反应体系中的Mg2+生成焦磷酸镁沉淀,不断消耗游离Mg2+,导致反应前后颜色显著改变,从而使IBRV检测可视化。
4 结论
本研究建立的可视化IBRV LAMP检测方法具有特异性和敏感性高、操作简便、耗时短等特点,适用于口岸进出口动物的IBR快速检疫。
参考文献:
[1] GRIFFIN D,CHENGAPPA M M,KUSZAK J,et al.Bacterial pathogens of the bovine respiratory disease complex[J]. Veterinary clinics of north america food animal practice,2010,26(2):381.
[2] BENO R M,JULIEN T,PHILIPPE K,et al.Bovine herpesvirusl infection and Infectious bovine rhinotracheitis[J]. Veterinary research,2007,38:181-209.
[3] 陈圣军,孔繁德,徐淑菲,等. 牛传染性鼻气管炎检测方法的研究进展[J]. 经济动物学报,2013,17(1):37-40.
[4] 徐晓琴,冷雪,李真光,等. 牛传染性鼻气管炎诊断方法研究进展[J]. 动物医学进展,2010,31(1):80-86.
[5] NOTOMT T H,OKAYAMA H,MASUBUCHI T,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic acids research,2000,28:e63.
[6] 张跃伟,李旭妮,郭盼盼,等. 荧光显色在环介导等温扩增(LAMP)检测猪繁殖与呼吸综合征病毒的应用[J]. 农业生物技术学报,2010,18(3):508-513.
[7] PAWAR S S,MESHRAM C D,SINGH N K,et al.Rapid detection of bovine herpesvirus 1 in bovine semen by loop-mediated isothermal amplification(LAMP)assay[J]. Archives of virology,2014,159(4):641.
[8] JONES C,CHOWDHURY S. A review of the biology of bovine herpesvirus type 1(BHV-1),its role as a cofactor in the bovine respiratory disease complex and development of improved vaccines[J]. Animal health research reviews,2007,8(2):187.
[9] ZHANG S Q,TAN B,LI P,et al. Comparison of conventional RT-PCR,reverse-transcription loopmediated isothermal amplification,and SYBR green I-based real-time RT-PCR in the rapid detection of bovine viral diarrhea virus nucleotide in contaminated commercial bovine sera batches[J]. Journal of virological methods,2014,207(10):204-209.
[10] 冯蒙. 可视化检测牛传染性鼻气管炎病毒LAMP法的建立及其对流行状况的初步调查[D]. 南京:南京农业大学,2014.

