高通量测序技术检测鸽群中病毒感染状况
王楷宬,庄青叶,邱 源,刘 朔,王素春,彭 程
(中国动物卫生与流行病学中心,山东青岛 266032)
鸽子是我国较受欢迎的食用动物之一,常与鸡、鸭、鹅一起在活禽交易市场销售,因而可以导致各种病原的相互传播。有些病原能在鸽子体内重组变异而产生新的病原。尤其是赛鸽,在训练和比赛中可与野鸟接触,具有将野鸟携带的病原传入家养赛鸽或者其他家禽的风险。已有研究者对鸽子感染病毒的种类进行过报道,包括副粘病毒1型、腺病毒、轮状病毒、疱疹病毒1型和圆环病毒等多种病原[1]。鸽子是禽类和人类病原的储存库,其携带的病毒可感染人类而发生新发传染病[2]。目前,我国对鸽子携带病原的种类和特性研究甚少。
动物病原的检测通常采用病原分离鉴定、PCR/RT-PCR、荧光定量PCR/RT-PCR、克隆测序分析等方法,往往针对已知的单种病原进行。而检测同一宿主或群体的多种病原时,需要使用不同的检测方法,甚至不同的实验室和实验人员,且不能检测未列入检测计划的动物疫病病原以及新型或未知病原。在对我国鸽子携带的病原种类尚不清楚的情况下,不适合采用传统方法,逐个进行病原筛查。随着高通量测序(NGS)技术和生物信息学的发展,这一难题得到解决。基于NGS的病原检测方法敏感性高,且可以不针对某些目标病原进行检测,而是对样品中携带的病原进行全景式扫描搜索。为了解我国鸽子的病毒携带情况,尤其是变异快、危害大的RNA病毒感染情况,采用高通量测序方法,对我国华东地区的肉鸽进行了病毒检测。
1 材料和方法
1.1 材料和仪器
Ion PGM Template OT2 200 Kit、Ion PGM Sequencing 200 Kit V2、E-Gel SizeSelect 2%Agarose、Ion 316 Chip Kit V2、Dynabeads MyOne Streptavidin C1 Beads、Qubit核酸浓度测定仪及配套试剂:均购自Life technologies公司。其他仪器包括:超净工作台(美国Forma Scientific);移液器(Eppendorf);孵化器(德州诚信孵化设备有限公司);高速台式离心机(德国Heraeus Biofuge primoR);PCR扩增仪(Perkin Elmeter Gen Amp PCR System 9600);QIAamp Viral RNA Mini Kit(Qiagen,德国)。高性能计算平台:Dell T630塔式服务器,具有2颗Intel(R)Xeon(R)CPU E5-2620 v3 @ 2.40GHz,内存264 G,存储23 T,操作系统版本CentOS Linux release 7.1.1503(Core)。
1.2 样品采集
在我国华东地区某省活禽交易市场,按照简单随机抽样方法,采集禽泄殖腔/咽喉双拭子60份,置于含有10%甘油和抗生素的PBS(pH 7.2)缓冲液中,-80 ℃保存。
1.3 核酸提取
将采集的60份样品充分混匀后,各取20 µL进行混合;将混合样品高速离心和0.22 μm滤膜过滤,去除大分子物质和细菌,再经DNase I 和 RNase A除去细胞外的游离核酸;使用QIAamp Viral RNA Mini Kit(Qiagen,德国)提取病毒核酸[3],-80 ℃保存。
1.4 NGS文库构建
按照稍加修改的已报道方法[3],将提取的病毒核酸构建为PGM测序仪可识别的文库:10 μL病毒 RNA,加入1 μL 100 μmol/L引物 A15N6(表1),72 ℃反应5 min,并置于冰上至少3 min;在上述反应混合物中加入4 µL 5× first-strand buffer、1 μL dNTP(100 μmol/L)、2 μL DTT(0.1 mol/L)、1 μL RNaseOUT ™ Recombinant Ribonuclease Inhibitor(40 U/μL) 和 1 μL SuperScript®III Reverse Transcriptase(200 U/μL)(Invitrogen,USA),25 ℃ 反应 15 min,并 42 ℃反转录30 min,70 ℃ 15 min,终止反应;反应产物中再加入 1 μL RNase H(TaKaRa,Japan),37 ℃ 反应20 min。将反转录合成的单链cDNA经 Agencourt®AMPure®XP Reagent(Beckman Coulter,USA)纯化,加入引物B15N6(表1),70 ℃反应 5 min;再加入 1 μL Klenow fragment(5 U)(NEB,USA),5 μL 10× NEBuffer 2,2 μL dNTP(100 μmol/L)和 1 μL DTT(0.1 mol/L),37 ℃ 反应30 min。采用引物A30和B30进行文库扩增。反应体系包括:1× Phusion High-Fidelity Buffer,10 μmol/L 引物 A30 和 B30(表 1),0.5 U Phusion High-Fidelity DNA Polymerase(NEB,USA)。文库经 E-Gel® SizeSelectTMAgarose Gel回收,将350 bp 的DNA进行PGM测序。
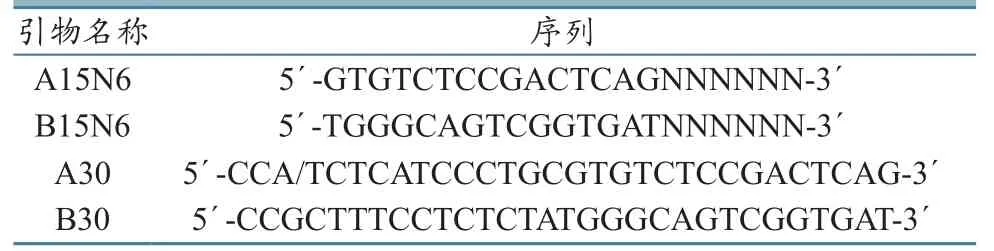
表1 引物及其序列
1.5 NGS感染病原种类分析
将经E-Gel® SizeSelectTM Agarose Gel回收的文库均稀释为26 pmol/L;应用Ion PGM Template OT2 200 Kit,对DNA文库进行测序前的样品处理。将处理后的样品加样至Ion 316 芯片,置于PGM测序仪进行测序;采用standalone NCBI BLASTn tool[4]将测序得到的reads与 GenBank 核酸数据库进行比对(E值为10-5)。对BLASTn 分析结果,由MetaGenome Analyzer(MEGAN)[5]进行展示。将其中与病毒序列比对上的结果进行整理,识别鸽子感染的主要病原。
2 结果与分析
2.1 测序质量
芯片上样率为73%,测序得到质量较高的序列数据,Reads数量为4.58 M,平均测序长度为107 bp,≥Q20 碱基数为492.3 Mbp。测序数据已登录GenBank,登录号为SRR2157429。
2.2 病原分析
将测序数据与GenBank 核酸数据库进行比对发现,在我国华东地区的肉鸽群中检出5种病毒(图1),包括禽轮状病毒、鸽圆环病毒、鸽星状病毒、鸽冠状病毒和鸽微RNA病毒B。将归为同一类病毒的reads提取后,应用CLC genomics workbench 8.5.1(Qiagen,Germany)进行拼接,发现拼接后的序列经在线BLAST核对均正确。基因序列BLAST分类和reads数量见表2。
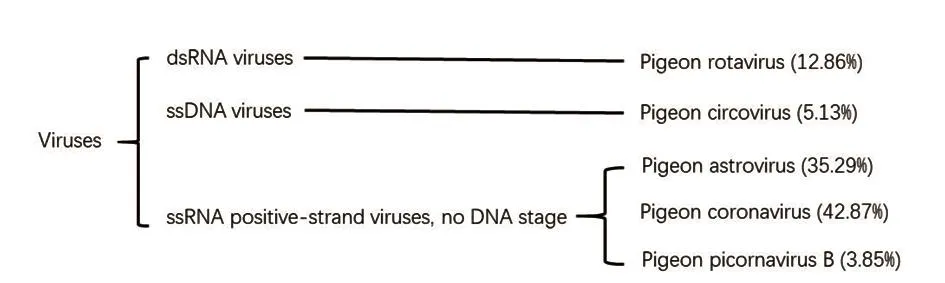
图1 MEGAN分析鸽子携带的病毒种类及其reads数量占病毒总reads数的比例
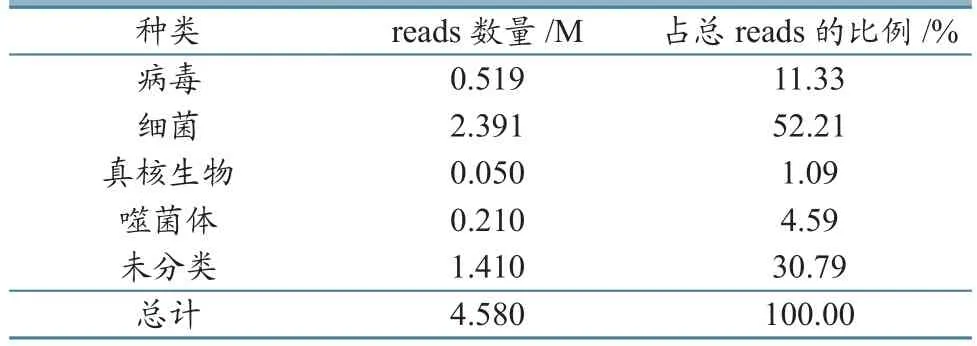
表2 基因序列BLAST分类和reads数量
3 讨论
我国对鸽子感染的病毒种类研究极少,至今仅报道过鸽群感染禽流感病毒[6-7]、新城疫病毒[8-9]、鸽圆环病毒[10-11]、鸭肝炎病毒[12]、网状内皮组织增生病毒[13]、鸽细环病毒[14]等。本次检测首次在我国鸽群中发现了禽轮状病毒、鸽星状病毒、鸽冠状病毒和鸽微RNA病毒B,为下一步开展鸽群中病毒感染情况监测提供了数据支持。这些病原在我国鸽群中的感染率和特性,今后将会被进一步研究和分析。
动物病原检测通常采用PCR等分子生物学方法或ELISA等血清学方法进行。由于PCR方法具有高敏感性和特异性,以及检测通量高、效率高等优点,已广泛被各病原监测实验室所接受。但是基于PCR的检测方法必须针对目标性病原开展,对检测的每种病原都要知晓基因序列信息,并分别建立特异性PCR检测方法。如,Roussan等[15]对鸡场的星状病毒、轮状病毒、呼肠孤病毒和腺病毒I型的感染情况进行检测,需要分别设计6个PCR,对所有样品进行检测,才能得到检测结果。这种检测方法只能涵盖列入监测计划的目标病原,而不能检测新发或新型病原[16]。对于研究数据较少的鸽群病毒感染状况,有目的地进行PCR检测并不能发现鸽群中主要感染病原。如本检测新发现的4种鸽群感染病原,往往由于之前未曾发现而被忽视。本检测采用NGS技术解决了这个问题,对鸽子样品中携带的RNA病毒进行全景式扫描搜索,并首次发现了我国鸽群中存在禽轮状病毒、鸽星状病毒、鸽冠状病毒和鸽微RNA病毒B的感染。
由于病毒性疫病,尤其是RNA病毒病[17-19],对动物健康影响较大,且其病原变异速度快,更需要密切监测其分子进化趋势,因而本文选择病毒性病原进行检测。因检测出的病原种类与采集的样品种类有关,本检测采集泄殖腔/咽喉双拭子,能够检测主要的呼吸道和消化道病原,更换样品类型也可以检测其他病原。
4 结论
综上所述,本检测采用NGS方法,发现我国华东地区肉鸽主要携带禽轮状病毒、鸽圆环病毒、鸽星状病毒、鸽冠状病毒和鸽微RNA病毒B等5种病原,其中禽轮状病毒、鸽星状病毒、鸽冠状病毒和鸽微RNA病毒B等4种为国内首次报道。结果证实,NGS技术能够检测出动物群体的主要感染病原,是动物疫病检测的新思路。随着NGS费用的逐渐降低,该方法可用于规模化养殖场的疫病检测、净化等工作,可以减少实验室检测工作量,有利于全面地掌握动物病原感染状况,及时预警、处置和防控动物疫病的发生。
参考文献:
[1] MARLIER D,VINDEVOGEL H. Viral infections in pigeons [J]. Veterinary journal,2006,172(1):40-51.
[2] PHAN T G,VO N P,BOROS A,et al. The viruses of wild pigeon droppings [J]. Plos one,2013,8(9):e72787.
[3] QIU Y,CHEN J M,WANG T,et al. Detection of viromes of RNA viruses using the next generation sequencing libraries prepared by three methods [J]. Virus Research,2017,237:22-26.
[4] MCGINNIS S,MADDEN T L. BLAST: at the core of a powerful and diverse set of sequence analysis tools [J].Nucleic acids research,2004,32:W20-25.
[5] HUSON D H,AUCH A F,QI J,et al. MEGAN analysis of metagenomic data [J]. Genome research,2007,17(3):377-386.
[6] LIU T,XIE Z,WANG G,et al. Avian influenza virus with hemagglutinin-neuraminidase combination H3N6,isolated from a domestic pigeon in Guangxi,Southern China [J]. Genome announc,2015,3(1):e00965.
[7] YAO Y,FU S,HE B,et al. Complete genome sequences of an h5n1 highly pathogenic avian influenza virus isolated from pigeon in China in 2012 [J]. Genome announc,2015,3(6):e01330.
[8] LIU H,WANG Z,SON C,et al. Characterization of pigeon-origin Newcastle disease virus isolated in China[J]. Avian disease,2006,50(4):636-640.
[9] REN S,XIE X,WANG Y,et al. Molecular characterization of a Class I Newcastle disease virus strain isolated from a pigeon in China [J]. Avian pathol,2016,45(4):408-417.
[10] WANG K C,ZHUANG Q Y,QIU Y,et al. Genome sequence characterization of pigeon circoviruses in China[J]. Virus research,2017,233:1-7.
[11] ZHANG Z,DAI W,WANG S,et al. Epidemiology and genetic characteristics of pigeon circovirus(PiCV)in eastern China [J]. Archives of virology,2015,160(1):199-206.
[12] SHI S H,CHEN H M,CHEN Z,et al. Complete genome sequence of a duck hepatitis a virus 1 isolated from a pigeon in china [J]. Genome announc,2013,1(4):e00451.
[13] ZHAI S L,CHEN S N,LIN T,et al. Emergence of reticuloendotheliosis virus in pigeons in Guangdong Province,Southern China [J]. Archives of virology,2016,161(7): 2007-2011.
[14] ZHANG Z,ZHUANG L,DAI W,et al. Complete genome sequence of a novel pigeon torque teno virus in china [J]. Genome announc,2013,1(6):215-216.
[15] ROUSSAN D A,SHAHEEN I A,KHAWALDEH G Y,et al. Simultaneous detection of astrovirus,rotavirus,reovirus and adenovirus type I in broiler chicken flocks[J]. Polish academy of sciences,2012,15(2):337-344.
[16] ZOU X,TANG G,ZHAO X,et al. Simultaneous virus identification and characterization of severe unexplained pneumonia cases using a metagenomics sequencing technique [J]. Science China life sciences,2017,60(3):279-286.
[17] AL-ATEEG F A. SARS:The emergence of a new epidemic [J]. Saudi medical journal,2003,24(7):794-798.
[18] LI W,SHI Z,YU M,et al. Bats are natural reservoirs of SARS-like coronaviruses [J]. Science,2005,310(5748):676-679.
[19] PARRY J. H7N9 virus is more transmissible and harder to detect than H5N1,say experts [J]. British medical journal,2013,346:f2568.

