腺样型胶质母细胞瘤
孙翠云 于士柱
胶质母细胞瘤(glioblastoma)是中枢神经系统常见恶性肿瘤,通常具有典型影像学表现和组织病理学特征。随着对胶质母细胞瘤异质性认识的不断深入,发现数种胶质母细胞瘤少见亚型,包括横纹肌样型、腺样型、上皮样型、富于脂质上皮样型、真上皮分化型、脂质化型、脂肪化生型、颗粒细胞型和伴原始神经元成分的胶质母细胞瘤等[1⁃2]。腺样型胶质母细胞瘤(adenoid glioblastoma)是胶质母细胞瘤的少见亚型,组织学形态表现为胶质母细胞瘤中出现多少不等的腺样分化结构,尤其当腺样分化结构成为主要成分时易误诊为转移瘤。本文回顾1例腺样型胶质母细胞瘤患者的诊断与治疗经过,结合相关文献分析此类肿瘤的临床病理学特征,以期提高诊断与鉴别诊断能力。
病历摘要
患者 男性,63岁,主因口角左偏10余天,于2016年9月12日入院。患者10余天前无明显诱因出现口角左偏,伴流涎,偶伴头痛、头晕,以左侧额部显著,呈钝痛,右下肢肌力降低,无恶心、呕吐,无幻嗅、幻听等。外院头部CT检查(2016年9月3日)显示,左侧额颞叶囊性占位性病变。为求进一步明确诊断与治疗,遂至我院就诊。患者自发病以来,一般状况良好,精神好,睡眠可,饮食正常,大小便正常,体重无明显减轻。
既往史、个人史及家族史均无特殊。
体格检查 患者体温36.5℃,心率66次/min,呼 吸 18次/min,血 压 120/80 mm Hg(1 mm Hg=0.133 kPa)。神志清楚,语言流利,自主睁眼,对答切题,可遵嘱活动肢体;双侧瞳孔等大、等圆,直径约3 mm,对光反射灵敏,眼球各向活动充分;双侧额纹对称,右侧鼻唇沟稍浅,示齿口角左偏,伸舌右偏,双侧咽反射存在;双侧肢体肌力4+级,肌张力无增高或降低,共济运动和感觉系统未见明显异常,双侧腱反射未见明显异常,双侧Babinski征阴性,脑膜刺激征阴性。入院时Glasgow昏迷量表(GCS)评分15分。
辅助检查 实验室检查各项指标均于正常值范围。影像学检查:头部MRI增强扫描(双倍对比剂剂量)显示,左侧额颞叶环形强化征象,环壁薄厚均匀,边界清晰;扩散加权成像(DWI)可见中央低信号边缘环形稍高信号影;病灶邻近脑组织环绕大片长T2信号水肿带,左侧侧脑室受压,中线结构偏向右侧,脑室系统、脑池和脑沟未见明显增宽和扩张,考虑左侧额颞叶占位性病变,转移瘤可能性大(图1)。18F⁃脱氧葡萄糖(18F⁃FDG)PET显像未见恶性肿瘤征象。
诊断与治疗经过 临床诊断为左侧额颞叶占位性病变。患者于全身麻醉下行神经导航联合术中超声引导下左侧额颞叶占位性病变切除术。术中于左侧额中回后部皮质下3.50 cm处见一类圆形肿物;其内可见黄色透明囊液,病变与周围脑组织之间可见假性边界,无包膜,呈灰白色,约30 mm×35 mm×30 mm大小,质地柔软,血供中等。于手术显微镜下全切除病变,进行组织病理学检查。(1)大体标本观察:手术切除标本为灰白、灰黄色组织一块,大小约40 mm×30 mm×15 mm,切面呈灰黄色,质地柔软,无包膜。经体积分数为4%的中性甲醛溶液固定,常规脱水、透明、石蜡包埋,制备5 μm连续切片,行HE染色和免疫组织化学染色。(2)HE染色:肿瘤组织位于脑实质内,与周围脑组织界限清晰;肿瘤细胞呈片状或巢状多中心生长,部分肿瘤区域黏液丰富(图2a,2b);肿瘤细胞呈条索状、筛状、腺腔样或乳头状排列,胞质较少,胞核大小较为一致、呈圆形或卵圆形、核深染,偶见明显核仁(图2c~2e);可见肾小球样血管内皮细胞增生(图2f),肿瘤细胞间或血管周围未见弥漫性淋巴细胞浸润。(3)免疫组织化学染色:采用ABC法,检测用试剂盒购自北京中杉金桥生物技术有限公司,检测用抗体为胶质纤维酸性蛋白(GFAP,1∶100)、少突胶质细胞转录因子 2(Olig⁃2,1∶100)、P53(1∶100)、波形蛋白(Vim,1∶100)、S⁃100蛋白(S⁃100,1∶100)、表皮生长因子受体(EGFR,1∶100)、同源性磷酸酶⁃张力蛋白(PTEN,1∶100)、细胞角蛋白(CK,1∶200)、上皮膜抗原(EMA,1∶200)、癌胚抗原(CEA,1∶100)、甲状腺转录因子⁃1(TTF⁃1,1∶100)、CD31(1∶100)、CD34(1 ∶100)、CAM5.2(1∶100)、异柠檬酸脱氢酶 1(IDH1,1 ∶100)和Ki⁃67抗原,均购自北京中杉金桥生物技术有限公司。结果显示,肿瘤细胞胞质弥漫性表达GFAP(图 3a)、Vim(图 3b)和 PTEN,胞核表达 Olig⁃2(图 3c)和 P53(图 3d),胞质和胞核表达 S⁃100(图3e),胞膜表达EGFR,不表达CK、EMA、CEA、TTF⁃1、CD31、CD34、CAM5.2 和 IDH1,Ki⁃67 抗原标记指数约为76.80%(图3f)。最终病理诊断为腺样型胶质母细胞瘤。患者术后12 d因呼吸功能和循环功能衰竭而死亡。
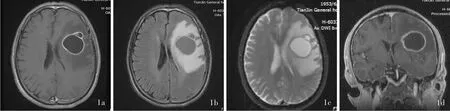
图1 头部MRI检查所见 1a 横断面增强T1WI显示,左侧额颞叶环形强化影,环壁薄厚均匀,边界清晰 1b 横断面FLAIR成像显示,左侧额颞叶囊性占位性病变,环壁薄厚均匀,边界清晰,周围脑组织明显水肿 1c 横断面DWI显示,中央低信号边缘环形稍高信号影,病灶邻近脑组织环绕大片水肿带 1d 冠状位增强T1WI显示,左侧额颞叶环形强化影,环壁薄厚均匀,边界清晰Figure 1 Brain MRI findings Axial enhanced T1WI showed ring enhancement of left frontotemporal lobe with evenly distributed wall and clear border(Panel 1a).Axial FLAIR showed cystic mass of left frontotemporal lobe with evenly distributed wall,clear border and obvious peritumoral edema(Panel 1b).Axial DWI revealed low⁃intensity surounded by slightly high⁃intensity.Adjacent brain tissue appeared a sheet edema zone(Panel 1c).Coronal enhanced T1WI revealed ring enhancement of left frontotemporal lobe with evenly distributed wall and clear border(Panel 1d).
讨 论
腺样型胶质母细胞瘤临床极为罕见,由Kepes等[3]于1982年首先报告,此后国内陆续有少量病例报道[4⁃5]。1988 年,Shintaku 等[6]报告 1 例腺样型胶质母细胞瘤患者,电子显微镜观察可见肿瘤细胞具有不成熟星形细胞瘤特征。2004年,du Plessis等[7]分别对腺样型胶质母细胞瘤的典型胶质母细胞瘤成分和腺样结构进行分子生物学检测,结果显示,两种成分均存在染色体17p13和10q22~26缺失以及TP53基因密码子209和6号外显子缺失,因此认为二者虽然组织学形态不同,但是具有相同的基因谱系。
腺样型胶质母细胞瘤组织学形态特征为,典型多形性胶质母细胞瘤组织中出现边缘锐利、间质呈黏液样变的腺样肿瘤细胞区域,典型腺样型胶质母细胞瘤区域至少占1个低倍视野(LPF)方诊断为腺样型胶质母细胞瘤。腺样结构区域的肿瘤细胞中等大小,胞质较少,胞核大小较为一致、呈圆形或卵圆形、核深染、核分裂象多见[20~52/10个高倍视野(HPF)];肿瘤细胞呈条索状、筛状、腺腔样或乳头状相互黏附、紧密排列;可见肾小球样血管内皮细胞增生;均可见坏死,但通常为凝固性坏死,而“栅栏”状坏死较为少见。肿瘤组织中还可见肉瘤细胞成分,偶可见骨、软骨和(或)横纹肌母细胞化生。免疫组织化学染色,腺样型胶质母细胞瘤的两种成分均表达 GFAP、S⁃100和Vim[1]。
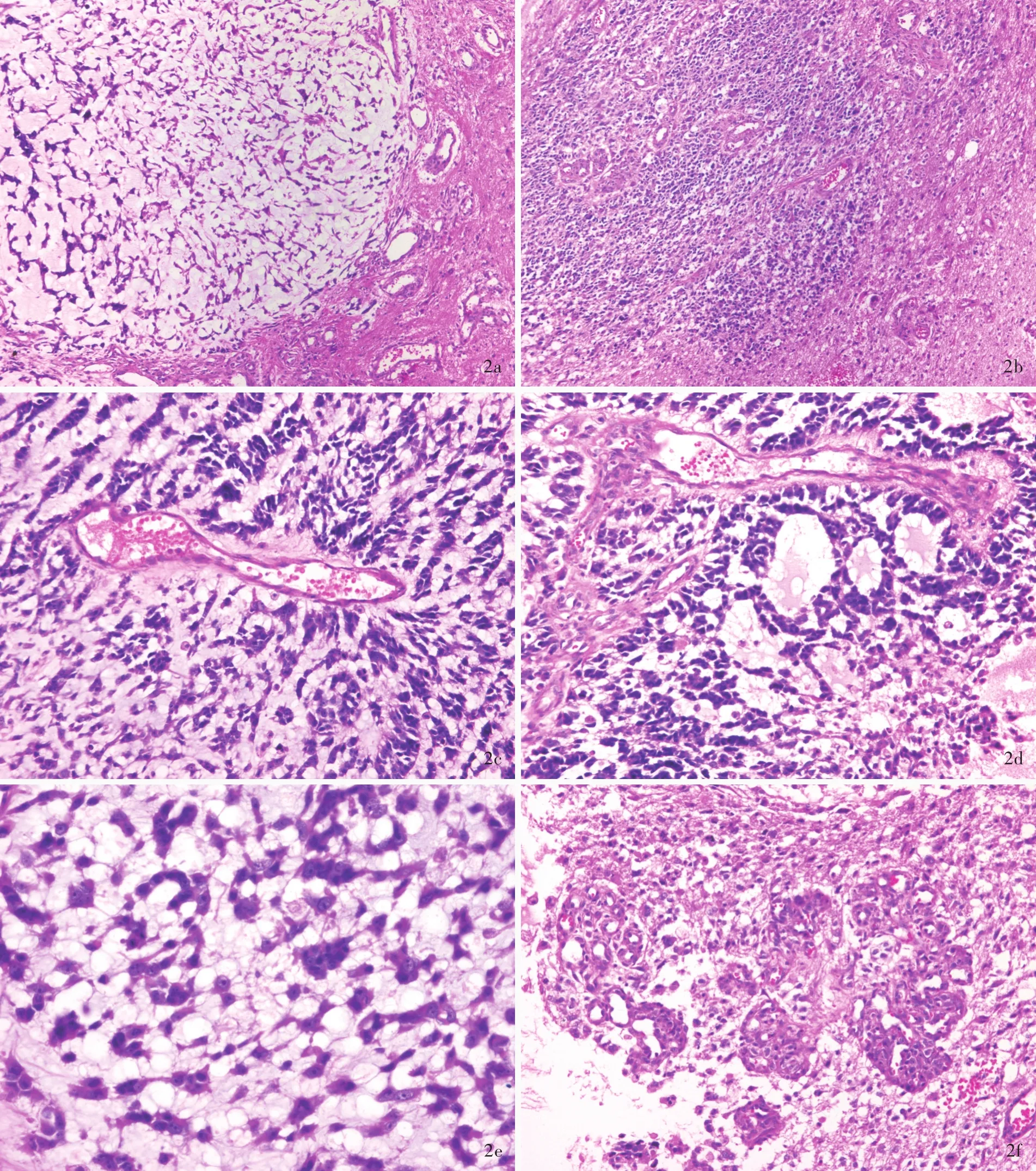
图2 光学显微镜观察所见 HE染色 2a 肿瘤组织位于脑实质内,与周围脑组织界限清晰;部分肿瘤细胞呈巢状,细胞间黏液丰富 ×100 2b 肿瘤组织与周围脑组织界限清晰,肿瘤细胞密集排列 ×100 2c 部分肿瘤细胞呈条索状排列 ×200 2d 部分肿瘤细胞呈筛状或腺腔样排列 ×200 2e 肿瘤细胞胞质较少,胞核大小较一致、呈圆形或卵圆形、核深染,偶见明显核仁 ×400 2f 可见肾小球样血管内皮细胞增生 ×200Figure 2 Optical microscopy findings HE staining The tumor was located in brain parenchyma and had a clear border with adjacent brain tissue.Some tumor cells presented a nest growing pattern and mucus scattered in some regions(Panel 2a). ×100 The tumor had a clear border with adjacent brain tissue and tumor cells were densely arranged(Panel 2b). ×100 Tumor cells were arranged in strip(Panel 2c),cribriform or adenoid patterns(Panel 2d). ×200 Tumor cells contained few cytoplasm with round or oval uniform hyperchromatic nuclei and occasionally obvious nucleoli(Panel 2e). ×400 Proliferation of glomeruloid vascular endothelial cells could be seen(Panel 2f). ×200
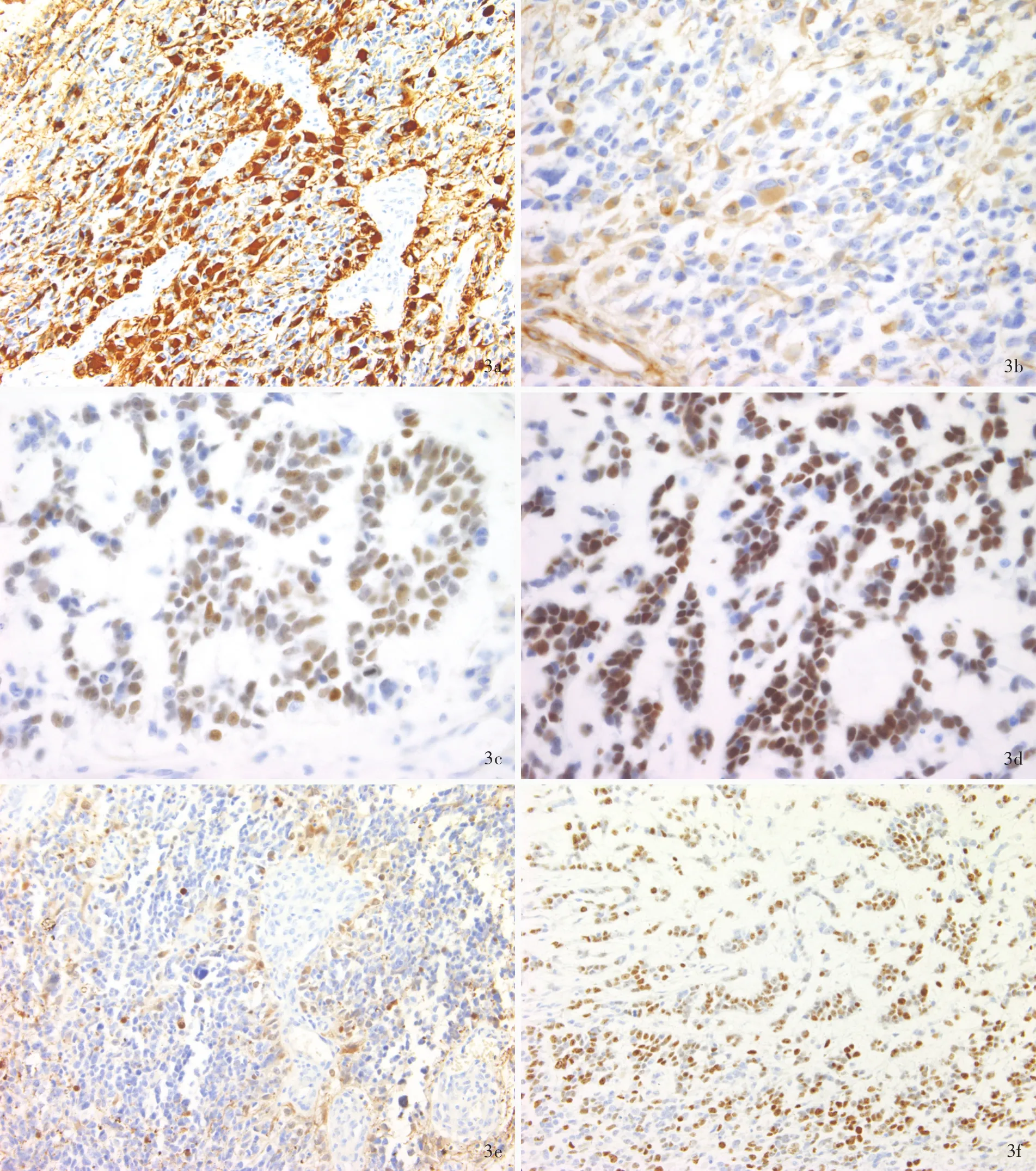
图3 光学显微镜观察所见 免疫组织化学染色(ABC法) 3a 肿瘤细胞胞质弥漫性表达GFAP ×200 3b 肿瘤细胞胞质弥漫性表达Vim ×200 3c 肿瘤细胞胞核表达Olig⁃2 ×400 3d 大多数肿瘤细胞胞核表达P53 ×400 3e 肿瘤细胞胞质和胞核表达S⁃100 ×200 3f 肿瘤细胞Ki⁃67抗原标记指数约为76.80% ×200Figure 3 Optical microscopy findings Immunohistochemical staining(ABC) Cytoplasm of tumor cells were diffusely positive for GFAP(Panel 3a). ×200 Cytoplasm of tumor cells were positive for Vim(Panel 3b). ×200 Nuclei of tumor cells were positive for Olig⁃2(Panel 3c). ×400 Nuclei of most tumor cells were positive for P53(Panel 3d). ×400 Cytoplasm and nuclei of tumor cells were positive for S⁃100(Panel 3e). × 200 Ki⁃67 labeling index was 76.80%(Panel 3f). × 200
该例患者肿瘤细胞胞质弥漫性表达GFAP、胞核表达Olig⁃2,可以肯定肿瘤来源于神经胶质细胞,且上皮标志物均呈阴性,18F⁃FDG PET未见原发病灶。尽管肿瘤组织学形态类似腺癌样改变,但仍是胶质母细胞瘤的腺样分化。因此,在胶质母细胞瘤中出现腺样结构时,免疫组织化学染色和超微结构观察是必要的,胞质GFAP阳性、上皮标志物阴性有助于明确诊断,亦可见部分腺样结构区域同时表达两种类型标志物或GFAP呈阴性、上皮标志物呈阳性的报道,必要时应行基因检测方明确诊断[8]。与典型胶质母细胞瘤相同,腺样型胶质母细胞瘤患者预后较差,积极的手术治疗和术后辅助放射治疗和药物化疗可以不同程度地延长生存期和改善生活质量。
[1]Yu SZ.Pay much attention to the clinical and pathological characteristics of rare subtypes of glioblastoma[J].Zhonghua Bing Li Xue Za Zhi,2015,44:297⁃300[.于士柱.应重视对胶质母细胞瘤少见亚型临床及病理学特征的认识[J].中华病理学杂志,2015,44:297⁃300.]
[2]Louis DN,Ohgaki H,Wiestler OD,Cavenee WK.WHO classification of tumours of the central nervous system[S].4th ed.Lyon:IARC Press,2016:28⁃51.
[3]Kepes JJ,Fulling KH,Garcia JH.The clinical significance of"adenoid" formations of neoplastic astrocytes, imitating metastatic carcinoma,in gliosarcomas:a review of five cases[J].Clin Neuropathol,1982,1:139⁃150.
[4]Duan HL,Xu QZ.Adenoid formations of neoplastic astrocytes imitating metastatic carcinoma presented in glioblastoma:report of one case[J].Beijing Yi Xue,1994,16:238.[段 会 玲, 徐 庆中.胶质母细胞瘤中肿瘤性星形细胞出现类似转移癌的“腺样”结构1例报告[J].北京医学,1994,16:238.]
[5]Gui QP, Wang FL, Li XH. Adenoid gliblastoma: a clinicopathological observation and review of literature[J].Zhen Duan Bing Li Xue Za Zhi,2007,14:282⁃284[.桂秋萍,王辅林,李向红.腺样胶质母细胞瘤临床病理观察[J].诊断病理学杂志,2007,14:282⁃284.]
[6]Shintaku M,Hirano A,Llena JF.Fine structure of glioblastoma multiforme with "adenoid formation"[J].No Shinkei Geka,1988,16:997⁃1003.
[7]du Plessis DG,Rutherfoord GS,Joyce KA,Walker C.Phenotypic and genotypic characterization of glioblastoma multiforme with epithelial differentiation and adenoid formations[J].Clin Neuropathol,2004,23:141⁃148.
[8]Oka N,Soeda A,Noda S,Iwama T.Brain tumor stem cells from an adenoid glioblastoma multiforme[J].Neurol Med Chir(Tokyo),2009,49:146⁃150.

