Al(OH)3的酸碱性的实验探讨
甘肃省兰州市教育科学研究所(730046) 甘肃省兰州市第三十四中学(730050)
吴正帅 任志斌
1 问题的提出
Al(OH)3为两性氢氧化物,Al(OH)3白色胶状沉淀既能溶于足量的NaOH溶液,也能溶于足量的HCl溶液,这是由于Al(OH)3既有酸式电离,也有碱式电离。
Al(OH)3的两性电离解释了它既能溶于强酸又能溶于强碱的性质。那么,Al(OH)3水溶液到底是酸性、中性还是碱性,一直是中学化学比较模糊的问题,梁俊峰在《探究Al(OH)3的酸碱性》中采用酸式、碱式溶度常数计算得到饱和氢氧化铝溶液显弱酸性,pH=5.6;何家忠在《研究性学习巧夺千峰秀色》的酸式、碱式溶度积常数结合数学的求导方法计算出Al(OH)3溶解量最小时的c(H+),进而求得pH=5.6;林恺在《漫谈氢氧化铝的两性》一文中用溶度积求算求得pH≈6.1。用溶度积Ksp计算的前提是物质难溶且为强电解质,Al(OH)3属于弱电解质,所以计算Al(OH)3的酸碱性时,利用Ksp计算有很大的误差,同时采用Ksp计算时也要考虑水本身电离出来的OH-。因此,上面的讨论未免偏颇,给读者会带来一些负面影响,基于此,带着疑问,笔者进行了以下探究。
2 Al(OH)3酸碱性的实验验证
实验采用分析纯(AR)的氢氧化铝,用煮沸2次的蒸馏水溶解氢氧化铝制成待测溶液。
2.1 实验设计
(1)制备Al(OH)3。
(2)过滤Al(OH)3。
(3)洗净Al(OH)3。
(4)制成Al(OH)3饱和溶液。
(5)测量溶液pH值。
2.2 实验方法一
(1)在大试管中加入适量Al2(SO4)3溶液,滴加氨水,生成白色胶状沉淀。
(2)将制好的Al(OH)3悬浊液进行离心分离,采用倾析法弃去溶液,加适量蒸馏水,并用玻璃棒搅拌后,再离心分离,重复此方法清洗沉淀物数次。
(3)取最后一次的洗涤液,加入BaCl2和HCl的混合溶液,直到无沉淀时,可认为Al(OH)3已洗涤干净。
(4)将洗涤后的Al(OH)3放到小烧杯中,加入适量蒸馏水并搅拌,使之充分溶解,静置或离心后,用玻璃棒蘸取上层清液,点在pH试纸上,并与标准比色卡进行比较,测得溶液的pH值为8~9。用pH计测3次清液的pH值,分别为8.4、8.2、8.3,取其平均值为8.3。
2.3 实验方法二
(1)在大试管中加入适量NaAlO2溶液,通入过量的二氧化碳,生成白色沉淀。
(2)将制好的Al(OH)3悬浊液进行离心分离,采用倾析法弃去溶液,加适量蒸馏水,并用玻璃棒搅拌后,再离心分离,重复此方法清洗沉淀物数次。
(3)取洗涤液,加入Ba(OH)2溶液,直到无沉淀时,可认为Al(OH)3已洗涤干净。
(4)将洗涤后的Al(OH)3放到小烧杯中,加入适量蒸馏水并搅拌,使之充分溶解,静置或离心后,用玻璃棒蘸取上层清液,点在pH试纸上,并与标准比色卡进行比较,测得溶液的pH值为7~8。用pH计测3次清液的pH值,分别为7.8、8.0、7.9,取其平均值为7.9。
2.4 实验结论
(1)实验方法一制得的Al(OH)3是一种白色的无定型凝胶沉淀,其组成中含水量不定,组成也不均匀,且其在水溶液中静置即会逐渐转变为结晶的偏氢氧化铝AlO(OH),温度越高,这种转变越快。
(2)实验二制的Al(OH)3是真正的白色沉淀。
(3)由于两种方法制得的组成的不同,其电离常数也不同,故溶液的pH值有一定的差异。
(4)由实验可知:Al(OH)3的水溶液显弱碱性。
3 Al(OH)3酸碱性的理论分析
在纯水中若只考虑Al(OH)3第一步碱式电离,其两性电离平衡如下。
已知18~25 ℃时,Al(OH)3的酸式、碱式电离常数分别为:pKa=12.20(即Ka=6.3×10-13),pKb1=8.3(即Kb1=5.0×10-9)。
由酸式电离常数和碱式电离常数的相对大小可以看出碱式电离程度比酸式电离程度大,其碱性弱强与酸性。其pH计算如下:
根据酸式电离平衡常数:
(1)
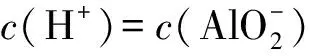
根据碱式电离平衡常数:
(2)
由于第一步电离远远大于第二步电离,故有
由(2)式除以(1)式得到:
(3)
25 ℃时,在稀溶液中,
Kw=c(H+)c(OH-)=1.0×10-14
将(3)式分子、分母同时乘以c2(H+),可得到:
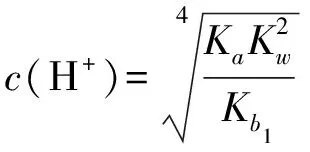
(4)
将Ka=6.3×10-13
Kb1=5.0×10-9
Kw=1.0×10-14
代入式(4)解得:
c(H+)=1.1×10-9mol/L
pH=7.98
4 探究结论
无论是实验验证,还是理论分析,都说明饱和Al(OH)3的水溶液显弱碱性。

