桃果实PLDα基因的表达及生物信息学分析
高 珊, 张 凯, 朱树华
(山东农业大学化学与材料科学学院,山东 泰安 271018)
桃果实属于呼吸跃变型果实,采后果实呼吸跃变致使成熟衰老进程加快,出现果实软化、腐烂、风味劣变等现象。采摘后的桃果实可以通过低温冷藏抑制其代谢活动[1],使其呼吸得到抑制,达到果实保鲜的目的,但是桃果实对冷害较为敏感,易出现不能正常后熟、絮败、果实褐变、风味丧失等冷害问题[2],诱发果实产生生理紊乱[3-4]。研究结果表明,桃果实存在中间冷害温度特性,0 ℃贮藏时能减轻冷害症状,使储藏时间变长[5]。因此,在储藏过程中保持桃果实正常风味是采后桃果实储存的重点。
大多数植物组织中都含有磷脂酶D(PLD),幼苗和种子中含量尤为丰富。它是一种多功能酶,能催化磷酸二酯键水解和碱基交换。它还是一种重要的跨膜信号转导酶[6]。早在1947年,Chaikof和Hanahan在胡萝卜和白菜的提取物中首次分离出具有活性的PLD,之后在棉花籽、蓖麻籽、花生中也分离出PLD[7-8]。此后又有40多种植物的PLD被确认[9]。到目前为止已经发现PLD存在于病毒、原核生物、真核生物中[10]。在生长条件下,植物会受到各种环境胁迫,在已经报道的PLD中,磷脂酶Dα(PLDα)可能在植物应对各种胁迫中起关键作用[11],其在抗冷害胁迫中发挥着尤为重要的作用[12-13]。其水解产物磷脂酸可以作为第二信使,参与信号的传导。在各种环境胁迫如冷害、干旱、高盐、营养不良、病虫害等逆境条件下,PLD能产生激活细胞内与抗性有关的细胞生理反应,从而对环境胁迫做出应答[14-15]。除此之外,在生长、发育等过程中,PLD都能被激活[16-18]。
目前,关于PLDα的许多机理尚不完全清楚,在体外重组PLDα蛋白对于了解桃果实环境适应性与后熟机理发挥着非常重要的作用,本试验借助分子生物学手段,体外表达了PLDα蛋白,并对其进行了生物学分析,探究冷信号对PLDα基因表达的影响,以期为下一步深入研究桃果实的环境适应性奠定基础。
1 材料与方法
1.1 试验材料
桃果实(PrunuspersicaL.Batsch, cv. Feicheng)采摘于山东省泰安市肥城桃园镇肥城桃基地。从长势良好的植株上随机采摘尺寸接近且无机械损伤的七成熟桃果实,并立刻运回实验室,4 ℃下预冷24 h后,分别置于常温(25 ℃)和低温(0 ℃)贮藏,常温储藏的样品隔天取样,低温储藏的样品按周取样(每周1次),样品切块并立即用液氮处理,之后置于-80 ℃环境保存。
感受态大肠杆菌E.coliDH5α、表达载体pET-30a均来源于本实验室。克隆载体pMD18-T Vector购买于TaKaRa公司。表达菌种Transetta(DE3)购买于北京全式金公司。
试验所用引物均由华大基因科技公司合成(表1)。
表1试验所用PCR引物及序列
Table1PCRprimersandsequencesusedintheexperiment
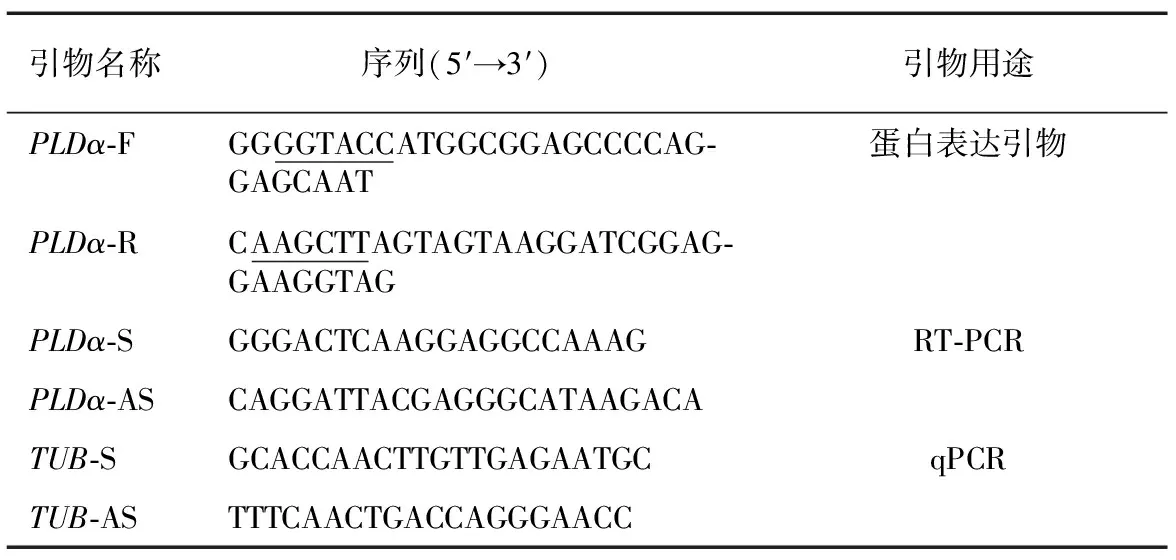
引物名称 序列(5′→3′)引物用途PLDα⁃FGGGGTACCATGGCGGAGCCCCAG⁃GAGCAAT蛋白表达引物PLDα⁃RCAAGCTTAGTAGTAAGGATCGGAG⁃GAAGGTAGPLDα⁃SGGGACTCAAGGAGGCCAAAGRT⁃PCRPLDα⁃ASCAGGATTACGAGGGCATAAGACATUB⁃SGCACCAACTTGTTGAGAATGCqPCRTUB⁃ASTTTCAACTGACCAGGGAACC
GGTACC为KpnI酶切位点;AAGCTT为Hind III酶切位点。
1.2 试验方法
1.2.1PLDα生物信息学分析 在NCBI (National center for biotechnology information)的GenBank中检索,得到桃果实PLDα基因碱基序列及其编码的蛋白质氨基酸序列,用在线网站工具对PLDα蛋白进行二维结构(https://bioinf.cs.ucl.ac.uk/psipred)和三维结构(http://www.swissmodel.expasy.org/)模拟,使用MEGA 4.1软件对桃果实PLDα蛋白与其他植物PLDα蛋白氨基酸序列进行进化关系分析,并构建系统进化树。利用ProtParam tool(http://web.expasy.org/protparam/)分析蛋白质的理化性质以及亲水性。
1.2.2 肥城桃果实总RNA的提取及第一链cDNA的合成 用改良CTAB法[19]提取桃果实总RNA,超微量紫外可见分光光度计检验其纯度及完整性。使用宝生物公司反转录试剂盒合成第一链cDNA。
1.2.3PLDα蛋白的体外表达 根据PLDα氨基酸序列全长,使用Primer Premier 5.0软件设计带有酶切位点(KpnI和Hind III)的引物PLDα-F、PLDα-R(表1)。以cDNA为模板经过PCR获得PLDα基因的全长,PCR产物回收目的基因后与pMD18-T Vertor构建克隆载体。克隆载体与pET30a分别用KpnI和Hind III双酶切并回收后,用T4 DNA Ligase(TaKaRa)连接回收片段,构建重组质粒pET30a-PLDα,将重组质粒导入表达菌株Transetta(DE3)中,双酶切验证和菌液PCR验证后诱导蛋白质体外表达,取100 μl上述菌液加入到50 ml液体培养基(含50 μg/L Kana)中,37 ℃恒温振荡培养至OD600为 0.4~0.6,取1 ml菌液用于聚丙烯酰胺电泳检测,向剩余菌液中加入50 μl 1 mol/L IPTG(终浓度为0.1 mmol/L),37 ℃条件下摇菌分别诱导2 h、4 h、6 h,取1 ml该菌液用于聚丙烯酰胺凝胶电泳检测。
1.2.4PLDα基因表达量检测 桃果实PLDα基因表达量的分析采用试剂盒(TaKaRa SYBR© PremixExTaq)说明书的方法,设计PLDα基因的荧光定量PCR引物以及内参引物PLDα-S、PLDα-AS、TUB-S、TUB-AS(表1),以cDNA 为模板,用BioRad CFX connect 实时荧光定量PCR仪进行荧光定量PCR检测。每个样品平行测定3次,以试验基因拷贝数与内参基因拷贝数之比作为衡量试验基因表达量的标准。
2 结果与分析
2.1 PLDα生物信息学分析
从PLDα蛋白氨基酸序列(图1)发现,该蛋白存在2个HKD基序,分别为HQKIVVVD和HTKMMIVD,两基序间隔320个氨基酸,这与标志序列相符合。借助ProtParam tool预测PLDα蛋白分子式为C4 135H6 363N1 139O1 202S26,原子总数12 865,分子量92 097.48,理论等电点5.90,理论半衰期30 h。不稳定系数为41.22,表明该蛋白不稳定。亲水性平均系数(Grand average of hydropathicity)为-0.417,预测该蛋白为疏水性蛋白。对PLDα蛋白进行二级结构预测,从图2中发现,肥城桃果实PLDα蛋白由12段α螺旋、26段β折叠和无规则卷曲交替构成。图3显示了PLDα蛋白不同角度的三维立体结构,可以发现其蛋白中心有一“洞穴”结构,这和蛋白的疏水性是相一致的。

图1 肥城桃果实PLDα氨基酸序列Fig.1 Amino acid sequence of PLDα in Feicheng peach fruits
2.2 PLDα蛋白系统进化树分析
系统进化树(图4)显示,同属蔷薇科的桃和草莓(Fragariaxananassa)在进化关系上位于同一簇分支,聚为一类,说明二者亲缘关系最近,且该基因在亲缘关系较近的物种间具有非常高的一致性。
2.3 PLDα蛋白体外表达
提取的总RNA,电泳结果如图5所示。可以看出28 S与18 S条带明亮,且28 S 与18 S 光密度之比为2.05,接近2∶1。使用微量紫外分光光度计对总RNA溶液进行浓度分析,OD280/OD260为2.01,OD260/OD230为2.00,表明所得RNA纯度较高,蛋白质及有机物含量较低,可以利用提取的RNA反转录合成第一链cDNA。
重组质粒pET30a-PLDα体外表达电泳结果如图6A所示,分子量约为101 000。从图6B来看诱导时间为4 h、6 h时,重组蛋白表达量均较高。
2.4 不同储藏条件下PLDα基因表达量的变化
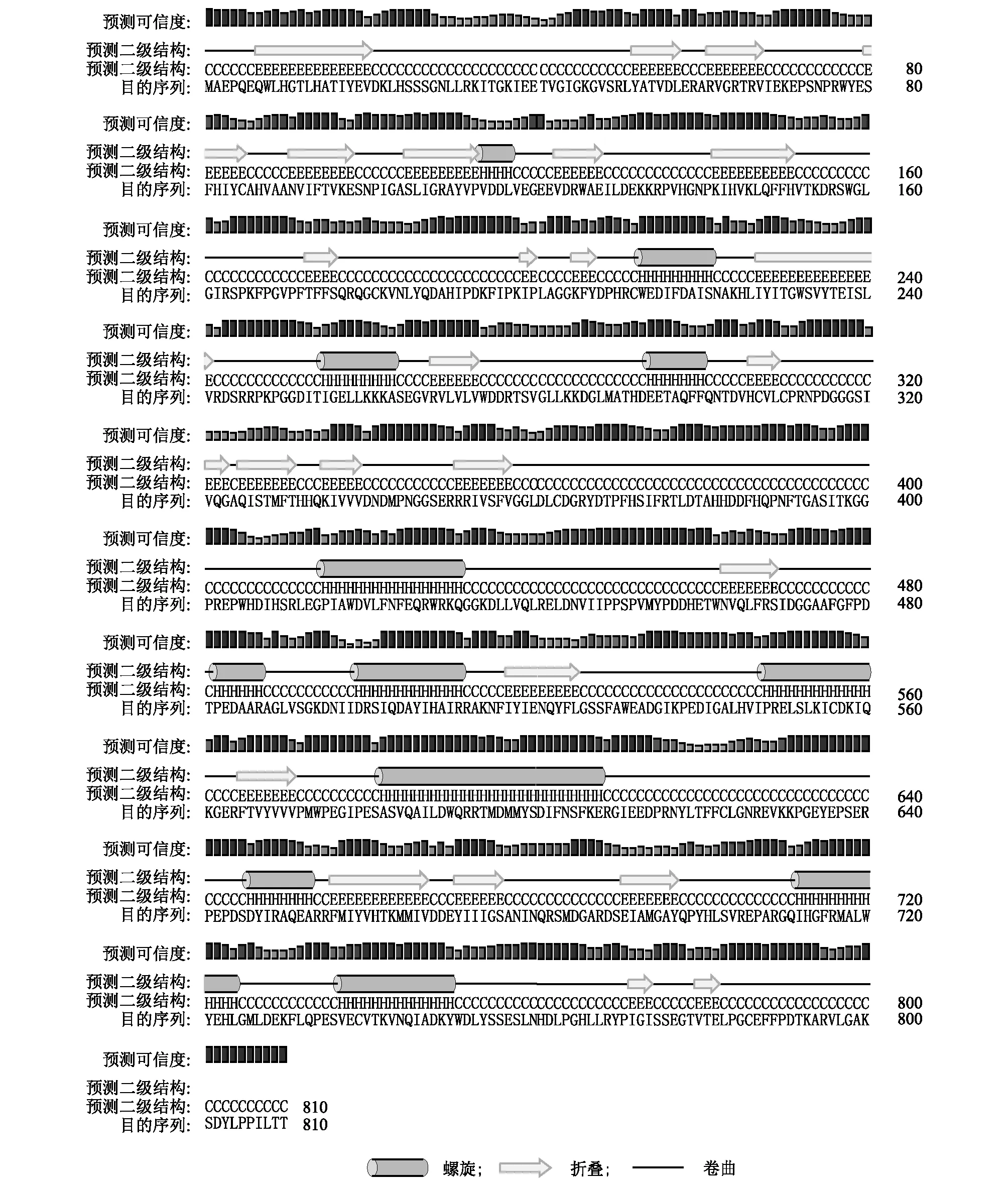
图2 PLDα蛋白二级结构预测Fig.2 Secondary structure prediction of PLDα protein
由图7可知,在常温储藏条件下,PLDα基因表达量在第6 d出现一个小高峰,之后大幅降低,在第8 d降到最低值,此时基因表达量为0 d的9.8%,在整个常温储藏过程中PLDα基因表达量是低于0 d的。在冷藏条件下,PLDα基因表达量大幅降低,1周时降到最低值,此时基因表达量为0 d的56%,之后逐渐升高,在3周达到峰值,此时基因表达量为0 d的1.4倍。在整个储藏过程中,低温条件下PLDα基因的表达水平明显高于常温储藏,可见,PLDα基因的表达受低温的调控,可能参与桃果实对低温胁迫的响应。低温储藏过程中,PLDα基因表达量出现跃升过程(第3周),常温储藏过程中,PLDα基因表达量同样出现跃升过程(第6 d),这与桃果实呼吸跃变规律相一致,可见,PLDα基因的表达可能与果实采后呼吸跃变有关。
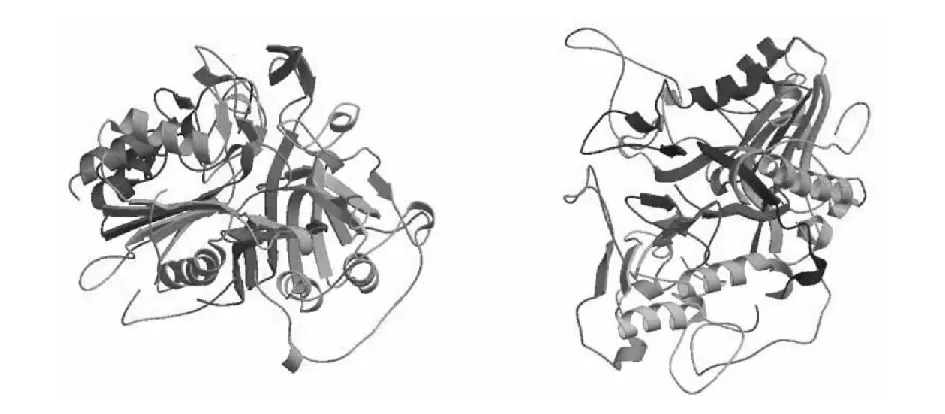
图3 PLDα蛋白三级结构预测Fig.3 Tertiary structure prediction of PLDα protein

分支上的数值表示1 000次重复计算得到的Bootstrap值。图4 肥城桃果实PLDα与其他物种PLDα系统进化树Fig.4 Phylogenetic tree of PLDα in Feicheng peach and PLDα proteins in other plants
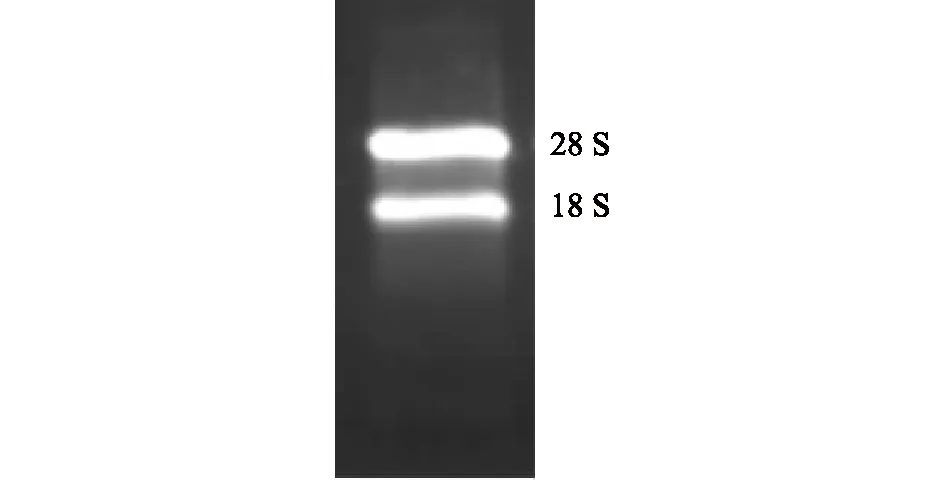
图5 桃果实总RNA 1%琼脂糖凝胶电泳Fig.5 1% agarose gel electrophoresis of total RNA in peach fruits

A: PLDα重组蛋白表达;B:PLDα重组蛋白诱导时间优化。M:低分子蛋白质分子量标准;1:含pET30a质粒,经IPTG诱导的蛋白质粗提物;2:含pET30a质粒,未诱导的蛋白质粗提物;3:含pET30a-PLDα质粒,经IPTG诱导的蛋白质粗提物;4:含pET30a-PLDα质粒,未经IPTG诱导的蛋白质粗提物;1′:pET30a-PLDα质粒经IPTG诱导2 h的蛋白质粗提物;2′、4′、6′:pET30a-PLDα质粒未经IPTG诱导的蛋白质粗提物;3′:pET30a-PLDα质粒经IPTG诱导4 h蛋白质粗提物;5′:pET30a-PLDα质粒经IPTG诱导6 h蛋白质粗提物。图6 PLDα 重组蛋白 12% SDS-聚丙烯酰氨凝胶电泳Fig.6 Analysis of recombinant PLDα protein by 12% SDS-PAGE
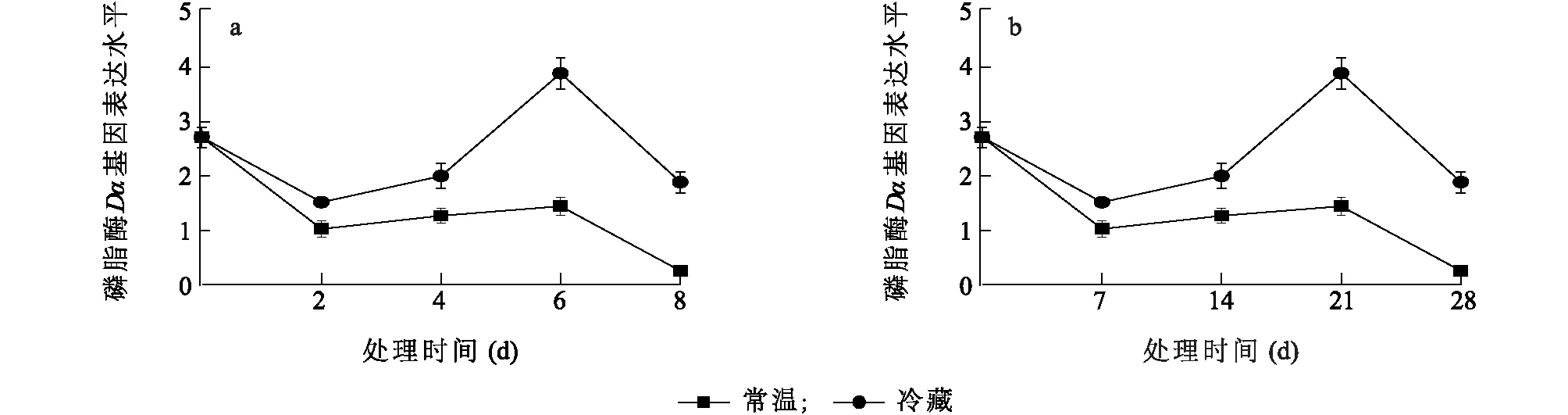
图7 常温(a)和低温(b)贮藏条件下桃果实PLDα基因表达水平Fig.7 PLDα expression level under normal(a) and low(b) temperature storage condition
3 讨 论
本试验通过GenBank检索得到PLDα的全长序列,在此基础上体外重组了pET30a-PLDα克隆载体,并在Transetta(DE3)中成功表达获得PLDα重组蛋白。对PLDα蛋白二级结构模拟可以看出该蛋白由α螺旋、β折叠和无规则卷曲构成,其中β折叠结构所占比例较大。三维结构模拟的“洞穴”结构可以很好地解释该蛋白的疏水性。而蛋白质系统进化树则表明桃果实PLDα蛋白与草莓PLDα蛋白二者亲缘关系最近,且该基因在亲缘关系较近的物种间具有非常高的一致性。从桃果实基因表达量的变化可以看出,低温储藏使PLDα基因的表达水平明显提高。
PLDα的标志序列为HKD基序,PLDα氨基酸序列中含有2个H×K××××D基序,其中H为His(组氨酸)、K为Lys(赖氨酸)、D为Asp(天冬氨酸),HKD1和HKD2之间相距约320个氨基酸,同时HKD基序也是催化水解的活性部位[20]。而其催化水解产物磷脂酸(PA)能够参与植物对环境胁迫的应答。对PLDα氨基酸序列分析结果表明,本试验体外表达的蛋白质氨基酸序列同样存在2个HKD基序(HQKIVVVD和HTKMMIVD),两基序中间包含320个氨基酸,这与标志序列相符合。由此可以证明,PLDα在植物应对环境胁迫中起着重要的作用。康虹丽等[21]对蒙古冰草的研究结果表明,PLDα分布在细胞质、细胞核的可能性分别为56.5%和21.7%,而分布在液泡中的可能性仅为4.3%,PLD酶类含有具有催化活性的N端和负责感受信号刺激的C端。
有研究结果表明,PLD几乎在植物所有的生命阶段及对环境胁迫的应答中起着重要的作用[22]。不同PLD的功能可以是独特的也可以是重叠的,这取决于具体的环境胁迫,根据不同的环境胁迫,不同的PLD会表现出各自的功能。PLDα与植物应对低温胁迫密切相关[23],同时也能促进气孔闭合并减少水分流失。本试验实时荧光定量PCR结果表明,低温能提高PLDα基因mRNA基因表达水平,Mao等[24]对冷胁迫下黄瓜果实PLD基因研究结果表明PLD在黄瓜响应冷胁迫过程中起重要作用,由此推测PLDα可能以信号分子的身份参与果实对冷胁迫的感应与识别。PLDα基因表达水平与桃果实呼吸跃变的特性两者变化是一致的,由此推测桃果实PLDα基因表达特征与桃呼吸跃变的特性可能有关。关于PLDα响应低温胁迫的机理研究尚在进行中,本试验研究结果为深入研究桃果实的耐冷性和低温贮藏奠定了理论基础。
参考文献:
[1] SUN Y, GU X, SUN K, et al. Hyperspectral reflectance imaging combined with chemometrics and successive projections algorithm for chilling injury classification in peaches [J]. LWT-Food Science and Technology, 2017,75: 557-564.
[2] JIN P, WANG K, SHANG H, et al. Low-temperature conditioning combined with methyl jasmonate treatment reduces chilling injury of peach fruit [J]. Journal of the Science of Food and Agriculture, 2009,89(10): 1690-1696.
[3] WANG K, YIN X R, ZHANG B, et al. Transcriptomic and metabolic analyses provide new insights into chilling injury in peach fruit [J]. Plant, Cell & Environment, 2017,40(8): 1531-1551.
[4] LURIE S, CRISOSTO C H. Chilling injury in peach and nectarine [J]. Postharvest Biology and Technology, 2005,37(3): 195-208.
[5] PAN L, ZHANG Q, ZHANG W, et al. Detection of cold injury in peaches by hyperspectral reflectance imaging and artificial neural network [J]. Food Chemistry, 2016,192: 134-141.
[6] JANG J H, LEE C S, HWANG D, et al. Understanding of the roles of phospholipaseDand phosphatidic acid through their binding partners [J]. Progress in Lipid Research, 2012,51(2): 71-81.
[7] HANAHAN D J, CHAIKOFF I L. A new phospholipide-splitting enzyme specific for the ester linkage between the nitrogenous base and the phosphoric acid grouping [J]. Journal of Biological Chemistry, 1947,169(3): 699-705.
[8] HANAHAN D J, CHAIKOFF I L. On the nature of the phosphorus-containing lipids of cabbage leaves and their relation to a phospholipide-splitting enzyme contained in these leaves [J]. Journal of Biological Chemistry, 1948,172(1): 191-198.
[10] SELVY P E, LAVIERI R R, LINDSLEY C W, et al. PhospholipaseD: enzymology, functionality, and chemical modulation [J]. Chemical Reviews, 2011,111(10): 6064-6119.
[11] BARGMANN B O R, LAXALT A M, RIET B, et al. MultiplePLDs required for high salinity and water deficit tolerance in plants [J]. Plant and Cell Physiology, 2009,50(1): 78-89.
[12] WELTI R, LI W, LI M, et al. Profiling membrane lipids in plant stress responses role of phospholipaseDαin freezing-induced lipid changes in Arabidopsis [J]. Journal of Biological Chemistry, 2002,277(35): 31994-32002.
[13] YANG N, DING F X, WU G F, et al. PhospholipaseDαfrom Chorispora bungeana: cloning and partial functional characterization [J]. Plant Growth Regulation, 2015,75(2): 511-520.
[14] HONG Y, ZHANG W, WANG X. PhospholipaseDand phosphatidic acid signalling in plant response to drought and salinity [J]. Plant, Cell & Environment, 2010,33(4): 627-635.
[15] HOU Q, UFER G, BARTELS D. Lipid signalling in plant responses to abiotic stress [J]. Plant, Cell & Environment, 2016,39(5): 1029-1048.
[16] LU S, YAO S, WANG G, et al. PhospholipaseDεenhances Braasca napus growth and seed production in response to nitrogen availability [J]. Plant Biotechnology Journal, 2016,14(3): 926-937.
[17] PETERS C, LI M, NARASIMHAN R, et al. Nonspecific phospholipaseCNPC4 promotes responses to abscisic acid and tolerance to hyperosmotic stress in Arabidopsis [J]. The Plant Cell, 2010,22(8): 2642-2659.
[18] LI G, XUE H W. ArabidopsisPLDζ2 regulates vesicle trafficking and is required for auxin response [J]. The Plant Cell, 2007,19(1): 281-295.
[19] 陈长宝,朱树华,周 杰. 改良CTAB法提取成熟肥城桃果实的总RNA [J]. 山东农业科学, 2009(5): 102-104.
[20] 王俊斌,李 明,丁 博,等. 小麦磷脂酶Dα的基因克隆及其编码序列的生物信息学分析 [J]. 华北农学报, 2013,28(1): 117-122.
[21] 康虹丽. 蒙古冰草磷脂酶D基因全长cDNA 序列的克隆及生物信息学分析 [D]. 呼和浩特:内蒙古农业大学, 2008.
[22] HONG K, ZHANG L, ZHAN R, et al. Identification and characterization of phospholipaseDgenes putatively involved in internal browning of pineapple during postharvest storage [J]. Frontiers in Plant Science, 2017,8: 913.
[23] 王海燕,孙 磊. 磷脂酶D调控植物抗逆性的机理研究进展 [J]. 中国农学通报, 2011,27(21): 13-17.
[24] MAO L, PANG H, WANG G, et al. PhospholipaseDand lipoxygenase activity of cucumber fruit in response to chilling stress [J]. Postharvest Biology and Technology, 2007,44(1): 42-47.

