不同肿瘤患者放疗前后LPA水平的变化及放疗对肿瘤患者血浆LPA的影响
张尧天
LPA又称磷脂信使,具有多项功能,在肿瘤等多种重大疾病的发生发展中占有极为重要的地位[1]。本研究探讨了不同肿瘤患者放疗前后LPA水平的变化及放疗对肿瘤患者血浆LPA的影响,现报告如下。
1 材料与方法
1.1 一般资料
选取我院2014年5月至2016年5月收治的肿瘤患者120例,纳入标准:所有患者均经影像学、病理组织学及细胞学方法确诊为肿瘤,预计生存期均在半年以上,均知情同意;排除标准:将有血液方面的基础疾病等患者排除在外。依据肿瘤类型将这些患者分为原发性脑肿瘤组(n=40)、转移性脑肿瘤组(n=40)和非脑肿瘤组(n=40)三组。原发性脑肿瘤组患者中男性28例,女性12例,年龄40~80岁,平均(60.2±10.3)岁。在疾病类型方面,30例患者为胶质瘤,8例患者为脑膜瘤,2例患者为垂体瘤;转移性脑肿瘤组患者中男性26例,女性14例,年龄41~80岁,平均(61.4±10.2)岁。在疾病类型方面,25例患者为肺癌脑转移,10例患者为乳腺癌脑转移,3例患者为卵巢癌脑转移,2例患者为胃癌脑转移;非脑肿瘤组患者中男性27例,女性13例,年龄40~79岁,平均(60.5±10.0)岁。在疾病类型方面,20例患者为肺癌,7例患者为喉癌,5例患者为食管癌,5例患者为直肠癌,3例患者为前列腺癌。三组患者的一般资料比较差异均不显著(P>0.05),具有可比性。
1.2 方法
采用直线加速器(美国瓦里安公司)对三组患者进行外照射放疗,将三维适形或调强放疗充分利用起来,常规分割,每次200 cGy,每周5次。放疗前后分别运用液态色谱法及相关试剂盒(北京九强生物技术有限公司)对三组患者的血浆溶血磷脂酸(LPA)水平进行测定,同时应用CAL-8000血常规分析仪(mindray迈瑞公司)对三组患者的血小板、白细胞计数进行测定。完成放疗后1个月内对三组患者的颅脑CT及MRI进行复查,将肿瘤控制率计算出来。
1.3 疗效评定标准
如果治疗后患者的肿瘤完全消失,则评定为完全缓解;如果治疗后患者的肿瘤体积缩小了一半及以上,则评定为部分缓解;如果治疗后患者的肿瘤体积没有显著变化,则评定为疾病稳定;如果治疗后患者的肿瘤体积增大,则评定为疾病进展[2]。
1.4 统计学分析
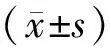
2 结果
2.1 三组患者放疗前后的血浆LPA水平、血小板计数、白细胞计数变化情况比较
转移性脑肿瘤组、非脑肿瘤组患者放疗后的血浆LPA水平均显著低于放疗前(P<0.05),但原发性脑肿瘤患者放疗前后的血浆LPA水平之间的差异不显著(P>0.05),三组患者放疗后的血小板计数、白细胞计数均显著低于放疗前(P<0.05)。
放疗前原发性脑肿瘤组、转移性脑肿瘤组患者的血浆LPA水平均显著低于非脑肿瘤组(P<0.05),但原发性脑肿瘤组、转移性脑肿瘤组患者的血浆LPA水平之间的差异不显著(P>0.05),转移性脑肿瘤组患者的血小板计数显著低于原发性脑肿瘤组、非脑肿瘤组(P<0.05),白细胞计数显著高于原发性脑肿瘤组、非脑肿瘤组(P<0.05),但原发性脑肿瘤组、非脑肿瘤组患者间血小板计数、白细胞计数差异均不显著。
放疗后原发性脑肿瘤组患者的血浆LPA水平显著高于转移性脑肿瘤组、非脑肿瘤组(P<0.05),但转移性脑肿瘤组与非脑肿瘤组患者的血浆LPA水平比较差异不显著(P>0.05),原发性脑肿瘤组与转移性脑肿瘤组患者的血小板计数、白细胞计数均显著高于非脑肿瘤组,但原发性脑肿瘤组与转移性脑肿瘤组患者的血小板计数、白细胞计数差异不显著(表1)。

表1 三组患者放疗前后的血浆LPA水平、血小板计数、白细胞计数变化情况比较
注:与同组治疗前比较,#为P<0.05;与转移性脑肿瘤组比较,△为P<0.05;与非脑肿瘤比较,*为P<0.05。
2.2 三组患者临床疗效比较
原发性脑肿瘤组患者的总缓解率[2.5%(1/40)]显著低于转移性脑肿瘤组、非脑肿瘤组[92.5%(37/40)、85.0%(34/40)](P<0.05),但转移性脑肿瘤组与非脑肿瘤组患者间缓解率比较差异不显著(P>0.05),具体见表2。
3 讨论
LPA属于1种脂类信号分子,类生长因子,将多种生物学效应产生出来的途径为通过细胞表面的G蛋白耦联受体[3]。现阶段,相关医学研究表明[4],G蛋白介导的多条信号通路是LPA的1个极为重要的作用途径。同时,非蛋白介导的信号转导过程也是LPA的1个作用途径,LPA在各种信号转导途径的基础上对细胞各项生理及病理活动进行调控。相关医学研究表明[5],乳腺肿瘤、肾肿瘤等中均具有LPA过表达,从而为肿瘤的浸润及转移提供良好的前提条件。此外,LPA还能够为卵巢癌细胞的浸润及转移提供良好的前提条件。也有相关医学研究表明[6],在卵巢癌、胃癌等肿瘤组织中,LPA受体表达异常,同时LPA结合不同受体后具有不同的反应,但是均能够对癌细胞的迁移、增殖、对血管生成因子的分泌等进行刺激。

表2 三组患者的临床疗效比较(例,%)
注:与转移性脑肿瘤组比较,△为P<0.05;与非脑肿瘤组比较,*为P<0.05。
在多种肿瘤的诊断及预后判断中,血浆LPA及其受体检测均具有一定的临床意义。相关医学研究表明[7],在妇科恶性肿瘤的诊断中,LPA属于1项生物学指征,尤其是在早期诊断卵巢癌的过程中,和糖链抗原CA125相比,其具有更高的敏感性,在卵巢恶性上皮性肿瘤的诊断中,其有望成为1项新的检测标志物及术后检测指标。相关医学学者测定了上皮性卵巢癌患者、健康人员的血浆LPA水平[8],发现术前和健康人员相比,上皮性卵巢癌患者具有明显较高的血浆LPA水平,在上皮性卵巢癌的诊断中,其灵敏度、特异度分别为91.1%、92.6%。相关医学学者对胃恶性上皮性肿瘤患者的LPA水平进行了检测,发现胃恶性上皮性肿瘤患者具有显著较高的血浆LPA水平,在胃恶性上皮性肿瘤的诊断中,和癌胚抗原相比,LPA具有较高的敏感度及特异度,有望成为一项特异性指标。
本研究结果表明,原发性脑肿瘤组患者的血浆LPA水平显著高于转移性脑肿瘤组、非脑肿瘤组(P<0.05),原发性脑肿瘤组、转移性脑肿瘤组患者的血小板计数、白细胞计数均显著高于非脑肿瘤组(P<0.05),原发性脑肿瘤组患者的总缓解率显著低于转移性脑肿瘤组、非脑肿瘤组(P<0.05),说明在肿瘤患者放疗疗效及预后的判定中,LPA水平可以作为1项重要的监测指标。此外,肿瘤的生长及进展也受到LPA水平提升的一定程度影响。放疗对原发性脑肿瘤、转移性脑肿瘤患者的血液系统具有较小的影响,对非脑肿瘤患者的血液系统具有较大的影响,但是目前临床还没有统一其对血浆LPA变化的影响,需要相关医学研究进一步验证。从总体上来说,在肿瘤预后的诊断及预测中,LPA作为1种肿瘤标志物具有生物学效应,其生物学作用的特异性较高,同时将作用充分发挥出来的途径为以受体依赖方式。由于在肿瘤生长中,LPA具有多重功能,因此临床已经将研究的热点放在以LPA及其受体为靶点的肿瘤治疗,临床有效治疗肿瘤的途径为将LPA的合成及代谢途径阻断,对LPA受体活性及其信号转导进行调节。
总之,转移性脑肿瘤、非脑肿瘤患者放疗后LPA水平均显著低于放疗前,肿瘤患者的放疗疗效能够在血浆LPA水平中得到有效反映,值得临床充分重视。
[1] 郭红燕,韩劲松,伍期专,等.血浆溶血磷脂酸在卵巢上皮性癌诊断中的应用初探〔J〕.中国妇产科临床杂志,2002,3(1):36-38.
[2] 肖焕擎,杨 洁,孙 政,等.溶血磷脂酸在胃恶性上皮性肿瘤患者巾表达及意义〔J〕.临床和实验医学杂志,2008,7(1):75-76.
[3] 马 睿.溶血磷脂酸受体及其信号转导〔J〕.生物化学与生物物理学进展,2000,27(1):48-52.
[4] 徐文生,黄艳丽,蒙玉刚,等.卵巢恶性上皮性肿瘤血浆溶血磷脂酸与CAl25诊断价值的对比观察〔J〕.中华肿瘤防治杂志,2008,15(11):840-842.
[5] 王 鹤,陈道桢.血浆溶血磷脂酸测定在卵巢癌患者诊断中的价值〔J〕.放射免疫学杂志,2008,21(4):355-357.
[6] 劳 明,潘忠勉,黄文成,等.血浆溶血磷脂酸检测在妇科恶性肿瘤诊断中的应用研究〔J〕.实用癌症杂志,2007,22(4):347-349.
[7] 陈亚楠,陶 敏,涂福平,等.卵巢上皮癌患者血浆LPA和IL-6、IL-8水平的检测分析〔J〕.实用癌症杂志,2008,23(6):580-582.
[8] Andrew N Fontanella,Mary-Keara Boss,Michael Hadsell,et al.Effects of High-Dose Microbeam Irradiation on Tumor Microvascular Function and Angiogenesis〔J〕.Radiat Res,2015,183 (2):147-158.

