超高效液相色谱-串联质谱法测定蜂蜜中抗生素和农药浓度
汪建妹,杨华,曾银欢,吴俐勤,李锐,袁玉伟,钱鸣蓉
(浙江农业科学院 农产品质量标准研究所, 浙江 杭州 310014)
蜂蜜具有抗氧化性、抗菌性、提高免疫力等生物活性,是一种食疗佳品和天然药品,不仅有调节机体生理机能、消除疲劳、抗衰老等功效,而且还可以辅助治疗和抵抗多种疾病,促进人们健康长寿. 目前我国以农户散养的传统养蜂方式为主,当蜜蜂感染疾病或受到害虫侵害时,蜂农为了控制病害而出现滥用抗生素和农药的情况. 同时,蜜源作物上使用的农药也可能通过蜜蜂的采蜜迁移至蜂蜜中,导致蜂蜜中存在农兽药残留. 国内外均有文献报道蜂蜜样品中存在抗生素或农药残留情况,如CUI 等[1]在蜂蜜样品中检出了诺氟沙星、环丙沙星和氧氟沙星,浓度分别为10.0,8.9,9.9 μg·L-1;LI等[2]采用气相色谱串联质谱法比较了2种不同的前处理分析方法测定蜂产品中的多种农药,并检出了蝇毒磷,其浓度高达221.97 ng·kg-1(干重计); KUJAWSKI等[3]采用液相色谱串联质谱法测定波兰蜂蜜中13种农药,其中40种样品检出35种,甚至1种样品中检出了5种农药. 食用这些含农兽药残留的蜂蜜,对人体健康存在潜在风险,因此,蜂蜜质量安全引起了人们的广泛关注,需要对蜂蜜中的危害因子进行风险评估.
目前,蜂蜜中农兽药残留的检测技术主要有: 液相色谱法[4-5]、气相色谱法[6]、液相色谱质谱联用法[7-10]、气相质谱色谱联用法[12-13]、微生物法[14]、酶联免疫法[15]、生物芯片技术[16]等. 其中,液质技术、气质技术因其具有较高的灵敏度、准确度和精确度,广泛应用于农兽药的多残留检测分析中. 蜂蜜中多残留检测前处理方法主要有液液萃取法、固相萃取法[8]、固相分散萃取法[7,9-10,12]等. 本研究采用通过式的固相萃取法快速净化蜂蜜样品,使用超高效液相色谱串联质谱测定39种抗生素和25种农药,操作简单、快速方便、灵敏度高,与已报道的蜂蜜中多残留检测方法相比,本方法测定的药物种类更多、涵盖参数更全,且适合大批量样品的筛查与监测. 本方法监测了市售蜂蜜样品中的抗生素与农药残留情况,并采用蒙特卡罗模拟分析法对蜂蜜中有害残留因子进行了风险评估[17],为居民膳食暴露风险评估提供了科学的分析结果.
1 材料与方法
1.1 试剂材料与设备
标准物质: 39种抗生素: 氯霉素、螺旋霉素(SPI)、替米考星(TIL)、泰乐菌素(TYL)、竹桃霉素(OLE)、北里霉素(KIT)、红霉素(ERY)、交沙霉素(JOS)、罗红霉素(ROX)、恩诺沙星(ENR)、环丙沙星(CIP)、诺氟沙星(NOR)、氧氟沙星(OFL)、氟甲喹(FLU)、噁喹酸(OXO)、双氟沙星(DIF)、沙拉沙星(SAR)、司帕沙星(SPA)、达氟沙星(DAN)、氟罗沙星(FLE)、马坡沙星(MAR)、伊诺沙星(ENO)、奥比沙星(ORB)、吡哌酸(PIP)、培氟沙星(PEF)、洛美沙星(LOM)、西诺沙星(CIN)、萘啶酸(NAL)、甲硝唑(MNZ)、甲硝唑代谢物(MNZOH)、二甲硝咪唑(DMZ)、二甲硝咪唑代谢物(HMMNI)、洛硝哒唑(RNZ)、异丙硝唑(IPZ)、异丙硝唑代谢物(IPZOH)、土霉素(OTC)、四环素(TC)、金霉素(CTC)、强力霉素(DC);25种农药: 吡螨胺(TBF)、噻螨酮(HTZ)、蝇毒磷(CMP)、哒螨灵(PDB)、克螨特(PPG)、螺螨酯(SPD)、唑螨酯 (FPM)、三环唑 (TCZ),戊菌唑 (PCZ),腈菌唑 (MCT),环丙唑醇 (CPZ),烯效唑 (UCZ),多效唑 (PBZ),三唑酮 (TDF),三唑醇 (TDN), 戊唑醇 (TBZ),己唑醇 (HXZ),氟硅唑 (FLZ),灭菌唑 (TTZ),氟环唑 (EPZ),腈苯唑 (FBZ),联苯三唑醇 (BTT),苯醚甲环唑 (DFZ),糠菌唑同分异构体 (BMZ),纯度均大于98%,Dr. Ehrenstorfer 公司,德国.
试剂材料: 乙腈和甲醇为色谱纯(Merck);甲酸为色谱纯(中国华东医药公司);Milli-Q system超纯水仪(美国Millipore 公司);Oasis PRiME HLB 固相萃取柱(6 cc 200 mg)(美国Waters公司).
仪器设备: 6500 Qtrap线性离子阱质谱仪(美国AB公司),超高压液相色谱(岛津,日本)配置SIL-30AC 自动进样器和 DGU-20A5r高压泵.
1.2 试剂配制
准确称取按其纯度折算为100%质量的标准物质各10.0 mg,分别用甲醇溶解并定容至50 mL,浓度为200 mg·L-1,储备液于-20℃储存,有效期为3个月. 用空白样品提取液配成不同浓度的基质混合标准工作溶液,混合标准工作溶液于4℃保存,现配现用.
1.3 样品前处理方法
准确称取1.0 g蜂蜜样品于15 mL离心管中,加入5 mL乙腈+水(v/v=8: 2),涡旋1 min,使样品与提取试剂混匀. 然后离心管在7 000 r·min-1的转速下离心5 min,取2.5 mL上清液过PRiME HLB柱,并接收流出液. 收集液经0.22 μm有机相滤膜后,用UPLC-MS/MS进行分析.
1.4 液质分析条件
色谱柱: BEH C18柱 (2.1 mm×100 mm,1.7 μm) (Waters,USA);柱温: 40℃;流动相A: 2 mmol·L-1甲酸铵溶液(含0.1%甲酸),流动相B: 甲醇(含2 mmol·L-1甲酸铵溶液+0.1%甲酸). 液相色谱梯度洗脱条件: 0~1.5 min,5% B;1.5~3.5 min,5%~25% B;3.5~5 min,25% B;5~9 min,80% B;9~14 min,80%~100% B;14~20 min,100% B;20~23 min,100%~5% B;23~25 min,5% B. 流速: 0.20 mL· min-1; 进样体积: 5 μL. 质谱条件: ESI (+),离子源温度: 550℃,喷雾电压: 5.5 kV;ESI (-),离子源温度: 400℃,喷雾电压: -4.0 kV. 气帘气: 40 psi,gas1: 55 psi,gas2: 50 psi. 其他质谱参数,如母离子(Q1),子离子(Q3),碰撞能量和去簇电压见表1.

表1 64种化合物的质谱参数
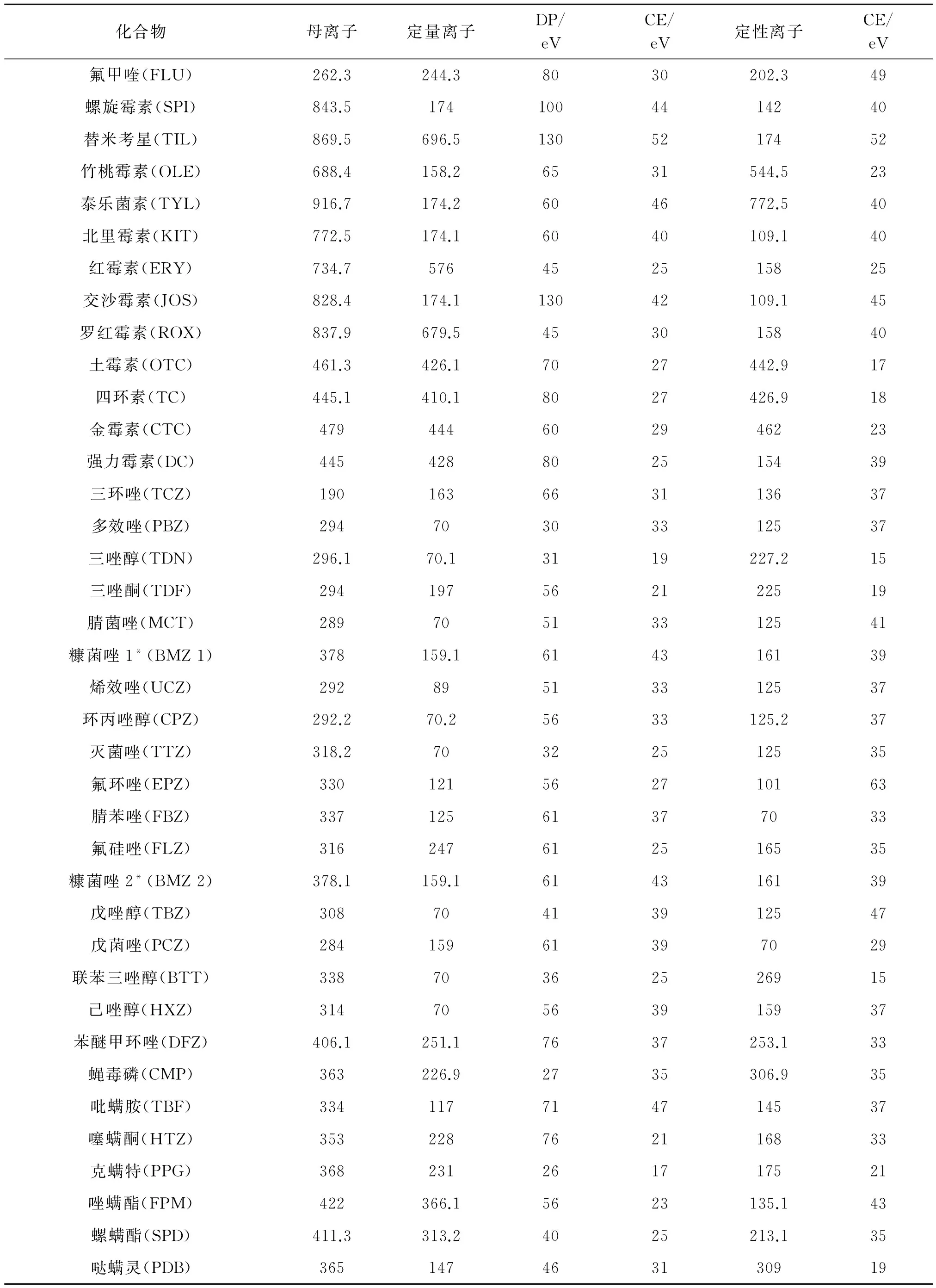
(续表1)
* 糠菌唑1和糠菌唑2分别表示在色谱柱上流出的1号异构体和2号异构体.
2 膳食暴露评估方法
运用软件@Risk (Palisade Corporation, Version5.0,NY,USA),采用Monte Carlo模拟法对蜂蜜中危险因子进行评估,利用食品消费数据、消费者的生理数据和食品中有害因子的残留浓度数据,计算暴露风险值的范围及概率分布,对蜂蜜中有害物质进行不确定性风险评估. 危害因子日均膳食暴露量的计算公式为:
DIs = C×10-3×IR·BW-1,
其中,DI (mg·(kg·bw)-1·day-1)为每日暴露值,C(g·d-1) 为蜂蜜的日均摄入量,IR(mg·kg-1)为食品中危害因子的平均浓度,BW (kg) 为每个群组的平均体重,ADI为日均最大允许摄入值. 其中食品消费数据和居民的平均体重数据来源于《中国统计年鉴2012》中的中国居民膳食调查数据.
3 结果与分析
3.1 样品前处理
文中待测的多种残留化合物极性差异较大,为了使所有目标物均能被提取,需要用极性范围较大的溶剂.乙腈和水的混合物能够提供较大的极性范围,因此本方法采用80%乙腈溶剂. 比较80%乙腈与添加了0.2%甲酸的溶剂对目标化合物的提取效率. 当添加浓度为100 μg·kg-1、提取剂为80%乙腈时,39种抗生素及25种农药的回收率均在70%~120%;当提取剂为含0.2%甲酸的80%乙腈时,只有35种抗生素及20种农药的回收率在70%~120%,表明80%乙腈的回收率更好(见图1),因此选择80%乙腈作为提取溶剂.
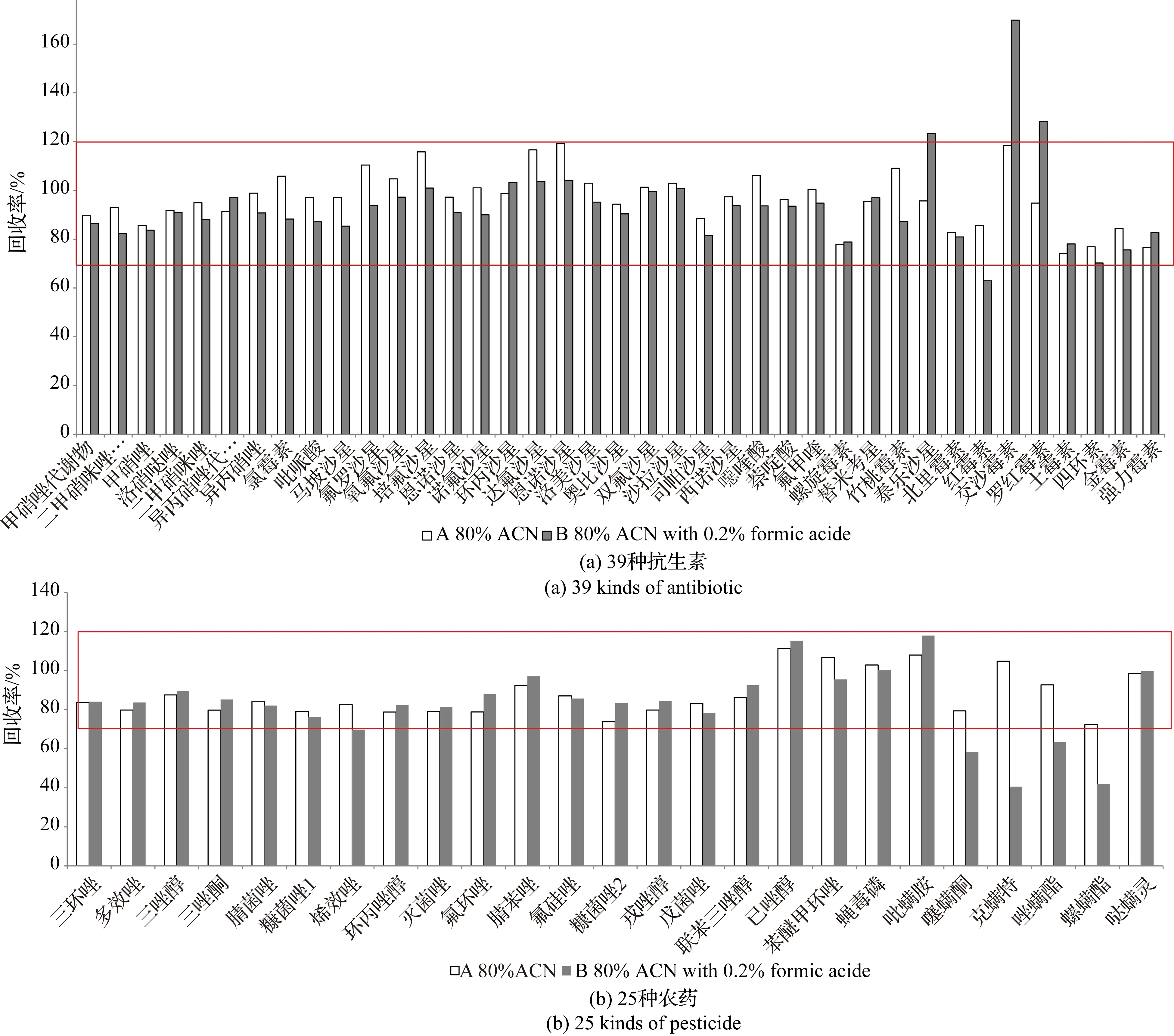
图1 采用2种提取溶剂提取后的目标物回收率分布图Fig. 1 The target distribution of recovery with two kinds of extraction solvent
3.2 基质效应、线性范围与检出限
以定量离子对峰面积为纵坐标,标准溶液浓度为横坐标,绘制标准曲线. 取混合标准中间液,用80%乙腈溶液逐级稀释配制浓度为0.01,0.05,0.1,0.5,1.0,5.0,10,50,100和200 μg·L-1的系列标准工作溶液;同时通过添加标准物质于空白基质中制备基质标准曲线,并与标准溶液曲线的响应值进行比较,分析基质效应. 结果基质校准标准工作液斜率与溶剂标准工作液斜率的比值在0.75~1.15间,部分目标物存在较大基质效应.为确保定量准确,用基质标准曲线进行定量.
氯霉素和大环内酯类药物浓度分别在0.02~200 μg·L-1和1.0~200 μg·L-1时线性关系良好,其他目标物浓度在0.1~200 μg·L-1时线性关系良好,相关系数r2>0.99.
基于目标物在样品中低档浓度的添加回收试验的定性和定量离子对响应值,以S/N为3计算检测限,S/N为10计算定量限. 硝基咪唑类药物的检出限为0.25~0.98 μg·kg-1,定量限为0.77~2.95 μg·kg-1;氯霉素的检出限为0.02 μg·kg-1,定量限为0.1 μg·kg-1;喹诺酮类药物的检出限为0.15~1.03 μg·kg-1,定量限为0.5~3.1 μg·kg-1;大环内酯类药物的检出限为0.03~3.8 μg·kg-1,定量限为0.1~11.5 μg·kg-1;四环素类药物的检出限为1.0~2.39 μg·kg-1,定量限为5.19~7.18 μg·kg-1;三唑类农药的检出限为0.18~0.76 μg·kg-1,定量限为0.5~2.29 μg·kg-1. 详见表2.
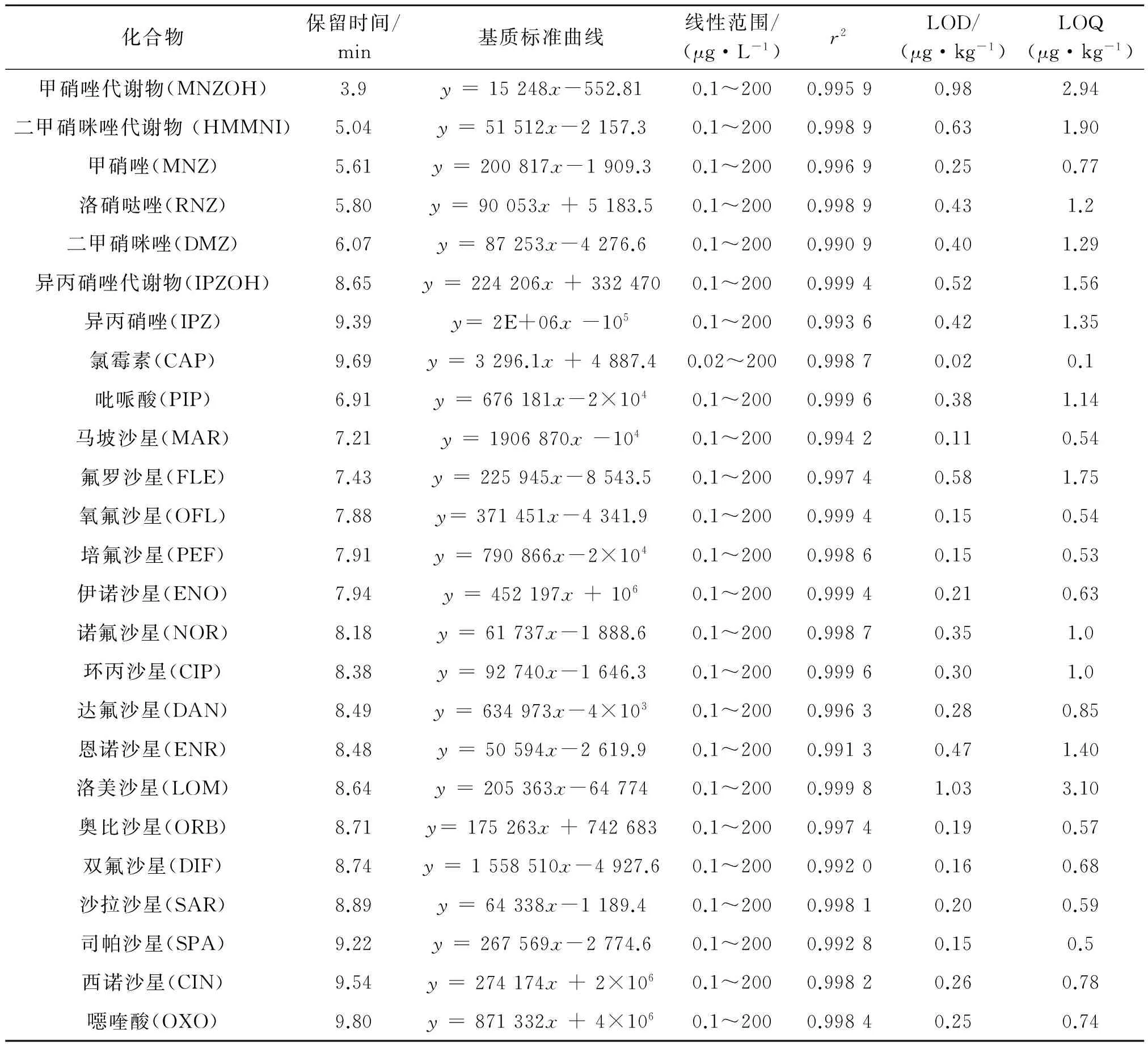
表2 方法验证参数
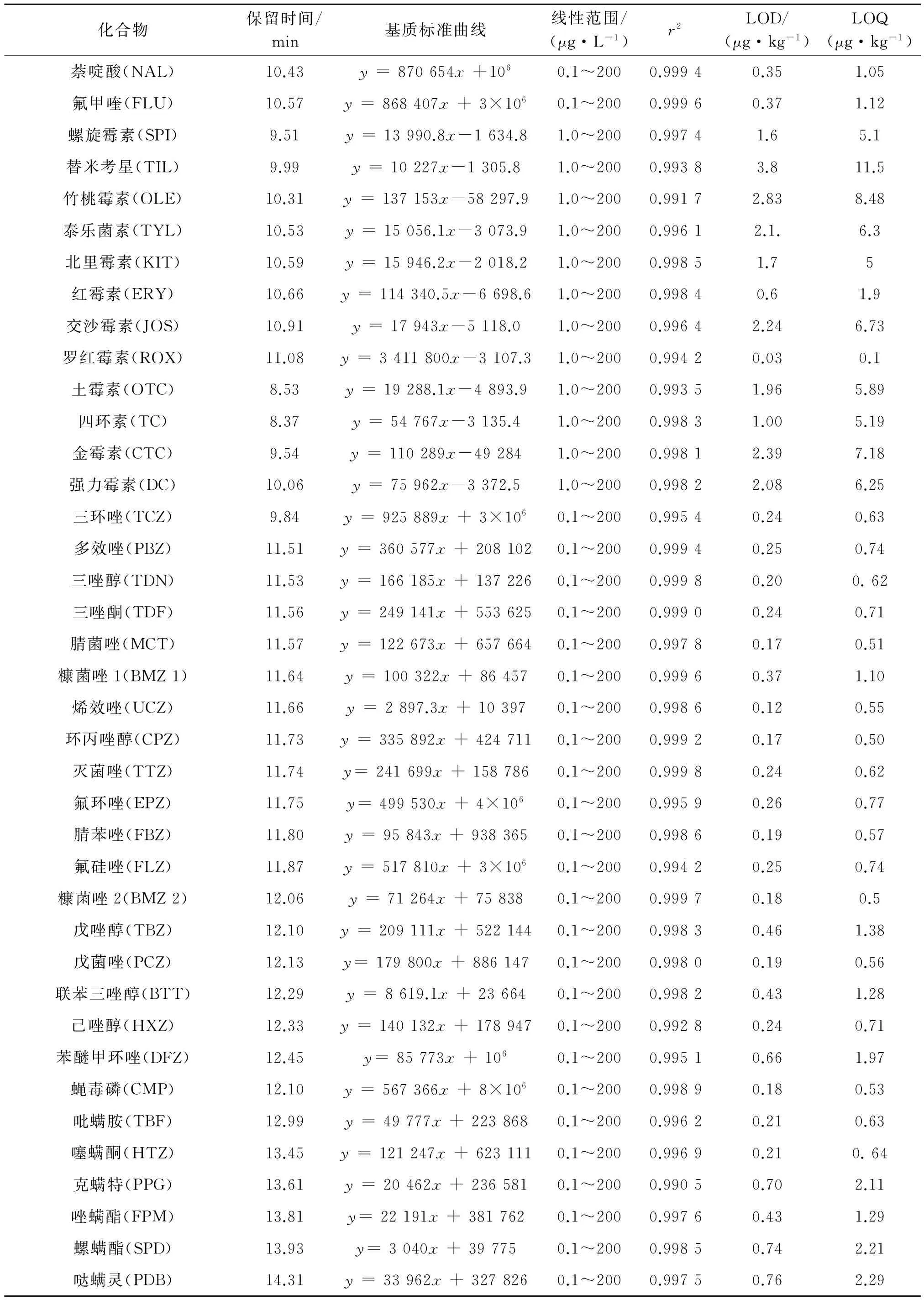
(续表2)
3.3 方法的准确度与精密度
对蜂蜜样品进行低、中、高3个水平的加标添加回收试验,以测定本方法的准确度与精密度. 根据化合物的定量限,硝基咪唑类、喹诺酮类、氯霉素和三唑类加标质量浓度分别为5,25 和50 μg·kg-1,四环素类加标质量浓度分别为10,25 和50 μg·kg-1,大环内酯类加标质量浓度分别为15,25 和50 μg·kg-1. 在3种浓度水平下,39种抗生素的回收率分别为72%~117%,73%~116% 和79%~119%,相对标准偏差分别为2.1%~13.7%,1.1%~12.7% 和0.8%~10.2%. 在3种浓度水平下,25种农药化合物的回收率分别为73%~103%,72%~109% 和79%~115%,相对标准偏差分别为2.8%~12.7%,1.7%~7.8%和 2.2%~9.7%(详细见表3). 图2为蜂蜜中39种抗生素和25种农药混合物的分离色谱图.
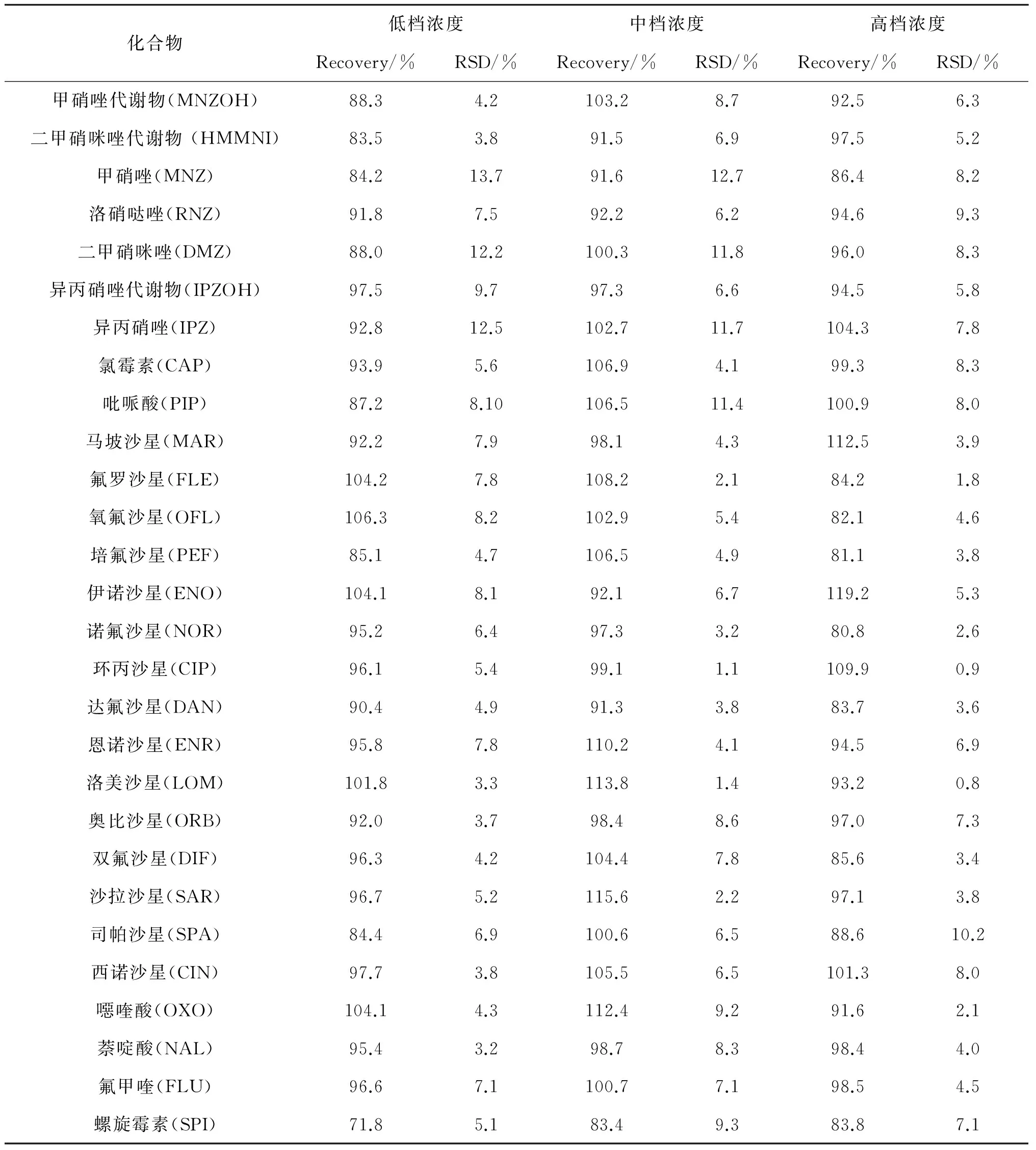
表3 蜂蜜中3种浓度水平的回收率(n = 5)
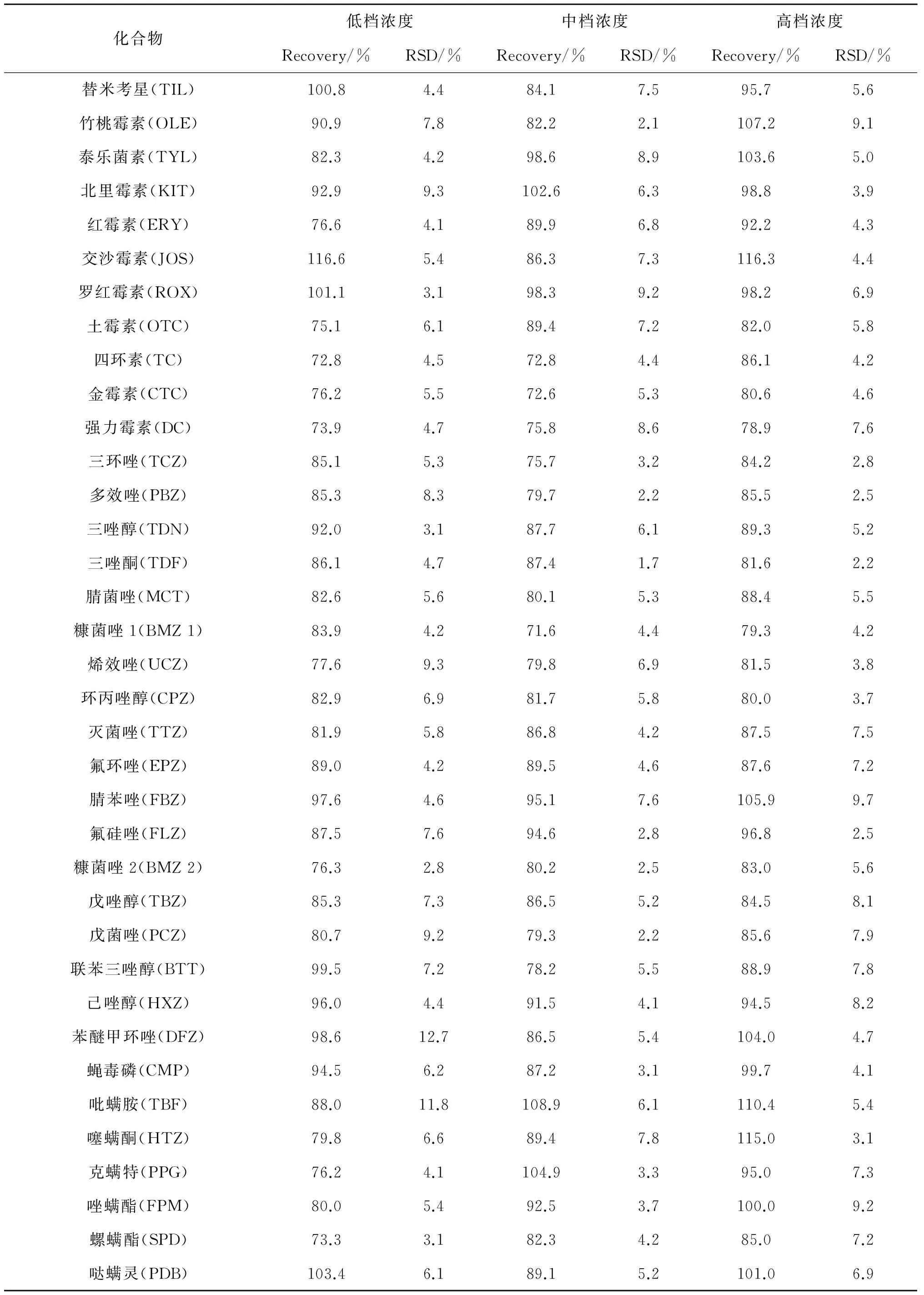
(续表3)
3.4 实际样品测定
52个蜂蜜样品均购自浙江省各超市,其中,洋槐蜜18个、百花蜜20个、枇杷蜜14个. 蜂蜜样品经过1.3节中的前处理,经LC-MS/MS测定,有9个蜂蜜样品检出有抗生素,检出率为17.3%,未检出农药. 其中3 个蜂蜜样品(百花蜜、洋槐蜜、枇杷蜜各1个)检出诺氟沙星,检出浓度分别为1 486.3,32.3和31.3 μg·kg-1;2个蜂蜜样品(百花蜜、枇杷蜜各1个)检出环丙沙星,检出浓度分别为5.9和215.1 μg·kg-1;4个蜂蜜样品(洋槐蜜、百花蜜各2个)检出罗红霉素,检出浓度分别为59.6,64.4和79.6,214.4 μg·kg-1.
3.5 膳食暴露评估
针对本实验检出的风险因子,未查到罗红霉素及诺氟沙星的ADI值. 在农业部235号公告中仅查到恩诺沙星的ADI值为0.002 mg·(kg·bw)-1·day-1,其中环丙沙星是恩诺沙星的代谢物,一般以总体计,因此本文将恩诺沙星的ADI(0.002 mg·(kg·bw)-1·day-1)用于环丙沙星的风险评估. 根据化合物结构和性质的相似性,诺氟沙星和罗红霉素的ADI值分别用与之结构和性质相似的恩诺沙星(ADI: 0.002 mg·(kg·bw)-1·day-1)和红霉素(ADI: 0.0007 mg·(kg·bw)-1·day-1)代替进行评估. 在概率模型评估分析中,将检出样品浓度作为输入值,未检出或低于定量限的样品通常用LOQ/2作为输入值,将检出和未检出样品的输入值经@Risk软件分析,可获得不同年龄组群的暴露风险.
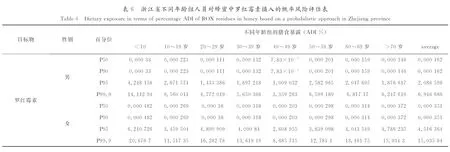
表4~表6分别为浙江省不同年龄组人员对诺氟沙星、环丙沙星和罗红霉素的概率风险评估值. 其中,3种风险因子在99.9th的位点,女性的膳食暴露风险要高于男性,10岁以下群组的膳食暴露风险要高于其他群组. 比较了3种风险因子在99.9th位点的风险值,其大小依次为诺氟沙星>罗红霉素>环丙沙星,膳食暴露风险最高分别出现在女性消费者和0~10岁群组,诺氟沙星为50.2% ADI,罗红霉素为20.7% ADI,环丙沙星为7.3% ADI. 以上%ADI值均小于100,说明膳食暴露评估风险水平尚可接受.
4 结 语
利用超高效液相色谱串联质谱技术结合通过式净化方式,可快速有效地检测蜂蜜中所含的多种抗生素及农药残留. 该方法前处理过程简单快速、经济高效. 通过对市售蜂蜜样品进行随机抽样检测,利用@Risk定量风险评估专用软件对在蜂蜜中监测到的抗生素残留数据进行处理,并对其进行膳食暴露评估,得到其ADI%小于100,不具有风险. 鉴于在计算中忽略了不同有害因子的相互作用以及其他饮食摄入等不确定因素,因此对蜂蜜中危害因子的膳食暴露评估还需要进一步研究,以确保蜂蜜的食用安全.
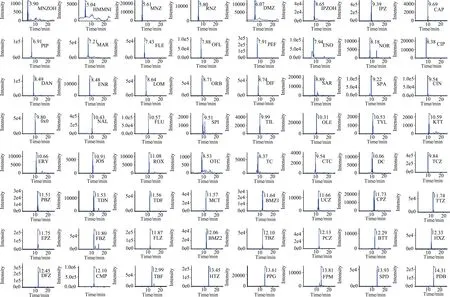
图2 蜂蜜中39种抗生素及25种农药混合物的分离色谱图Fig.2 The chromatograms of 39 kinds of antibiotics and 25 kinds of pesticides in honey
参考文献(References):
[1] CUI X, ZHANG P, YANG X, et al. β-CD/ATP composite materials for use in dispersive solid-phase extraction to measure (fluoro)quinolone antibiotics in honey samples[J].AnalyticaChimicaActa, 2015, 878: 131-139.
[2] LI Y, KELLEY R A, ANDERSON T D, et al. Development and comparison of two multi-residue methods for the analysis of select pesticides in honey bees, pollen, and wax by gas chromatography-quadrupole mass spectrometry[J].Talanta, 2015, 140: 81.
[4] 卢坤,童群义. 高效液相色谱法同时检测蜂蜜中的5类抗生素残留[J].分析测试学报,2011, 30(11): 1320-1323.
LU K, TONG Q Y. Simultaneous determination of 5 classes of antibiotics residues in honey using high performance liquid chromatography[J].JournalofInstrumentalAnalysis,2011, 30(11): 1320-1323.
[5] LI J, CHEN L, WANG X, et al. Determination of tetracyclines residues in honey by on-line solid-phase extraction high-performance liquid chromatography.[J].Talanta, 2008, 75(5): 1245-52.
[6] 周碧青,张金彪,陈万灵. 蜂蜜中8种有机磷农药残留量的气相色谱法测定[J].福建分析测试, 2012(6): 9-12.
ZHOU B Q, ZHANG J B,CHEN W L. Determination of eight organophosphorus pesticide residues in honey by gas chromatography[J].FujianAnalysis&Testing, 2012(6): 9-12.
[7] ZHENG W, PARK J A, ABD El-ATY A M, et al. Development and validation of modified QuEChERS method coupled with LC-MS/MS for simultaneous determination of cymiazole, fipronil, coumaphos, fluvalinate, amitraz, and its metabolite in various types of honey and royal jelly[J].JChromatogrBAnalytTechnolBiomedLifeSci, 2018, 1072: 60-69. DOI: 10.1016/j.jchromb-2017.11.011.
[8] DEBAYLE D, DESSALCES G, GRENIER-LOUSTALOT M F. Multi-residue analysis of traces of pesticides and antibiotics in honey by HPLC-MS-MS[J].Analytical&BioanalyticalChemistry, 2008, 391(3): 1011-1020.
[9] SHENDY A H, AL-GHOBASHY M A, GAD ALLA S A, et al. Development and validation of a modified QuEChERS protocol coupled to LC-MS/MS for simultaneous determination of multi-class antibiotic residues in honey[J].FoodChemistry, 2016, 190: 982-989.
[10] ORSO D, FLORIANO L, RIBEIRO L C, et al. Simultaneous determination of multiclass pesticides and antibiotics in honey samples based on ultra-high performance liquid chromatography-tandem mass spectrometry[J].FoodAnalyticalMethods, 2016, 9(6): 1638-1653.
夹纻胎轻巧、牢固,成型后不易变形、开裂,留存时间长。从工艺角度看,造型的自由度增加了,能够制造更为丰富多样的器型。夹纻器的出现是漆工艺的一次革命,也为漆器生产的兴旺发达奠定了基础。夹纻器最早出现在战国时期,两汉中期以后盛行起来,成为最常见的制胎方法。魏晋南北朝以来,常采用夹纻胎工艺制作佛像。塑造的佛像十分轻便,可以车载、人抬游行于街市,达到宗教宣传的目的。遗憾的是,唐末武宗灭佛,大量夹纻造像遭到毁坏,也导致这项工艺的失传。到了清代,福州沈绍安恢复了传统的“纻胎”工艺,并在此基础上创造出著名的“脱胎漆器”。
[11] 苗琼晨,聂晶,吴慧珍,等. QuEChERS净化—高效液相色谱-串联质谱法测定蜂蜜中农药及抗生素的含量[J].理化检验:化学分册, 2017, 53(7): 745-752.
MIAO Q C, NIE J, WU H Z, et al. Determination of Pesticides and antibiotics in honey by QuEChERS-HPLC-MS/MS[J].PhysicalTestingandChemicalAnalysisPartB:ChemicalAnalysis, 2017, 53(7): 745-752.
[12] SHENDY A H, ALGHOBASHY M A, MOHAMMED M N, et al. Simultaneous determination of 200 pesticide residues in honey using gas chromatography-tandem mass spectrometry in conjunction with streamlined quantification approach[J].JournalofChromatographyA, 2016, 1427: 142.
[13] SHAMSIPUR M, YAZDANFAR N, GHAMBARIAN M. Combination of solid-phase extraction with dispersive liquid-liquid microextraction followed by GC-MS for determination of pesticide residues from water, milk, honey and fruit juice[J].FoodChemistry, 2016, 204: 289.
[14] 庄明亮,崔敬德,朱方群,等. 一种用微生物法检测蜂蜜中环丙沙星的尝试[J].中国蜂业,2013, 64(z1): 122-122.
ZHUANG M L,CUI J D,ZHU F Q, et al. An experiment on the detection of antibiotic ciprofloxacin in honey by TTC[J].ApicultureofChina, 2013, 64(z1): 122-122.
LIU J T.StudyonanEnzyme-LinkedImmunosorbentAssayfortheDetectionofTetracycline[D]. Tianjin: Tianjin University of Science&Technology, 2012.
[16] 王兴如,钟文英,李周敏,等. 微孔板生物芯片测定蜂蜜中四环素残留方法的研究及应用[J].药物分析杂志, 2015(7): 1240-1244.
WANG X R, ZHONG W Y, LI Z M, et al. Visual microplate biochip for determination of tetracycline residues in honey[J].ChineseJournalofPharmaceuticalAnalysis, 2015(7): 1240-1244.
[17] 冯强.浙江省蜂蜜中主要抗生素及重金属残留的风险评估及检测方法的研究[D]. 杭州: 浙江工业大学, 2013.
FENG Q.InvestigationonMethodsofDeterminationHealthRiskAssessmentofMetalsandAntibioticinHoneyConsumedinZhejiangProvince[D]. Hangzhou: Zhejiang University of Technology, 2013.

