高效液相色谱测定明日叶中查尔酮的含量
邓建梅,余传波,郑毅
(攀枝花学院生物与化学工程学院,四川攀枝花617000)
明日叶(Angelica keiskei)也叫明日草、咸草等。最初来源于日本的伊豆岛,是伞形科草本植物的一种[1-2]。叶卵圆形,茎多,分枝能力较强,其生命力强盛,根系很发达,能在很多恶劣的环境中存活,具有“今日摘叶,明日长新芽”,故又叫“明日草”,由于自身含有大量的维生素、微量元素等营养物质和查尔酮等活性物质,被誉为“二十一世纪的健康食品”。其中,黄酮类活性物质在明日叶中含量较高,而查尔酮是一种重要的黄酮类化合物,其基本构成是1,3-二苯基丙烯酮[3-6]。有研究表明查尔酮对癌症和肿瘤具有很强的抑制作用,同时还可以降血糖,降低胆固醇,具有抗血栓,抗菌消炎、防艾滋病等诸多功效[7-8]。在国外,许多国家已经开始大面积种植明日叶,且作为一种健康蔬菜而普遍食用。在中国,明日叶已在台湾地区被广泛种植,在云南、江苏、上海、山东、东北等多个地区也已经被逐渐引进并进行大面积种植。
目前国内有学者用分光光度计对明日叶中查尔酮的提取工艺进行了研究,但具体的工艺参数不够清楚,另外未见报道用高效液相色谱对其查尔酮进行测定,尤其对高效液相色谱法测定明日叶中查尔酮的色谱条件更没有学者研究,如能结合现代仪器对其查尔酮进行测定,将是对明日叶进行有效应用的一个新的途径。本试验正是采用超声波辅助提取明日叶中查尔酮,高效液相色谱法测定查尔酮含量,以期为综合应用明日叶奠定一定的基础。
1 材料与方法
1.1 材料
明日叶:干热河谷特色生物资源开发技术中心;查尔酮(99%):上海雅吉生物科技有限公司;甲醇:色谱纯其他试剂均为分析纯。
1200型高效液相色谱仪:安捷伦公司;(KH2200DB)超声波清洗器:昆山禾创超声波仪器厂。
1.2 查尔酮测定方法
1.2.1 样品处理
将明日叶放于托盘中,自然风干72 h,粉碎后,用60目筛筛选并存储于棕色试剂瓶中密封保存以备用。
准确称取明日叶干粉样品0.5 g,放置于100 mL锥形瓶中,参考宁鸿珍等[9]的方法对明日叶查尔酮进行提取,将得到的提取液用真空泵进行抽滤,用3 mL~5 mL乙醇洗涤滤渣2至3次,将所得到的滤液再次抽滤;所得滤液转移到烧瓶,用旋转蒸发仪蒸发浓缩,再将浓缩的滤液水浴干燥,便得到了明日叶中查尔酮的粗提取物。
1.2.2 色谱条件的选择与优化
检测色谱柱为phenomenex C18柱(5 μm,4.6 mm×150mm),柱温 30℃,波长为 360nm[10],流速 0.8mL/min,每次进样20 μL。为保证查尔酮类化合物能很好的被测定,对流动相进行了优化,以不同浓度的甲醇∶水、甲醇∶0.4%磷酸作为流动相,其比例设置为50∶50、55 ∶45、60 ∶40、65 ∶35、70 ∶30、75 ∶25、80 ∶20、85 ∶15、90∶10。考察标准品的出峰情况。
1.2.3 标准溶液的配制
用甲醇溶解准确称量好的查尔酮标品20.00 mg,溶解并定容至50 mL,再按梯度配制成10、20、40、80、160、320 μg/mL 的标准溶液[11]。
1.2.4 单因素试验
称取约0.5 g明日叶粉末,加入一定浓度的乙醇进行超声波辅助提取。设置提取时间为10、20、30、40、50 min;料液比为 1∶20、1∶30、1∶40、1∶50、1∶60(g/mL);设置温度为50、60、70、80、90℃;乙醇浓度为50%、60%、70%、80%、90%,测定明日叶查尔酮的含量。每组至少3个重复。
1.2.5 正交试验
正交试验设计见表1。

表1 正交试验设计Table 1 Orthogonal test design
2 结果与分析
2.1 流动相的选择
通过对流动相的优化操作,实验表明流动相中甲醇体积分数越高,出峰时间越早,出峰效果更好。并且当流动相为甲醇∶0.4%磷酸为85∶15时,样品和标准品溶液的色谱图清晰单一,波峰完全分离且无杂峰拖尾峰。所以流动相选择甲醇∶0.4%磷酸为85∶15作为流动相为最佳。
2.2 标准曲线的绘制
2.2.1 单因素标准曲线的绘制
参照文献[9],测定吸收波长为360 nm的吸光值,得出线性回归方程:y=0.041 1x+0.051 7,R2=0.998 3,标准曲线如图1所示。
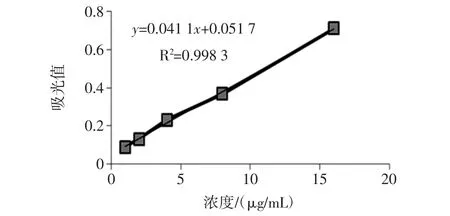
图1 查尔酮标准曲线Fig.1 Chalcone standard curve
2.2.2 正交试验标准曲线的绘制
图2为查尔酮液相色谱图,由图看出其保留时间为3.213 min,用进样针分别取20 μL不同浓度的标准溶液进样,绘制出查尔酮标准曲线,线性回归方程为:y=34.695x+20.776,R2=0.999 7(N=6)。
2.3 精密度试验
用微量进样针分别吸取查尔酮320 μg/mL标准品溶液,在此条件下,连续进样6次,结果表明相对标准偏差(relative standard deviation,RSD)为 1.78%,说明

图2 查尔酮标准品的色谱图Fig.2 The chromatogram of chalcone standard
此方法精密度较好,结果见表2。
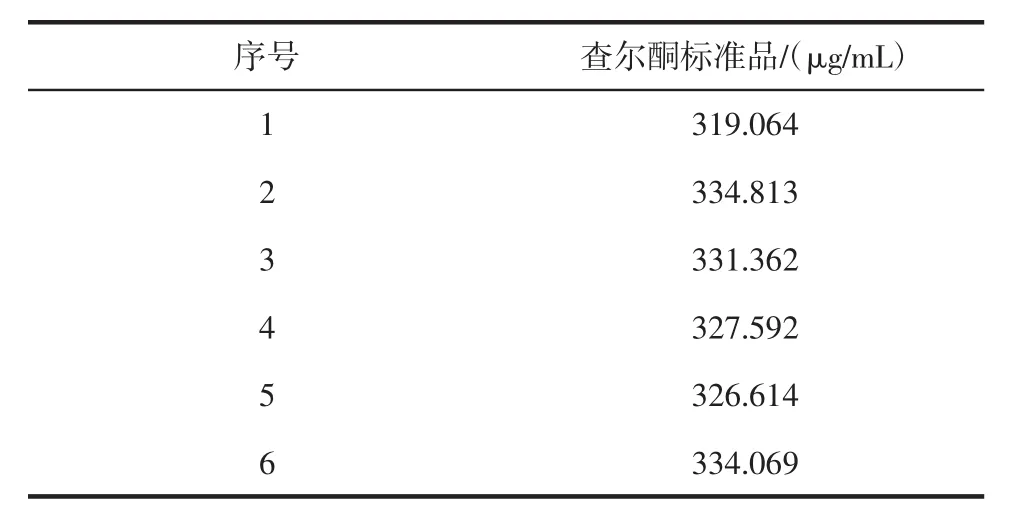
表2 精密度试验Table 2 The precision test
2.4 稳定性试验
取同一样品溶液 21 μL,经过 0、2、4、6、8 h 和 24 h分别进样,得出RSD为1.1%,表明试液在24 h内基本不变,结果见表3。
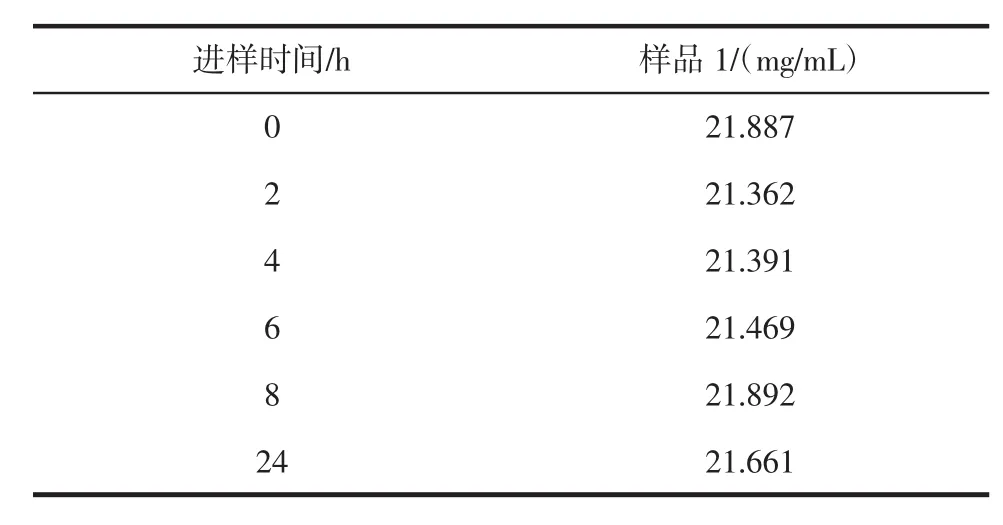
表3 稳定性试验Table 3 The stability test
2.5 重现性试验
重现性试验结果,计算得出RSD为1.51%,重现性较好。结果见表4。
2.6 加样回收率试验
加样回收率试验结果见表5,样品中查尔酮的平均回收率为97.43%,说明加样回收率较好。

表4 重现性试验结果Table 4 The results of reproducible test

表5 回收率试验Table 5 The recovery experiment
2.7 单因素试验结果与分析
2.7.1 不同提取时间对提取效果的影响
提取时间对提取效果的影响见图3。
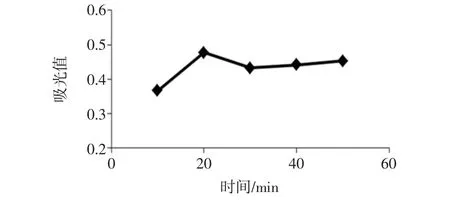
图3 提取时间对提取效果的影响Fig.3 Effect of extraction time on extraction efficiency
由图3可知,当提取时间在10 min~20 min时,测得查尔酮的吸光值随时间增长而逐渐增大,当提取时间超过20 min时,测得查尔酮的吸光值有明显下降且不再有大幅度的提高。这可能是因为本实验采用乙醇溶液作为萃取溶剂,萃取时间增加,溶剂挥发较多,使乙醇溶液浓度下降,使萃取效果降低。而在提取时间为20 min时,查尔酮能较好的被提取出来。故最佳提取时间为20 min。
2.7.2 不同料液比对提取效果的影响
料液比对提取效果的影响见图4。
由图4可知,吸光值随料液比的增大而升高,其中料液比未达到1∶40(g/mL)时,吸光值增长相对较快,但当料液比达到1∶40(g/mL)后,吸光值增长相对缓慢。因为料液比高会使两相间的浓度差增大,传质动力也会增大,所以提取效果也会更好。因为过大的料液比,会增加溶剂的使用量且在后面的操作中增加能耗和拉长时间,通过对提取效果、原料消耗和后续处理难度等问题进行分析、平衡,试验确定以1 ∶40(g/mL)为最佳料液比。

图4 料液比对提取效果的影响Fig.4 The influence of liquid ratio on extraction effect
2.7.3 不同提取温度对提取效果的影响
提取温度对提取效果的影响见图5。

图5 提取温度对提取效果的影响Fig.5 Effect of extraction temperature on extraction efficiency
由图5可知,提取效果随温度增加先升高再降低,当提取温度为70℃使,此时有最大的吸光度值,所以可得明日叶查尔酮的提取的最佳提取温度为70℃。因为温度过低,减慢提取物的溶出和降低传质速率:温度过高,会极大的增加能耗,还可能会使提取物分解和挥发,甚至破坏化合物的分子结构。所以可得明日叶查尔酮的提取的最佳提取温度为70℃。
2.7.4 不同乙醇浓度对提取效果的影响
不同乙醇浓度对提取效果的影响见图6。
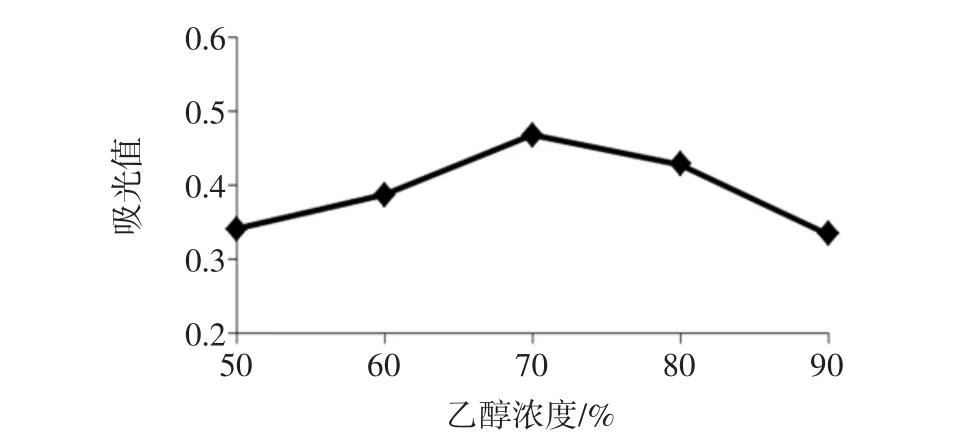
图6 乙醇浓度对提取效果的影响Fig.6 Effects of ethanol concentration on extraction efficiency
由图6可知,整个过程吸光值呈现先升高后下降的趋势。开始乙醇浓度升高,溶液极性升高,吸出大量的查尔酮,当乙醇浓度过高时,会使溶液的极性下降,提取物的溶解度随之下降,导致提取物不能充分溶解出来,另外一些可溶于醇的成分被析出,与查尔酮形成竞争机制,导致提取效果相对较差。
2.8 正交试验结果与分析
以样品1号为例,其色谱图见图7,其保留时间为3.159 min,与标准品保留时间3.213 min基本对应,证实了查尔酮的存在。其它样品测定方法与此相同,其实验结果及数据分析见表6。

图7 样品液相色谱图Fig.7 HPLC chromatogram of sample
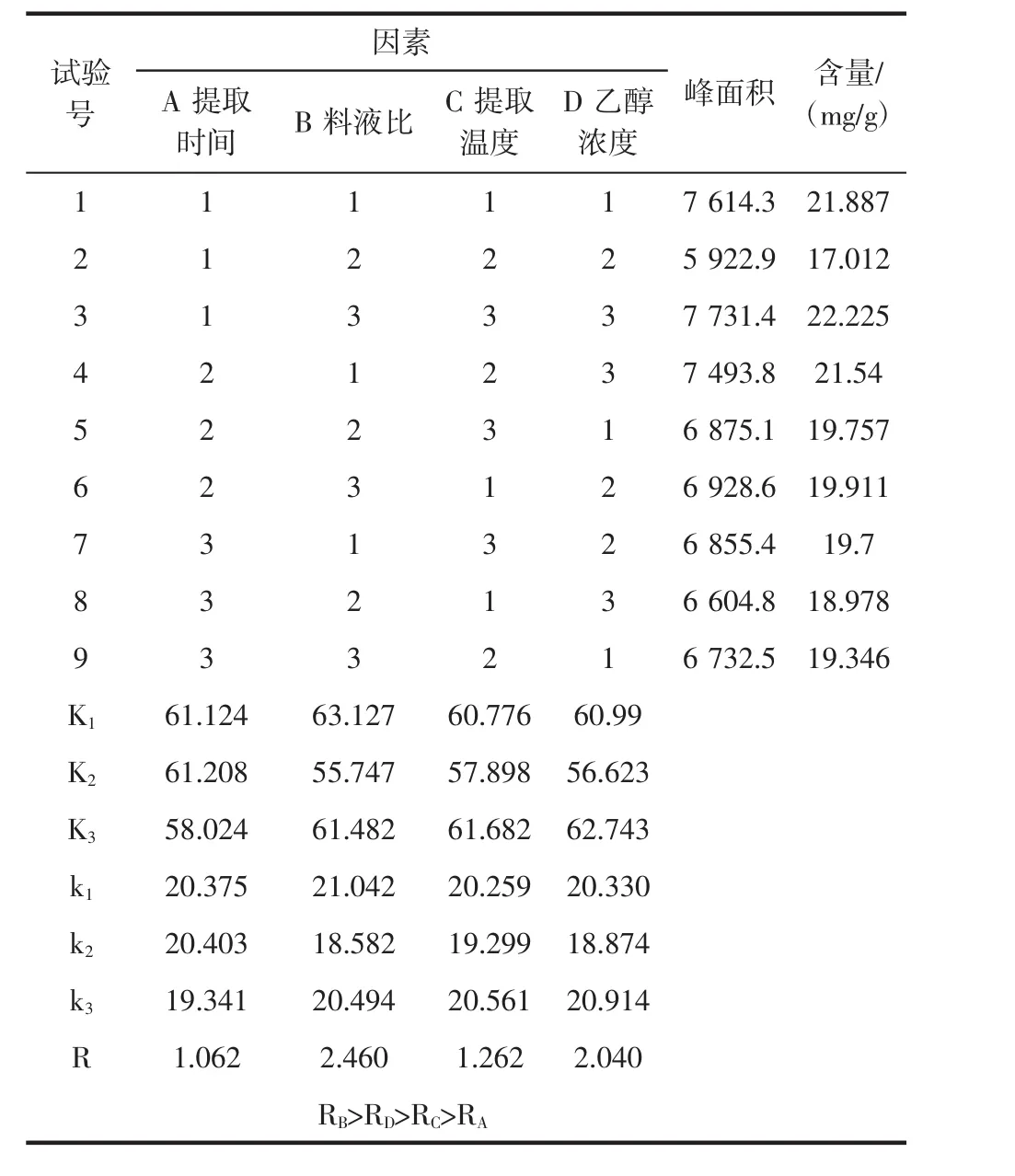
表6 查尔酮最佳提取条件结果Table 6 The optimum extraction conditions of chalcone
对表6数据进行分析,料液组的极差为2.460,乙醇浓度组的极差为2.040,超声温度组的极差为1.262,超声时间组的极差为1.062。从表中可以看出:对查尔酮的含量影响最大的是料液比,超声时间对明日叶中查尔酮含量的影响最低,乙醇浓度和超声温度对查尔酮含量影响不大。通过正交试验得出,试验最优组合料液比1∶30、乙醇浓度为80%、超声温度为80℃和超声时间为30 min时。为了验证明日草黄酮最佳提取工艺的可靠性,在最优条件下,料液比1∶30(g/mL)、乙醇浓度为80%、超声温度为80℃和超声时间为30 min做3次平行试验,结果取算数平均值,其结果见表7。

表7 验证性试验Table.7 The replication experiment
稳定性试验结果表明,查尔酮含量平均值为22.675 mg/g,相对标准偏差0.98%此偏差与偏离算术平均值的程度均在2.0%以内,考虑试验误差,表明该提取工艺参数较为稳定。因此,采用正交试验得到的查尔酮提取工艺最优条件的数据可靠。
3 结论
1)在查尔酮的提取过程中,质量/体积对查尔酮提取率的影响最为显著,乙醇浓度对提取率影响较大,其次是提取温度,提取时间几乎对查尔酮提取没有影响。最佳组合条件为:在料液比为1∶30(g/mL)、提取温度为80℃、乙醇浓度为80%和提取时间为30 min时,得到最高的查尔酮含量:为22.765 mg/g。这比陈欣华等[12]研究提出的查尔酮含量7.53 mg/g要高出两倍多,这可能是采用现代高端仪器-高效液相色谱测量,减少了试验误差,使得含量相对较高。
2)本试验表明,明日叶查尔酮的含量可通过现代仪器-高效液相色谱法测定,为查尔酮类化合物的获得提供一种可利用资源,同时也为合理开发明日叶的药用成分提供一定的依据。但本试验只是对其查尔酮含量进行了测定,对提取的查尔酮没有做进一步的研究,在后续的试验中可以就其生理生化性质等方面进行研究。
参考文献:
[1]李佳,张智俊,周长芳,等.明日叶的组织培养与快速繁殖[J].植物生理学通讯,2006,42(6):1142
[2]刘彬,楚冬海.超声波提取明日叶总黄酮的工艺研究[J].江苏农业科学,2016,44(2):338-339
[3]Tatuji Enoki,Hiromu Ohnogi,Kinuko Nagamine,et al.AntidiabeticActivities of Chalcones Isolated from a Japanese Herb[J].Angelicakeiskei agricultural and food chemistry,2007,55(15):6013-6017
[4]Toshihiro Akihisa,Takashi Kikuchi,Hisashi Nagai,et al.4-Hydroxud-erricin from Angelica keiskei Roots Induces Caspase-dependentApoptotic Cell Death in HL60 Human Leukemia Cells[J].J Oleo Sci,2011,60(2):71-77
[5]Junichi Nagata,Tomoko Morino,Morio Saito.Effects of Dietary Angelica keiskei on Serum and Liver Lipid Profiles,and Bodu Fat Accumulations in Rats[J].J Nutr Sci Vitaminol,2007,53:133-137
[6]Chien-Yi Chen.Elemental analysis of the Taiwanese health foodAngelica keiskei by INAA[J].RadioanalyticalandNuclearChem-istry,2002,252(3):551-558
[7]孙赫,钟进义,孟扬.明日叶查尔酮对小鼠肝癌细胞PCNA和BCL-2蛋白表达的影响[J].毒理学杂志,2011,25(1):33-36
[8]ZHENG H W,NIU X W,ZHU J,et al.Progress in research of biological activites of chalcones[J].Chin J New Drugs(中国新药杂志),2007,16(18):1445-1449
[9]宁鸿珍,陈欣华,王曼曼,等.超声波辅助提取明日叶查尔酮的工艺优化[J].食品研究与开发,2014,35(8):34-37
[10]孙莲,张丽静,孟磊,等.高效液相色谱法测定桑叶中的芦丁[J].内蒙古中医药,2004,23(2):27-28
[11]刘娥,郭鹏.高效液相色谱法测定钟祥苦荞茶中芦丁的含量[J].中国医院药学杂志,2013,33(13):1110-1111
[12]陈欣华,王曼曼,宁鸿珍,等.明日叶中查尔酮三种提取方法的比较研究[J].食品工业2014,35(6)91-93

