霍山石斛多糖研究进展
崔胜文,罗双群,周婧琪,高愿军
(1.漯河中德双成功能食品研究院有限公司,河南漯河462300;2.漯河食品职业学院食品检测系,河南漯河462300)
霍山石斛(Dendrobium huoshanense)属于兰科,多年生草本植物,主要分布于中国安徽省霍山县,河南省也有分布[1]。霍山石斛是一种珍稀中药材,传统医学认为其具有滋阴消渴、生津润肺、清音明目等功效[2]。多糖是霍山石斛中最主要的活性成分之一,研究发现霍山石斛多糖(Dendrobium huoshanense polysaccharide,DHP)具有抗氧化、抗白内障、抗肝损伤和肝纤维化、抗疲劳、调节免疫力、抗肿瘤、抗糖基化等生理功能[3],且药物毒性极小,从而成为药物药效物质基础研究的热点。本文拟从DHP的提取、结构特性以及生理功能等进行综述,为霍山石斛多糖的开发和利用提供参考。
1 霍山石斛多糖的提取方式
DHP的含量受生长部位以及生长年限的影响,在叶中含量最高,茎中含量最低,且两年生茎中多糖含量最高,但3年生茎中含量减少。当前DHP提取工艺有多种,其中最常用的为热水提醇沉法[4],该法提取所需温度高,时间长,一般需重复提取两次,经济效率和提取率均较低。黄森等[5]用该法在提取温度为69.4℃,pH 值为 5.9,料液比为 1∶20(g/mL),提取次数为 2次,提取时间为1.57 h时所得DHP提取率最高仅为0.1821 g/g。谷仿丽[6]和董泽梁[7]用该法分别从霍山石斛组培苗和新鲜的霍山铁皮石斛根茎中提取DHP,其得率分别为17.763%和17.45%[8]。若在提取过程中添加超声波辅助不仅可提升浸提速率,还可显著提升多糖提取率,刘艳艳等通过比较超声波辅助提取工艺和热水浸提工艺对DHP提取率的影响,发现超声波辅助提取所得DHP得率是传统热水浸提工艺的1.70倍。QIN Xia[9]等也通过研究发现,在超声功率250 W,固液比1∶10(g/mL)条件下提取仅 30min,DHP 的提取率可高达到28.02%。此外,微波辅助法也能有效提高DHP的提取率[10]。近年来出现了酶法提取,该方法条件温和,提取效率和收率均提升,且多糖活性获得较大限度保留。魏明等[11]采用超声波协同纤维素酶法提取DHP,当料液比1∶40(g/mL)、纤维素酶 500 U/g、酶解温度 40 ℃、酶解时间3 h、超声波功率为300 W、超声时间6 min时,多糖提取量可达0.283 g/g。
2 霍山石斛多糖的结构特性
DHP主要是非淀粉类中的中性多糖,多数不含有还原糖[12]。查学强等[13]最早开展霍山石斛活性多糖的分离纯化和结构鉴定的研究,已从霍山石斛水溶性多糖中分离出一种具有免疫活性的均一性多糖HPS-1B23。该多糖为α-吡喃构型,平均分子量为2.2×104Da,由葡萄糖、甘露糖和半乳糖按31∶10∶8的分子摩尔比组成,含有以下6个重复单元,见图1[14]。
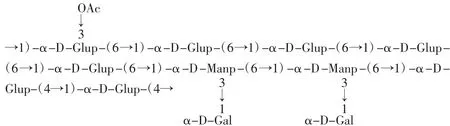
图1 α-吡喃多糖结构式Fig.1 The structure of α-pyran polysaccharides
田长城等[15]发现的DHP1A(分子量为6.7×103Da)也主要由葡萄糖、甘露糖和少量半乳糖组成,其摩尔组成比为 2.5∶16∶0.1,其主链由(1→4)-α-D-Glc p、(1→6)-α-D-Glc p 和(1→4)-β-D-Man p,与终端一个分支的β-D-Gal p组成。黄月纯等[16]对10批霍山石斛多糖柱前衍生高效液相色谱(High performance liquid chromatography,HPLC)特征图谱与国家药典委员会中药色谱指纹图谱相似度评价系统软件(2004A版)生成图谱对比发现,10批霍山石斛多糖柱前衍生特征图谱标示出6个特征峰,主要由D-甘露糖(71.8%)与D-葡萄糖(27.2%)组成,D-甘露糖与D-葡萄糖峰面积比值为2.05~3.71,此外含微量的D-半乳糖醛酸、D-半乳糖、D-木糖、D-阿拉伯糖。与对照图谱比较,10批霍山石斛的相似度为0.994~1.000,说明霍山石斛多糖提取具有良好的重复性。但是霍山石斛多糖的分子量、化学结构、微观结构等又受提取方法、提取温度等的影响。
2.1 提取方法对DHP结构特性的影响
提取方法对DHP的微观结构、分子量、化学结构等影响很大。刘艳艳[17]对超声波辅助提取法和热水浸法所得霍山石斛多糖粗提液从分离纯化所得多糖组分DHP-1A(热水浸提所得)和UDHP-1A(超声波辅助提取所得)进行比较发现,两种多糖组分粘度都较小,但DHP-1A特性粘度大于UDHP-1A;从结构上看,两种多糖组分均不含三股螺旋结构,也不含蛋白质和核酸等杂质;但DHP-1A固态聚集体颗粒较大,表面较为平整,而UDHP-1A颗粒较小,表面较为粗糙,呈现出松散的碎片状堆积;从红外光谱图可知DHP-1A中存在β-型糖苷键,超声辅助提取的多糖UDHP-1A这一结构受到影响。高效液相色谱法检测结果显示多糖DHP-1A和UDHP-1A均为分子量均一体系,分子量分别为 1.17×104Da和 6.08×103Da。
冯宝军[18]将热水浸提法所得霍山石斛粗多糖进行脱蛋白及分离纯化所得的分子量为7.3×104Da的DHP-W2经全水解分析表明,DHP-W2主要由葡萄糖(Glc)、木糖(Xyl)和半乳糖(Gal)按 1.1∶1.0∶0.5 的分子摩尔比以及少量的半乳糖醛酸组成。甲基化分析和核磁共振波谱分析表明,DHP-W2的主链由1,6-连接和1,4-连接的β-D-glucose组成,分枝点位于O-4/6:DHP-W2 的枝链由 1,4-连接的 α-D-xylose、1,2,4-连结的 α-D-xylose以及末端残基 α-D-xylose、α-D-galactose和α-D-galacturonicacid组成。董泽梁[7]将热水浸提法所得霍山铁皮石斛粗多糖(HDCP)经DEAE-52色谱分离可以得到HDCP-W、HDCP-1和HDCP-3这3个组分,将粗多糖及各组分分别进行气相色谱(GC)分析。GC结果显示,HDCP含有11.4%的阿拉伯糖、8%的鼠李糖、13.4%的木糖、10.7%的半乳糖、44.5%的葡萄糖和12%的甘露糖:HDCP-W含有38.9%的阿拉伯糖、21.3%的半乳糖、24.2%的葡萄糖和15.6%的甘露糖:HDCP-1含有81.1%的木糖、3.4%的半乳糖和15.5%的葡萄糖;HDCP-3含有23.2%的阿拉伯糖、30%的鼠李糖、15.4%的葡萄糖和31.4%的甘露糖。研究还证明,HDCP-W不含有蛋白质等杂质,其分子量为3.538×105g/mol,分子旋光半径为51.9 nm,分散系数为1.139,分子构象倾向于无规则线团。经扫描电镜扫描观察,发现其微观形态主要为细线条状、大小不一的碎片状和无规则网团状。肖婧婧[19-20]用水提醇沉法提取总多糖,经分离纯化获得两种相对均一组分DHP-D1、DHP-D2。采用高效液相测得DHP-D1、DHP-D2 的相对分子量分别为 3.2×103Da、8.09×106Da。DHP-D1主要由葡萄糖、阿拉伯糖、半乳糖组成,摩尔比为 1.023∶0.023∶0.021,同时还存在极少量的甘露糖和木糖:DHP-D1 主链主要由 1,4-α-D-Glcp、1,5-α-L-Araf、1,6-α-D-Glcp 和 1,6-α-D-Glap 构成,其中部分1,4-α-D-Glcp的C-6位上连接有1-α-Glcp及微量的1-β-D-Xylp,此外还存在微量的1,3-α-DManp,其的C-6位上连接有1-α-Glcp。DHP-D2主要由半乳糖、葡萄糖、阿拉伯糖、甘露糖、木糖、鼠李糖组成,其摩尔比为 0.896∶0.723∶0.2∶0.072∶0.031∶0.028,其主链主要由 1,6-β-D-Galp、1,4-β-D-Glcp、1,6-β-DGlcp、1,5-α-L-Araf和 1,6-α-D-Glcp 组成,其中1,6-β-D-Galp的 C-3位连接有少量的 1-α-D-Manp、1-α-D-Xlyp、3-α-L-Rhap。
2.2 提取温度对DHP结构特性的影响
霍山石斛多糖的结构特性还受提取温度的影响,江贤敏、王正明等[21-22]研究发现,DHP的特性黏度随提取温度的升高而呈现下降趋势;用HPLC分析表明不同温度(40、60、80、100℃)条件下水提醇沉法提取的DHP均由高分子质量(higher molecular weight,HMW)和低分子质量(lower molecular weight,LMW)两种组分所构成,LMW热稳定性好、主要存在于阴离子交换色谱的水洗脱组分(water-eluted fraction,DHPW),HMW热稳定性弱、主要存在于阴离子交换色谱的盐洗脱组分(salt-eluted fraction,DHPS);GC和FTIR分析显示,DHPW主要由呈α-构型的葡萄糖所组成、不含糖醛酸,DHPS主要由呈β-构型的葡萄糖、半乳糖、阿拉伯糖和甘露糖所组成,且含糖醛酸。由此可见,提取温度不仅影响DHP的提取量,而且可明显改变DHP的特性黏度、分子质量分布、单糖组成。
3 霍山石斛的生理功能
大量研究表明,DHP具有广泛的生理活性,包括:抗氧化、抗白内障、抗肝损伤和肝纤维化、抗疲劳、调节免疫力、抗肿瘤、抗糖基化等生理功能。
3.1 抗氧化
DHP具有体外抗自由基和抗脂质过氧化作用,汪曙等[23]研究发现DHP对·OH的半数清除浓度为6.79 mg/mL,对O2-的半数抑制浓度分别为3.04 mg/mL,且对VC-Fe2+诱导的肝匀浆的脂质过氧化均有一定的抑制作用,并可减轻VC-Fe2+系统诱导所致小鼠肝线粒体氧化损伤程度。DHP的体外抗氧化能力与其相对分子量大小有一定关系。郝杰等[24]分别用40%、50%、60%和80%终浓度的乙醇连续沉淀霍山石斛苗总多糖(ST:2.52×105Da)所得 4 种多糖组分(S1:4.79×105Da、S2:3.16×105Da、S3:3.07×105Da 和 S4:8.59×104Da)为材料,研究DHP体外抗氧化能力。研究发现,不同相对分子质量DHP均有抗氧化作用,其中相对分子量最大的S1对H2O2、·OH的清除作用强于其他多糖组分,IC50分别为0.15 mg/mL和1.81 mg/mL,并具有显著的还原力和抑制Fe2+-VC诱导脂质过氧化能力,最大效应分别为0.312和45.67%;S3对超氧自由基的清除作用较好,最大清除率达到72%;ST抑制H2O2诱导的红细胞溶血能力最强,达到67.23%,而在其他抗氧化试验中效果较差;S2在上述体外抗氧化评价体系中的效果较差。田长城等[15]也通过研究发现低分子霍山石斛多糖DHP1A(分子量6.7×103Da)对FeCl2诱导的脂质过氧化有显著抑制作用。剂量对抗氧化能力也有一定影响,谷仿丽等[25]研究发现DHP具有降低肥胖小鼠氧化应激的作用,DHP高剂量组[0.2 g/(kg·d)]能显著降低模型小鼠体重、Lee′s、体脂比、血清游离脂肪酸(free fatty acids,FFA)、血清胰岛素(insulin,INS)和丙二醛(malona-ldehyde,MDA),显著提高肝谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)、肝超氧化物歧化酶(superoxide dismutase,SOD)、肝总抗氧化能力(total antioxidant capacity,T-AOC)水平(P<0.05v模型组),空腹血糖(FBG)有降低趋势,但不显著。此外,DHP提取方式对其抗氧化能力也有一定影响,用超声波辅助提取工艺所得DHP还原力和ABTS自由基清除率均优于热水浸提的多糖[8]。
3.2 抗白内障
DHP是一种良好的糖尿病性白内障防治药物,它能从氧化途径和蛋白糖基化途径两方面同时抑制晶状体浑浊进程。DHP可保证注射链脲佐菌素(strepto-zotocin,STZ)大鼠正常的生活规律和体重增长,降低血糖水平,并且减缓晶状体浑浊发生,治疗效果随用药剂量增加。DHP可显著降低糖尿病性大鼠NO水平及其合成酶iNOS活性,多色荧光实时定量PCR证实DHP可以下调iNOS基因表达,抑制效果与多糖剂量正相关[26-27]。DHP对STZ大鼠谷胱甘肽家族酶活性有显著保护作用,它能够显著增加糖尿病性白内障大鼠晶状体组织中谷胱甘肽(glutathione,GSH)水平、降低MDA及羰基的含有量,提高其GSH-PX、谷胱甘肽还原酶(gutathione reductase,GR)、谷胱甘肽-S-转移酶(glutathione S-transferase,GST)、过氧化氢酶(catalase,CAT)、SOD酶活力[28]。此外,DHP还可抑制蛋白糖基化终产物(advanced glycation end products,AGEs)的形成,200 mg/(kg·d)剂量组多糖时抑制率达到了40.2%。
3.3 抗肝损伤和肝纤维化
黄静[29]等发现霍山石斛粗多糖能够有效增强小鼠对四氯化碳(carbon tetrachloride,CCl4)肝损伤的抵抗能力,DHP 各剂量组(200、100、50 mg/kg) 均能降低CCl4致小鼠急性肝损伤血清谷丙转氨酶(anine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)的升高,降低肝匀浆中MDA含量,增强SOD的活性,抑制肝细胞中肿瘤坏死因子(tumor necrosis factor-α,TNF-α)表达,减轻 CCl4对肝组织的病理损伤。田长城等[30]将用热水浸提法所得霍山石斛粗多糖通过DEAE-纤维素阴离子交换法分离纯化所得的 4种多糖组分(DHP1、DHP2、DHP3和 DHP4)用于研究它们对CCl4肝毒性的保护作用。发现口服DHP1显著降低了CCl4诱导的小鼠血清ALT和AST活性的升高,削弱了肝组织中MDA的表达,同时恢复了肝组织中SOD和CAT的活性。得出DHP1可能是霍山石斛中一种潜在的保肝多糖成分。该学者[31]采用Sephadex G-100凝胶层析对DHP1进一步分离和纯化,得到 DHP1A(分子量:6.7×103Da)和 DHP1B(分子量:3.51×103Da)两种多糖片段。进一步评价了DHP1A的保肝功效,结果表明,DHP1A的摄入可以有效降低CC14肝损伤中各种生化指标的升高,降低了丙二醛和8-羟基脱氧鸟苷(8-hydroxyl deoxyguanosine,8-OHdG)的产生;DHP1A可以调节小鼠肝内各种炎性分子的表达,如 TNF-α、白介素(IL-1β)、单核细胞趋化蛋白(MCP)-1、巨噬细胞炎性蛋白(macrophage inflammatory protein,MIP)-2和CD68。此外,DHP1A还干扰了CCl4诱导的核因子(NF)-κB的激活,缓解了小鼠的肝损伤。
孟海涛等[32]比较了霍山石斛冷冻干燥物、水提物、水提醇溶物、水提醇沉物、水提粗多糖等5种提取物抗小鼠亚急性酒精性肝损伤效果,结果发现,霍山石斛水提醇溶物抗亚急性酒精性肝损伤的活性最差,醇沉物、水提物、冷冻干燥物具有一定的肝损伤保护活性,水提粗多糖各个剂量组均可显著改善肝脏组织损伤和脂肪变性(P<0.05),降低血清 ALT、AST、碱性磷酸酶(alkaline phosphatase,ALP)活性和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)水平,提高血清高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)含量,增强肝组织乙醇脱氢酶(alcohol dehydrogenase,ADH)、乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)、SOD 和 GSH-PX活性,减少肝组织中还原性谷胱甘肽(glutathione,GSH)损耗并抑制肝组织MDA含量增加,这说明多糖是霍山石斛抗小鼠亚急性酒精性肝损伤的功能因子。聂春艳等[33]也证明DHP对亚急性酒精性肝损伤小鼠有显著的保护作用,能减轻酒精对肝脏的病理损伤。此外,DHP还可以通过辅助饮食调节改善SD大鼠非酒精性脂肪性肝(nonalcoholic fatty liver,NAFL)损伤,这种改善保护作用可能是通过恢复机体脂质代谢平衡而实现的[34]。
潘利华等[35]通过研究发现,DHP对亚硒酸钠致大鼠肝损伤和肝纤维化也有干预效果,DHP可以明显改善亚硒酸钠导致的大鼠体重减轻、肝脏缩小和脾脏增大的症状,有效干预肝损伤和肝纤维化的发展,对亚硒酸钠导致的大鼠血清ALT、AST和LDH活性升高具有显著的抑制作用:DHP还可以恢复亚硒酸钠处理的大鼠肝脏内 H2O2、GSH、MDA、SOD、CAT 和 GST 至对照的水平,维持肝实质细胞膜的正常流动性。该学者[36]还通过免疫荧光组织化学分析证明,DHP对肝损伤和肝纤维化的干预和它有效减少转化生长因子TGF-β1和肝脏内胶原蛋白表达相关。该学者[37]还研究发现霍山石斛均一多糖半乳葡甘露聚糖(GGM)可通过进一步降低转化生长因子-02051(TGF-02051)和I型胶原的表达来预防亚硒酸钠诱导的肝损伤和肝纤维化,这意味着GGM可能发展成为一种新型的对肝损伤和肝纤维化有防治作用的抗纤维化剂。
3.4 抗疲劳
DHP可有效提高小鼠运动能力,余刚,夏云建等[38-39]从负重游泳力竭时间、血乳酸、血清尿素氮、丙二醛、肝糖元等方面探讨了低剂量[150 mg/(kg·d)]、高剂量[450 mg/(kg·d)]DHP抗疲劳作用机制,研究发现,两种剂量的DHP都能显著延长小鼠游泳时间,降低运动后小鼠的乳酸累积,降低血清尿素氮、丙二醛含量,增加运动后小鼠的肝糖原储备值,但高剂量DHP效果优于低剂量DHP。
3.5 免疫调节
Hsieh[40]等分别证实了霍山石斛水溶性总多糖具有促进小鼠巨噬细胞和脾细胞释放TNF-a、IL-6、IL-1等细胞因子和GM-CSF、G-CSF等造血生长因子的功能,并通过分离纯化、结构表征和构效关系的研究表明霍山石斛多糖发挥免疫增强活性需要适度的乙酰化。Lin等[41]研究了DHPS对小鼠体内和体外诱导的细胞因子/趋化因子的影响。研究发现,DHPS在体内和体外均可诱导小鼠TH1、TH2、炎性细胞因子和趋化因子。DHPS能扩增小鼠脾细胞,包括CD4(+)T细胞、CD8(+)T 细胞、B 细胞、NK 细胞、NKT 细胞、单核/巨噬细胞、粒细胞和调节性T细胞,特别是DHPS诱导小鼠和人的免疫细胞(尤其是单核细胞)产生了一种抗炎分子IL-1ra。注射DHPS将使血清IL-1ra水平达到IL-1的10倍以上,提示DHPS诱导的抗炎活性因子可能会过度依赖IL-1介导的炎症反应。研究还发现,DHPS诱导IL-1ra产生的信号通路包括:ERK/ELK、p38 MAPK、PI3K和 NF-κB。这些结果表明,DHPS可能有改善IL-1诱导的致病条件的作用。查学强等[42]研究了口服 DHP(50 mg/kg~200 mg/kg)对没有或有氨甲喋呤小鼠肠道、脾脏和肝脏的免疫调节反应。肠道免疫反应显示,从口服DHP小鼠中分离出的小肠淋巴细胞培养上清液,可使骨髓细胞增殖,这表明所有的DHP治疗组都有显著增强肠道免疫反应的能力:脾脏免疫反应显示,所有的DHP治疗组都能显著促进脾细胞增殖和分泌干扰素(IFN-γ);肝脏免疫应答显示,不仅所有的DHP治疗组能显著刺激肝细胞增殖和IFN-γ的分泌,而且100 mg/kg和200 mg/kg剂量组还能显著提高IL-4的分泌。此外,DHP还可以恢复氨甲喋呤损伤小鼠小肠免疫功能(100 mg/kg和200 mg/kg),促进氨甲喋呤治疗小鼠脾和肝的细胞增殖以及IFN-γ的产生(200 mg/kg)。这些结果表明,口服DHP对小肠免疫系统和全身免疫系统都具有免疫调节能力。
DHP对肠对黏膜免疫调节活性受浓度和温度的影响,郝冉等[43]通过口服和离体小肠培养以及Peyer’s结细胞培养,用激光共聚焦显微镜检测DHP在小肠内的吸收分布以及与Peyer's结细胞的结合情况,研究发现,DHP具有肠黏膜免疫调节活性,在体内和体外均可通过Peyer's结细胞被小肠吸收,且DHP浓度越高,免疫调节活性越强,在质量浓度为 25、50、100、200 μg/mL时,其肠黏膜免疫调节活性分别提高到对照组的112.8%、131.1%、137.6%和160.5%。江贤敏等[21]发现不同温度(40、60、80、100℃)条件下水提醇沉法提取的DHP及其阴离子交换色谱水洗脱组分(water-eluted fraction,DHPW)和盐洗脱组分(salt-eluted fraction,DHPS)均表现出肠道黏膜免疫调节活性,且DHPS比DHPW具有更强的肠道黏膜免疫调节活性,但它们的活性均随提取温度的升高而下降。
3.6 抗肿瘤
黄森等[44]优化了霍山石斛多糖的提取工艺,纯化分离了多种多糖组分,重点研究了霍山石斛多糖对人胃腺癌细胞SGC-7901的抑制作用,探讨了多糖抗肿瘤作用与肿瘤相关基因之间的相关性。通过单因素试验结合Box-Behnken设计和响应曲面分析,建立了提取温度、提取pH和提取时间与霍山石斛多糖提取率间的数学模型。水提获得的霍山石斛粗多糖HDP通过DEAE-纤维素离子交换色谱分离得到多糖HDP-1,HDP-2,HDP-3,HDP-4,HDP-5,HDP-6。其中抗胃癌活性最强的多糖HDP-2经Se:phacryl-200HR色谱后,又获得HDP-2-A和HDP-2-B两种多糖组分,经UV扫描不含蛋白。多糖组份HDP-2对胃腺癌细胞SGC-7901的作用在荧光定量RT-PCR下检测得到,多糖组份HDP-2明显下调胃腺癌细胞SGC-7901中原癌基因c-myc的表达,仅为对照组表达率的42.34%。同时大幅提高肿瘤抑制基因野生型p53的表达,为对照组表达率的2.042倍。鲍丽娟[45]研究发现,霍山石斛多糖具有良好的抑制HelaS3人宫颈癌细胞和HepG2人肝癌细胞毒性作用,在试验浓度范围内呈剂量依赖性。DHP具有显著的抗心肌缺血-再灌注损伤的作用,其作用机制可能是激活GSK-3β信号通路发挥抗氧化、抗炎和抗凋亡作用。房雪等[46]采用Langendorff离体灌流系统建造大鼠离体缺血-再灌注损伤模型,研究DHP 低、中、高浓度(0.1、0.5、1.0 mg/L)对抗心肌缺血-再灌注损伤的影响,发现与模型组相比,DHP中、高剂量组的心肌坏死程度、梗死面积和细胞凋亡率显著降低,心功能显著改善:冠脉流出液中乳酸脱氢酶(LDH)、肌酸激酶(CK)水平逐渐降低:心肌组织中MDA以及TNF-α和白介素6(IL-6)含量显著降低,SOD活性和还原型谷胱甘肽/氧化型谷胱甘肽(GSH/GSSG)比值显著升高(P<0.01)。高剂量DHP可显著降低心肌细胞凋亡指数,升高心肌组织中GSK-3β磷酸化水平。
3.7 抗糖基化
肖婧婧[19]以体外蛋白质非酶糖基化反应体系为试验模型,研究DHP及其硫酸化衍生物的抗蛋白质非酶糖基化活性。结果表明,在培养的前21天,DHP及其硫酸化衍生物对蛋白质非酶糖基化初期产物Amadori的抑制率呈上升趋势,随后下降至不同水平。DHP及其硫酸化衍生物对蛋白质非酶糖基化中期产物二羰基化合物和末期产物AGEs形成的抑制作用均存在剂量依赖关系,在培养的第28天抑制率最大。研究还表明,硫酸化修饰可提高DHP对蛋白质非酶糖基化的抑制作用,其抑制活性的高低与取代度的大小呈一定的正相关关系,并且6-O-硫酸化霍山石斛多糖衍生物对蛋白质非酶糖基化的抑制活性强于2,2’,4-O-硫酸化霍山石斛多糖衍生物。
3.8 其他
孟鸽等[47]研究发现DHP对嗜酸乳杆菌生长有一定的影响作用,当添加DHP浓度为6 g/L时,嗜酸乳杆菌生物量及生长速度较对照组明显提高。此浓度下,还原糖的利用和蛋白质及乳酸的合成量也均高于对照组:同时发现添加多糖提高了嗜酸乳杆菌LDH、SOD、GSH-Px 3种酶活力。王长顺[48]以霍山石斛原球茎中提取的DHP与牛血清白蛋白偶联后作为抗原,免疫小鼠获得单克隆抗体,以获得的单克隆抗体为一级抗体对小鼠进行免疫组织化学试验。证实了CDAP活化法可有效偶联多糖与蛋白质,且以制备的偶联物能引起小鼠免疫反应从而制备出所需的单克隆抗体,利用获得的活性较高、特异性较好的单克隆抗体得到多糖在小鼠组织的分布图,该方法可为霍山石斛多糖进入机体后分布情况提供科学依据。
4 发展方向
当前,针对DHP的研究以成为热点研究,DHP的提取工艺被不断改进,提取效率和提取率也有了极大提高,DHP的分子量与化学成分间的关系也被进一步明确。目前,众学者对DHP的生理功能研究仍停留在动物试验阶段,且其具体作用机制仍有待进一步研究。此外,DHP进入机体后的分布情况目前也尚不明确,对DHP生理功能的人体试验更是尚未涉及。
参考文献:
[1]张炜玲,王新生,戴亚峰,等.霍山石斛最新研究进展[J].安徽农业科学,2010,38(36):20661-20663,20719
[2]童晨曦,齐蕾.霍山石斛的研究进展及可持续发展[J].医学综述,2015,21(24):4512-4514
[3]司华阳,陈乃东,陈乃福.霍山石斛多糖的分离鉴定及药理活性研究进展[J].天然产物研究与开发,2016(28):467-470,445
[4]ZHANG Wei-lin,WANG Xin-sheng,DAI Ya-feng,et al.Optimization of Extraction Process for Polysaccharides from Dendrobium huoshanense by Response Surface Methodology[J].Medicinal Plant,2012,3(7):48-52
“互联网+”时代迅速发展,互联网融资平台犹如雨后春笋般争先恐后般进入市场,政府应与时俱进,对大学生创业融资制度进行优化升级,降低大学生互联网创业融资的风险;相关政策制定部门要与政府、高校、银行建立起大学生创业互联网融资服务网站,充分利用新媒体传播途径,加大力度宣传互联网创业融资模式,让大学生正确看待互联网创业融资的诸多方式,降低融资风险;另外,互联网融资平台迅猛爆发,致使其信用程度良莠不齐,甚至会坑蒙拐骗。相关部门的监管力度,未能提供良好的互联网融资环境;最后,政府部门应适度降低融资门槛,对大学生创业应采取更加科学、便捷的审批措施。
[5]黄森,查学强,罗建平.等.Box-Behnken法优化提取霍山石斛活性多糖的研究[J].中药材,2007,30(5):591-594
[6]谷仿丽,陈乃富,戴军.霍山石斛组培苗多糖的提取工艺研究[J].宿州学院学报,2011,26(11):68-70
[7]董泽梁.霍山铁皮石斛多糖的提取优化、分离纯化及结构特征的研究[D].合肥:安徽农业大学,2014
[8]刘艳艳,魏明,孟鸽.等.超声波辅助提取霍山石斛多糖及其抗氧化活性研究[J].食品科技,2016(5):213-218
[9]QIN Xia,DONG Hai-li,LIU Hong.Optimization of the Ultrasonic Assisted Extraction of Polysaccharides from Dendrobium huoshanense by Response Surface Method[J].Medicinal Plant,2012,3(8):78-80
[10]Guihua XIAN,Bin LI,Hengchang ZANG.Microwave Technique for Polysaccharide Extraction from Dendrobium huoshanense[J].Agricultural Science&Technology,2014(8):1304-1307,1367
[11]魏明,邵平,姚红.等.超声波协同纤维素酶法提取霍山石斛多糖的研究[J].食品工业科技,2009,30(3):199-201
[12]卢荣德,陶小平,孙晴.等.霍山石斛的生化特征及光合过程的研究进展[J].中草药,2010,41(11):1917-1921
[13]Zha X Q,Luo J P,Luo S Z.Structure identification of a new immunostimulating polysaccharide from the stems of Dendrobium huoshanense.Carbohydrate Polymers[J].Carbohydrate Polymers,2007,69(1):86-93
[15]Tian C C,Zha X Q,Pan L H,et al.Structural characterization and antioxidant activity of a low-molecular polysaccharide from Dendrobium huoshanense[J].Fitoterapia,2013,91:247-255
[16]黄月纯,叶家宏,戴亚峰,等.霍山石斛与美花石斛多糖柱前衍生HPLC特征图谱比较[J].中药新药与临床药理,2014,25(6):725-730
[17]刘艳艳.超声波辅助提取霍山石斛多糖及其对多糖理化性质和抗氧化活性的影响[D].芜湖:安徽工程大学,2016
[18]冯宝军.霍山石斛多糖的分离纯化及结构鉴定[D].合肥:合肥工业大学,2010
[19]肖婧婧.基于硫酸化修饰的抗蛋白质非酶糖基化活性霍山石斛多糖的构效关系[D].合肥:合肥工业大学,2013
[20]Li X L,Xiao J J,Zha X Q,et al.Structural identification and sulfated modification of an antiglycation Dendrobium huoshanense polysaccharide[J].Carbohydr Polym,2014,106:247-254
[21]江贤敏,王正明,潘利华,等.提取温度对霍山石斛多糖理化性质及肠道黏膜免疫活性的影响[J].食品科学,2017,38(7):176-181
[22]王正明.提取温度对霍山石斛多糖理化性质及肠道粘膜免疫活性的影响[D].合肥:合肥工业大学,2013
[23]WANG Shu,WEI Feng-juan,CAI Yong-ping,et al.Anti-oxidation Activity in Vitro of Polysaccharides of Dendrobium Huoshanense and Dendrobium moniliforme[J].Agricultural Science&Technology,2009,10(6):121-124
[24]郝杰,查学强,鲍素华,等.霍山石斛不同分子量多糖体外抗氧化研究[J].食品科学,2009,30(15):94-98
[25]谷仿丽,陈乃富,余茂耘,等.霍山石斛多糖对肥胖小鼠氧化应激的影响[J].皖西学院学报,2016,32(5):4-7
[26]Luo J-P,Deng Y-Y,Zha X-Q.Mechanism of Polysaccharides from Dendrobium huoshanense on Streptozotocin-Induced Diabetic Cataract[J].Pharmaceutical Biology,2008,46(4):243-249
[27]邓媛元.霍山石斛多糖抗糖尿病性白内障的研究[D].合肥:合肥工业大学,2007
[28]李秀芳,邓媛元,潘利华,等.霍山石斛多糖对糖尿病性白内障大鼠眼球晶状体组织抗氧化作用的研究[J].中成药,2012,34(3):418-421
[29]黄静,李胜立,赵宏伟,等.霍山石斛多糖对四氯化碳致急性肝损伤小鼠的保护作用[J].中国中药杂志,2013,38(4):528-532
[30]田长城,罗建平.霍山石斛中不同多糖组分的保肝活性[J].食品科学,2015,36(7):162-166
[31]田长城.霍山石斛保肝多糖的结构表征与功效评价[D].合肥:合肥工业大学,2014
[32]孟海涛,汪鹤,查学强.霍山石斛不同提取物抗小鼠亚急性酒精性肝损伤活性的比较研究[J].食品科学,2015,36(13):229-234
[33]聂春艳,汪鹤,潘利华,等.霍山石斛水溶性多糖抗亚急性酒精性肝损伤研究[J].安徽农业科学,2017,45(17):100-105
[34]姜苏薇.霍山石斛多糖对非酒精性脂肪性肝损伤的干预及改善作用研究[D].合肥:合肥工业大学,2012
[35]潘利华,陆俊,罗建平.可食植物霍山石斛多糖对大鼠肝损伤和肝纤维化的干预[C].北京:中国食品科学技术学会年会,2010
[36]陆俊.霍山石斛多糖干预亚硒酸钠致大鼠肝损伤和肝纤维化的研究[D].合肥:合肥工业大学,2010
[37]Pan L H,Lu J,Luo J P,et al.Preventive effect of a galactoglucomannan(GGM)from Dendrobium huoshanense on seleniuminduced liver injury and fibrosis in rats[J].Experimental and toxicologic pathology:official journal of the Gesellschaft fur Toxikologische Pathologie,2012,64(7/8):899-904
[38]余刚,夏云建,尹航.霍山石斛多糖抗运动性疲劳实验研究[J].运动,2013(2):52-54
[39]夏云建,余刚.霍山石斛多糖干预对力竭运动小鼠BUN、MDA、BLA、肝糖原影响的研究[J].湖北体育科技,2012,31(6):650-653
[40]YS Hsieh,C Chien,SK Liao.etal.Structure and bioactivity of the polysaccharides in medicinal plant Dendrobium huoshanense[J].Biorganic and medicinal chemistry,2008,16(11):6054-6068
[41]Lin J,Chang Y J,Yang W B,et al.The multifaceted effects of polysaccharides isolated from Dendrobium huoshanense on immune functions with the induction of interleukin-1 receptor antagonist(IL-1ra)in monocytes[J].PloS one,2014,9(4):1-12
[42]Zha X Q,Zhao H W,Bansal V,et al.Immunoregulatory activities of Dendrobium huoshanense polysaccharides in mouse intestine,spleen and liver[J].International journal of biological macromolecules,2014,64:377-382
[43]郝冉,王正明,查学强,等.霍山石斛多糖的肠黏膜免疫调节活性及在小肠中的吸收分布[J].食品科学,2014,35(9):256-259
[44]黄森.霍山石斛多糖提取分离以及抗肿瘤活性的研究[D].合肥:合肥工业大学,2007
[45]Bao L J,Wang J H,Luo J P.Inhibitory effects of water extracts from four species of Dendrobium on HelaS3 Cells and HepG2 Cells[J].J Anhui Agric Sci,2008,36:15968-15970
[46]房雪,韩吉春,李德芳,等.霍山石斛多糖通过激活GSK-3β信号通路减轻大鼠心肌缺血-再灌注损伤[J].中药材,2017(4):926-931
[47]孟鸽,魏明,赵世光,等.霍山石斛多糖对嗜酸乳杆菌生理特性影响研究[J].食品科技,2017(4):184-187,193
[48]王长顺.霍山石斛多糖单克隆抗体的制备及多糖组织分布研究[J].安徽农业科学,2016,44(21):100-103,147

