胞内劳森菌LsaA蛋白的原核表达及间接ELISA抗体检测方法的建立
吴艳阳,杨东东,高冬生,李永涛,常洪涛,王川庆,赵 军
(河南农业大学牧医工程学院,郑州 450002)
胞内劳森菌(Lawsoniaintracellularis)是一种专性细胞内寄生细菌,主要寄生在肠黏膜上皮细胞内,引起猪的增生性肠炎[1]。临床上导致发病猪食欲下降、腹泻和生长发育迟缓,给养猪业造成巨大的经济损失[2]。猪增生性肠炎自1931年被报道以来,已经在世界主要养猪国家流行。但由于该病造成的猪死亡率较低,我国对胞内劳森菌感染的关注度并不高,有关该菌在我国猪群中的流行现状尚没有全面和明确的了解。造成这种现状的主要原因除了关注度不高之外,更主要的原因是由于检测方法的欠缺。目前,国内外用于诊断胞内劳森菌感染的方法主要是血清学和检测粪便样品的各种PCR方法[3-12]。PCR方法虽然具有特异性强、敏感度高等特点,可以实现临床样品的快速检测[13],但是该方法仅限于感染猪排菌期的粪便样品检测,通常还需要特殊的仪器对PCR样品进行后续分析,不适合大批量样品的检测[11]。通过组织病理学和免疫组织化学的方法也可以检查肠上皮细胞内的细菌,但该方法只适用于死后剖检分析[14],不适用于早期诊断。血清学诊断不仅具有较高的敏感性和特异性,且抗胞内劳森菌的特异性抗体能够在体内存在更长时间,因此能够提供更好的检测替代方法。对于胞内劳森菌的血清学诊断,已有学者运用免疫过氧化物酶单层细胞测定(IPMA)[15]和间接免疫荧光试验(IFAT)[16]检测抗胞内劳森菌的抗体,但这两种方法均需要荧光显微镜,对人员及设备的要求较高,而且试验结果判定的主观性较强。因此,亟需建立一种能够快速、准确地检测胞内劳森菌特异性抗体的血清学方法,以便进行我国猪群胞内劳森菌流行病学调查。H. T. Boesen等采用培养的胞内劳森菌的脱氧胆酸钠提取物作为包被抗原建立了一种检测胞内劳森菌特异性抗体的ELISA方法,所建立的ELISA方法能很好地用于猪增生性肠炎的诊断和猪群中增生性肠炎的流行状况评价[17]。但胞内劳森菌是一种严格的细胞内寄生细菌,培养条件要求苛刻[18],目前世界上仅有少数实验室实现了胞内劳森菌的分离培养。因此,用培养的胞内劳森菌全菌作为诊断抗原存在制备困难和成本高等诸多限制。研究能够替代胞内劳森菌全菌的新型廉价抗原将改进现有ELISA方法的不足和促进其他检测方法的建立和推广。
LsaA是胞内劳森菌的一种表面抗原,在细菌感染过程中合成,参与细菌的黏附和侵袭。已有研究证明,对猪和小鼠通过口服接种胞内劳森菌,可以在其血浆中检测出抗LsaA蛋白的抗体[19]。利用这一蛋白质作为检测抗原将对胞内劳森菌感染的检测具有直接指示作用。LsaA基因全长为0.7 kb,仅含一个ORF,编码蛋白质的相对分子质量约为27.4 ku[20]。本研究首次在大肠杆菌中表达LsaA蛋白,利用纯化的重组LsaA蛋白替代胞内劳森菌全菌提取物作为包被抗原,以期通过一系列条件的优化,初步建立检测胞内劳森菌抗体的间接ELISA方法,为胞内劳森菌流行病学调查、疫苗免疫效果的评价以及制定有效防控措施提供辅助工具。
1 材料与方法
1.1 质粒和菌种
原核表达载体pET32a(+)由河南农业大学传染病实验室保存,E.coliDH5α和BL21(DE3)感受态细胞购自北京华越洋生物。
1.2 主要试剂和材料
限制性内切酶NdeⅠ、XhoⅠ、T4 DNA连接酶均购自宝生物工程(大连)有限公司;异丙基-β-D-硫代半乳糖苷(IPTG)、氨苄青霉素(Amp)购自生工生物工程(上海)股份有限公司,HRP标记的兔抗猪IgG购自Abcam公司;3,3′,5,5′-四甲基联苯胺(TMB)和3,3-二氨基联苯胺(DAB)显色液购自北京索莱宝科技有限公司;BCA蛋白定量试剂盒和Ni-Agarose Resin购自北京康为世纪生物科技有限公司;胞内劳森菌阳性血清为利用德国柏林格公司胞内劳森菌疫苗免疫胞内劳森菌阴性健康猪,采集血液而制备,胞内劳森菌阴性血清为采集胞内劳森菌阴性健康猪血液分离制备;猪流行性腹泻病毒(PEDV)和猪传染性胃肠炎病毒(TGEV)阳性血清为PEDV和TGEV阴性健康猪经PEDV CH/ZMDZY/11株(GenBank登录号:KC196276)和TGEV Purdue株(GenBank登录号:AJ271965)灭活疫苗分别免疫后采集血液分离制备;猪霍乱沙门菌阳性血清为猪霍乱沙门菌(菌株号CVCC2139)灭活疫苗免疫猪霍乱沙门菌阴性健康猪采血分离制备,上述材料均由河南农业大学传染病实验室制备与保存;大肠杆菌(E.coli) K88猪血清由辽宁益康股份有限公司惠赠;96孔酶标板购自Corning公司。
1.3 重组表达质粒的构建
根据GenBank中登录的猪胞内劳森菌LsaA基因序列(登录号:AF498259),由生工生物工程(上海)股份有限公司优化合成LsaA基因,合成基因上游和下游分别带有NdeⅠ和XhoⅠ限制性内切酶位点,合成基因和pET32a载体分别用NdeⅠ和XhoⅠ双酶切后经琼脂糖凝胶电泳回收,两者用T4 DNA连接酶连接,连接产物转化入DH5α感受态细胞,涂布于含有100 μg·mL-1Amp的LB平板。PCR菌落鉴定阳性的克隆进一步测序鉴定,最终得到重组表达质粒pET32a-LsaA。
1.4 重组LsaA蛋白的表达与纯化
将鉴定正确的重组质粒pET32a-LsaA转化表达宿主菌BL21(DE3)感受态细胞,挑取单菌落于含有100 μg·mL-1Amp的LB液体培养基中,37 ℃ 250 r·min-1,培养至OD600 nm为0.8,加入IPTG至终浓度0.1 mmol·L-1,37 ℃,250 r·min-1振荡诱导培养6 h。离心收集菌体,超声波破碎菌体。按照Ni-Agarose His标签蛋白纯化试剂盒说明书纯化重组目的蛋白,用BCA蛋白定量试剂盒测定蛋白含量,并经SDS-PAGE分析。
1.5 重组蛋白的Western blot 鉴定
将纯化后的重组LsaA蛋白转移至硝酸纤维素(NC)膜上,将含有LsaA蛋白NC膜切成多条并置于含5%脱脂奶粉的封闭液中4 ℃封闭过夜。分别以猪抗胞内劳森菌阳性血清(1∶200稀释)、胞内劳森菌阴性血清、猪流行性腹泻病毒阳性血清、猪传染性胃肠炎病毒阳性血清、猪霍乱沙门菌阳性血清和大肠杆菌K88猪血清为一抗,37 ℃孵育2 h,洗膜后用HRP标记的兔抗猪IgG(1∶5 000稀释) 为二抗,37 ℃孵育2 h,最后用DAB显色试剂盒显色。
1.6 最佳工作浓度与工作条件的确定
1.6.1 抗原最佳包被浓度与血清最佳稀释度的确定 采用方阵滴定法,将纯化的LsaA蛋白用包被稀释液稀释为2、4、6、8 μg·mL-1分别加入96孔酶标板内,每孔100 μL,每个样品设置3个重复,于37 ℃孵育1 h,4 ℃包被过夜;次日弃去包被液,用PBST洗涤3次;在相应浓度的抗原孔内加入1∶25、1∶50、1∶100、1∶200、1∶400稀释的猪抗胞内劳森菌阳性血清和阴性血清,每孔100 μL,37 ℃孵育1.5 h,洗涤3次;每孔加入100 μL 1∶10 000稀释的兔抗猪IgG-HRP,37 ℃孵育1.5 h,洗涤5次;每孔加入100 μL TMB显色液,37 ℃显色10 min,每孔加入100 μL终止液(2 mol·L-1H2SO4)终止显色。在Multiskan Go酶标仪(Thermo)上读取OD450 nm值,比较阳性、阴性血清的OD值,并计算相应的阳性血清(P)与阴性血清(N)的OD值的比值(P/N值),以阳性血清OD450 nm值接近于1.0,且P/N值最大的孔所对应的抗原包被浓度和血清稀释度为抗原最佳包被浓度和血清最佳稀释度。
1.6.2 抗原包被条件和封闭条件的确定 按照“1.6.1”确定的最适包被抗原浓度包被酶标板,按照以下3种方式进行包被:4 ℃过夜,37 ℃ 1 h后4 ℃过夜,37 ℃ 2 h,然后采用5%脱脂奶和含0.2%吐温-20的PBS做封闭液封闭抗原孔,37 ℃分别封闭0.5、1、1.5、2 h,随后按照“1.6.1”条件进行ELISA测定,确定最佳抗原包被条件和封闭条件。
1.6.3 酶标抗体浓度及其反应条件的确定 按上述筛选的条件进行试验,将HRP标记的兔抗猪IgG进行1∶5 000、1∶10 000、1∶20 000、1∶40 000稀释,在37 ℃分别孵育1、1.5和2 h,比较各组阳性血清和阴性血清的OD450 nm值,以阳性血清OD450 nm值接近于1.0,且最大的P/N值所对应的酶标抗体浓度和反应时间作为酶标抗体的最佳工作浓度和反应条件。
1.6.4 显色时间的优化 按上述确定的条件进行间接ELISA,显色时间分别为10、15、20、25 min,比较阳性血清和阴性血清的OD450 nm值,并计算P/N值,以阳性血清OD450 nm值接近于1.0,且最大的P/N值所对应的显色时间为最佳显色时间。
1.7 血清阴阳性临界值的确定
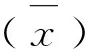
1.8 特异性与敏感性试验
用建立的间接ELISA方法检测大肠杆菌、沙门菌、猪流行性腹泻病毒和猪传染性胃肠炎病毒抗血清,同时设立抗胞内劳森菌阴、阳性血清对照,评价方法的特异性。
将胞内劳森菌的抗血清作1∶200、1∶400、1∶800、1∶1 600、1∶3 200倍比稀释后,用建立的ELISA方法检测其中的特异抗体,每个稀释度设3个重复,评价方法的敏感性。
1.9 重复性试验
用同一批次重组蛋白包被酶标板,用建立的间接ELISA方法测定5份胞内劳森菌阳性血清和5份 阴性血清。另取3个批次的重组蛋白包被酶标板进行间接ELISA检测,每份血清样品设3个重复,对检测结果进行统计学分析。
1.10 符合率试验
收集河南省及周边省份疑似胞内劳森菌感染的发病猪的血清和相应的回肠样品50份,分别用建立的间接ELISA方法和检测胞内劳森菌病原的PCR方法[6]进行平行检测,并统计分析,比较两者的符合率。
1.11 临床血清样品检测
用所建立的间接 ELISA 方法对河南省不同地区猪场送检的232份来自临床有腹泻症状的病猪的血清样品进行胞内劳森菌抗体检测,初步了解河南省不同地区猪群中胞内劳森菌的感染和流行情况。
2 结 果
2.1 重组胞内劳森菌LsaA蛋白的制备
在37 ℃下经IPTG诱导3 h后,pET32a-LsaA/BL21(DE3)表达的重组蛋白相对分子质量约27 ku,与预期大小一致,应用Ni-Agarose His标签蛋白纯化试剂盒能够有效地纯化目的蛋白(图1A),经Western blot检测,该蛋白可以与胞内劳森菌抗血清特异性结合,在预计相对分子质量大小位置出现特异性条带;而不与胞内劳森菌阴性血清、猪流行性腹泻病毒阳性血清、猪传染性胃肠炎病毒阳性血清、猪霍乱沙门菌阳性血清和大肠杆菌K88猪血清发生特异性反应(图1B)。纯化后的蛋白用BCA蛋白定量试剂盒测定蛋白浓度为0.38 g·L-1。
2.2 ELISA抗原和抗体的最佳工作浓度和反应条件
采用方阵滴定法对不同浓度的包被抗原、包被条件、血清最佳稀释度、封闭液和封闭条件、酶标抗体的工作浓度和反应条件,以及显色液显色时间等因素进行优化。结果显示,用2 μg·mL-1的重组胞内劳森菌LsaA蛋白在37 ℃孵育1 h,然后4 ℃包被过夜,用0.2%吐温-20的PBS在37 ℃封闭2 h,待检血清1∶200倍稀释,与包被抗原37 ℃下反应2 h,酶标二抗1∶10 000倍稀释,与待检血清在37 ℃ 下作用1.5 h,TMB显色10 min,ELISA的P/N值最大。
2.3 血清阴阳性判定标准
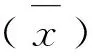
2.4 敏感性和特异性
用建立的方法检测大肠杆菌、沙门菌、猪流行性腹泻病毒和猪传染性胃肠炎病毒的抗血清时,OD450 nm值均小于0.239,表明建立的ELISA方法与常见猪腹泻病原抗血清无交叉反应,具有良好的特异性。
敏感性的检测发现,当阳性血清做1∶800倍稀释时,OD450 nm值为0.353±0.031,高于0.304;当1∶1 600倍稀释时,OD450 nm值为0.206±0.043,低于0.239,所以,该试验能检出的血清抗体效价为1∶800,具有较好的敏感性。
2.5 重复性试验
当用同一批次重组LsaA蛋白包被酶标板,重复3次检测相同血清样品,或者用3个批次的重组蛋白包被酶标板进行间接ELISA检测,其变异系数分别为0.352%~2.752%和0.877%~3.000%,均小于5%,批内和批间重复试验的结果表明,重组LsaA蛋白作为包被抗原建立的间接ELISA具有很好的重复性。
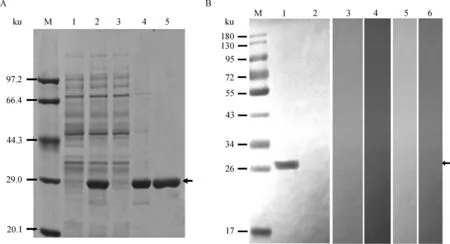
A. 猪胞内劳森菌重组LsaA蛋白的表达与纯化(M.蛋白质低相对分子质量标准;1. pET32a-LsaA/BL21(DE3)未诱导;2. pET32a-LsaA/BL21(DE3)诱导;3. pET32a-LsaA/BL21(DE3)诱导破菌后上清;4. pET32a-LsaA/BL21(DE3)诱导破菌后沉淀;5.纯化的重组LsaA蛋白);B. 重组LsaA蛋白的Western blot分析(M. 预染的梯度蛋白质相对分子质量标准;1. 重组LsaA蛋白与猪抗胞内劳森菌阳性血清反应性;2. 重组LsaA蛋白与胞内劳森菌阴性血清反应性;3. 重组LsaA蛋白与猪流行性腹泻病毒阳性血清反应性;4. 重组LsaA蛋白与猪传染性胃肠炎病毒阳性血清反应性;5. 重组LsaA蛋白与猪霍乱沙门菌阳性血清反应性;6. 重组LsaA蛋白与大肠杆菌K88猪血清反应性)A.The expression and purification of recombinant Lawsonia intracellularis LsaA protein (M. Low molecular weight protein marker; 1. Non-induced pET32a-LsaA/BL21(DE3) ; 2. Induced pET32a-LsaA/BL21 (DE3) ; 3. Supernatant of induced pET32a-LsaA/BL21(DE3) lysate; 4. Pellet of induced pET32a-LsaA/BL21(DE3) lysate; 5. Purified recombinant LsaA protein); B. Western blot analysis for recombinant L. intracellularis LsaA protein (M. Prestained protein ladder; 1. Reactivity of recombinant LsaA protein against anti-L. intracellularis positive serum; 2. Reactivity of recombinant LsaA protein against anti-L. intracellularis negative serum; 3. Reactivity of recombinant LsaA protein against anti-porcine epidemic diarrhea virus serum; 4. Reactivity of recombinant LsaA protein against anti-transmissible gastroenteritis virus serum; 5. Reactivity of recombinant LsaA protein against anti- Salmonella choleraesuis serum; 6. Reactivity of recombinant LsaA protein against anti-E. coli K88 serum) 图1 重组胞内劳森菌LsaA蛋白的SDS-PAGE与Western blot 分析Fig.1 SDS-PAGE and Western blot analysis of recombinant Lawsonia intracellularis LsaA protein
2.6 符合率试验
利用建立的间接ELISA方法对临床疑似胞内劳森菌感染猪的50份血清样品进行检测,同时利用针对胞内劳森菌LaspA基因的特异性引物进行PCR检测对应的50份回肠样品中的胞内劳森菌。结果显示,PCR检测出胞内劳森菌阳性回肠样品50份,ELISA检测对应猪血清中抗胞内劳森菌抗体亦为阳性,两者的符合率为100%。
2.7 临床血清样品检测
用所建立的间接 ELISA 方法对河南省不同地区猪场送检的232份来自临床有腹泻症状的病猪的血清样品进行胞内劳森菌抗体检测,232份猪血清样品共有71份显示为胞内劳森菌抗体阳性,阳性率在13.3%~57.1%,平均阳性率为30.6%(表1)。
3 讨 论
由专性细胞内寄生的胞内劳森菌引起的猪增生性肠炎自1931年首次被报道以来,目前已经分布于世界各主要养猪国家,成为集约化养殖场常见疾病之一。肖爱欢等首先报道了猪增生性肠炎在我国的流行[21]。由于该病临床上导致的猪死亡率不高和受到检测方法的限制,对于该病在我国猪群中的流行情况至今没有全面的了解。目前用于粪便样品和肠道组织中检测胞内劳森菌的各类PCR方法和基于血清学的免疫荧光技术,受到排菌期和特定仪器设备的限制,较难实现对临床大量样品的检测。此外,PCR并不能区分粪便中的胞内劳森菌是否有活性,从粪便中检测到胞内劳森菌并不能说明猪正感染着细菌,检测到胞内劳森菌DNA也并不能说明
表1河南省部分地区胞内劳森菌血清学调查情况
Table1SeroepidemiologicalsurveyofL.intracellularisinfectioninpartialregionsofHenanprovince
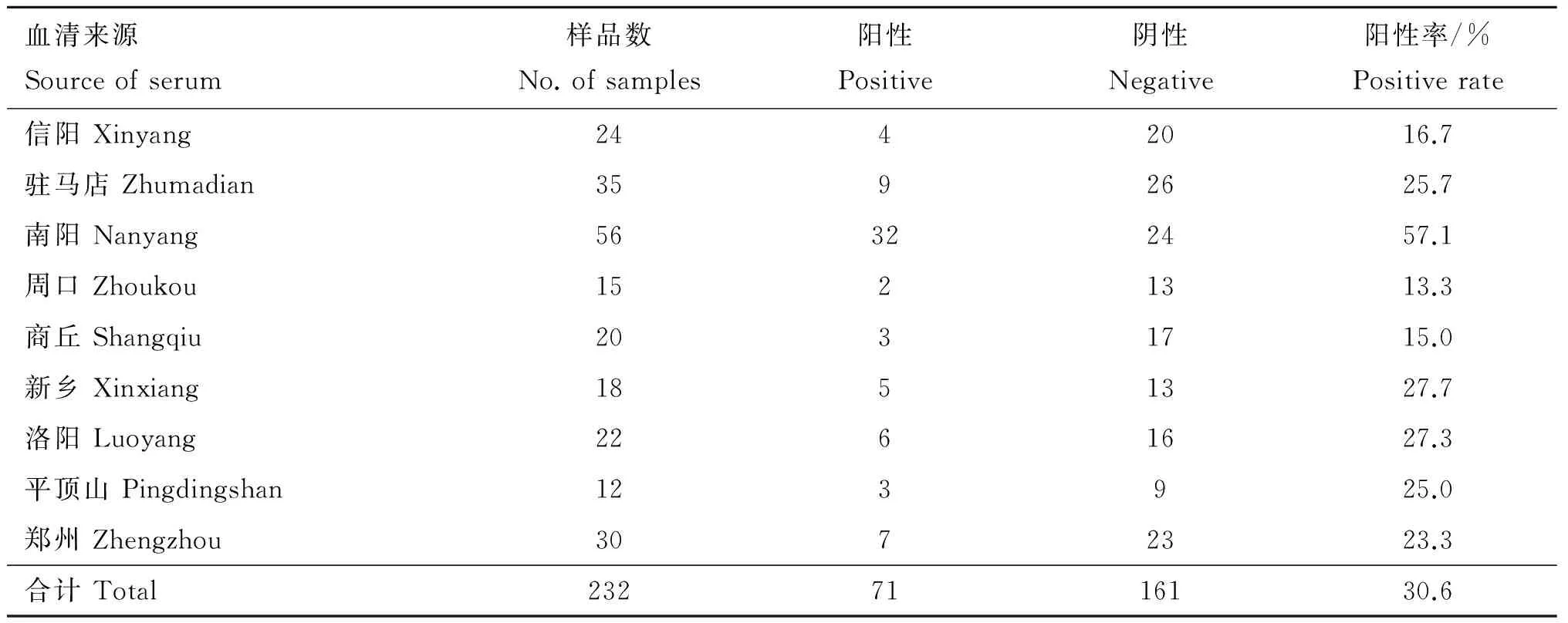
血清来源Sourceofserum样品数No.ofsamples阳性Positive阴性Negative阳性率/%Positiverate信阳Xinyang2442016.7驻马店Zhumadian3592625.7南阳Nanyang56322457.1周口Zhoukou1521313.3商丘Shangqiu2031715.0新乡Xinxiang1851327.7洛阳Luoyang2261627.3平顶山Pingdingshan123925.0郑州Zhengzhou3072323.3合计Total2327116130.6
该细菌就是引起腹泻的原因。但胞内劳森菌感染猪后能诱导机体产生特异性抗体,且抗体通常能在机体内存在相当长的时间。LsaA作为胞内劳森菌的一种表面蛋白,参与细菌的黏附和侵袭,而且在感染动物血浆中可以检测出抗LsaA蛋白的抗体[19]。因此,利用这一蛋白作为检测抗原建立间接ELISA检测针对胞内劳森菌的特异性抗体,不仅克服了现有其他检测方法的局限,而且检测结果可以作为胞内劳森菌前期感染的指示。借助大型ELISA工作站等平台可以实现大量临床血清样品的快速、准确检测。
胞内劳森菌是一种严格的细胞内寄生细菌,其培养条件要求苛刻,国内尚未见成功分离培养该菌的报道,国外已经有用胞内劳森菌全菌裂解物作为抗原研发的检测胞内劳森菌抗体的试剂盒,但价格昂贵。用该试剂盒检测临床大量血清样品,进行胞内劳森菌血清流行病学调查的成本很高。国内张曙俭和刘磊分别以胞内劳森菌外膜蛋白OMP作为抗原建立了ELISA方法[12, 22],但未见后期临床应用的报道。本试验原核表达了胞内劳森菌表面蛋白LsaA。Western blot分析结果显示,表达的重组LsaA蛋白与胞内劳森菌阳性血清具有良好的免疫反应性,而与胞内劳森菌阴性血清和其他猪腹泻病原抗血清均不发生特异性反应。在此基础上,用纯化的LsaA蛋白替代胞内劳森菌全菌裂解物作为包被抗原建立了检测胞内劳森菌抗体的间接ELISA,所建立ELISA方法特异性良好,检测抗PEDV、TGEV、大肠杆菌、沙门菌阳性血清均无交叉反应;敏感性也较高,阳性血清1∶800稀释,P/N值仍在阳性范围;批内和批间重复性试验显示所建立ELISA重复性良好。对临床上疑似胞内劳森菌感染猪血清样品的检测结果与胞内劳森菌病原检测结果一致,说明所建方法具有较高的可靠性和准确性,可用于胞内劳森菌感染期的诊断和血清流行病学调查。
在成功建立检测胞内劳森菌抗体间接ELISA方法的基础上,本试验对河南省内部分地区猪场送检的临床有腹泻症状猪的血清样品进行了检测。检测结果显示,河南省内被检猪场均存在胞内劳森菌抗体阳性猪,其中河南南阳地区送检样品阳性率最高,高达57.1%,具体原因尚待进一步确定。通过样品溯源了解到南阳地区送样猪场的育肥猪确实存在排水泥样和带血稀粪,部分猪生长状况不佳的情况。从上述送检样品猪场采集的粪便样品经PCR检测也确为胞内劳森菌阳性,因长期便血而衰竭死亡猪的死后剖检也呈现典型的猪回肠炎病变。上述结果也在一定程度上反映了本试验所建立ELISA方法用于胞内劳森菌感染情况的血清流行病学调查的可靠性。
4 结 论
成功表达胞内劳森菌表面蛋白LasA,并建立基于LsaA蛋白的间接ELISA方法,该方法检测胞内劳森菌抗体与其他常见猪腹泻病病原抗血清不发生交叉反应,对胞内劳森菌感染阳性猪的检测结果与PCR检测病原结果有很高的符合率,敏感性和重复性良好。应用建立的ELISA方法对河南省部分地区猪场胞内劳森菌的感染情况进行了血清流行病学调查,结果显示被检地区猪场均存在不同程度的胞内劳森菌抗体阳性,提示养猪业应提高对胞内劳森菌感染的重视度,加强血清学监测,及早采取有效措施控制胞内劳森菌感染在我国的流行。
参考文献(References):
[1] 王元凯, 严亚贤. 胞内劳森菌与猪增生性肠炎的研究进展[J]. 中国兽医科学, 2008, 38(6): 540-543.
WANG Y K, YAN Y X. Research advance inLawsoniaintracellularisand porcine proliferative enteritis[J].ChineseVeterinaryScience, 2008, 38(6): 540-543. (in Chinese)
[2] 余彦国, 张 瑾. 猪增生性肠炎的研究进展[J]. 畜牧兽医杂志, 2009, 28(3): 33-36.
YU Y G, ZHANG J. Research advance in porcine proliferative enteritis[J].JournalofAnimalScienceandVeterinaryMedicine, 2009, 28(3): 33-36. (in Chinese)
[3] 李 磊. 胞内劳森菌IPMA抗体检测方法的建立及猪源性胞内劳森菌在小鼠体内的复制[D]. 南京: 南京农业大学, 2014.
LI L. The establishment ofLawsoniaintracellularisIPMA antibody detection assay and porcine endogenous copy ofLawsoniaintracellularisin mice[D]. Nanjing: Nanjing Agricultural University, 2014.(in Chinese)
[4] 罗 露. 猪胞内劳森氏菌LAMP、PCR快速检测方法的建立及应用[D]. 雅安: 四川农业大学, 2015.
LUO L. Construction and application of loop-mediated isothermal amplification and PCR for rapid detection ofLawsoniaintracellularis[D]. Ya’an: Sichuan Agricultural University, 2015. (in Chinese)
[5] 马景霞, 杨灵芝, 郭显坡. 猪胞内劳森菌定量PCR检测方法的建立与初步应用[J]. 畜牧与兽医, 2015, 47(2): 74-77.
MA J X, YANG L Z, GUO X P. Development and application of quantative PCR for detection ofLawsoniaintracellularis[J].AnimalHusbandry&VeterinaryMedicine, 2015, 47(2): 74-77. (in Chinese)
[6] 董炳梅, 唐 娜, 王金良, 等. 胞内劳森氏菌PCR检测方法的建立与应用[J]. 中国预防兽医学报, 2011, 33(5): 370-373.
DONG B M, TANG N, WANG J L, et al. Development and application of PCR assay for the detection ofLawsoniaintracellularis[J].ChineseJournalofPreventiveVeterinaryMedicine, 2011, 33(5): 370-373. (in Chinese)
[7] 孙 娜, 刘 杏, 陈 强, 等. 胞内劳森菌PCR检测方法的建立及初步应用[J]. 中国兽医学报, 2017, 37(1): 36-39.
SUN N, LIU X, CHEN Q, et al. Establishment and primary application of PCR method for detection ofLawsoniaintracellularis[J].ChineseJournalofVeterinaryScience, 2017, 37(1): 36-39. (in Chinese)
[8] 彭 忠, 涂志勤, 梁 婉, 等. 胞内劳森菌巢式PCR检测方法的建立及初步临床应用[J]. 中国兽医学报, 2017, 37(1): 40-46.
PENG Z, TU Z Q, LIANG W, et al. Development and preliminary application of a nested PCR method for detection ofLawsoniaintracellularisin feces of pigs[J].ChineseJournalofVeterinaryScience, 2017, 37(1): 40-46. (in Chinese)
[9] 郑新添, 黄翠琴, 黄其春, 等. 胞内劳森菌SYBR Green Ⅰ real-time PCR检测方法的建立[J]. 西北农林科技大学学报: 自然科学版, 2015, 43(12): 29-34.
ZHENG X T, HUANG C Q, HUANG Q C, et al. Establishment of SYBR Green Ⅰ real-time PCR assay for detection ofLawsoniaintracellularis[J].JournalofNorthwestA&FUniversity:NaturalScienceEdition, 2015, 43(12): 29-34. (in Chinese)
[10] 郑新添, 黄其春, 黄翠琴, 等. 基于胞内劳森菌16S rDNA基因的TaqMan荧光定量PCR检测方法的建立与应用[J]. 中国兽医学报, 2014, 34(11): 1753-1757.
ZHENG X T, HUANG Q C, HUANG C Q, et al. Establishment and application of TaqMan real-time fluorescent quantitative PCR for detection ofLawsoniaintracellularis[J].ChineseJournalofVeterinaryScience, 2014, 34(11): 1753-1757. (in Chinese)
[11] 白挨泉, 郭建超, 覃宗华, 等. 胞内劳森菌TaqMan荧光定量PCR检测方法的建立[J]. 畜牧兽医学报, 2014, 45(10): 1733-1738.
BAI A Q, GUO J C, QIN Z H, et al. Development of a TaqMan quantitative polymerase chain reaction assay for detectingLawsoniaintracellularis[J].ActaVeterinariaetZootechnicaSinica, 2014, 45(10): 1733-1738. (in Chinese)
[12] 张曙俭. 劳森氏胞内菌的PCR检测方法及其抗体间接ELISA检测方法的建立与应用[D]. 南京: 南京农业大学, 2012.
ZHANG S J. Development of PCR and indirect ELISA method forLawsoniaintracellularis[D]. Nanjing: Nanjing Agricultural University, 2012. (in Chinese)
[13] JONES G F, WARD G E, MURTAUGH M P, et al. Enhanced detection of intracellular organism of swine proliferative enteritis, ileal symbiont intracellularis, in feces by polymerase chain reaction[J].JClinMicrobiol, 1993, 31(10): 2611-2615.
[14] JENSEN T K, MØLLER K, LESER T D, et al. Comparison of histology, immunohistochemistry and polymerase chain reaction for detection ofLawsoniaintracellularisin natural porcine proliferative enteropathy[J].EurJVetPathol, 1997, 3(3): 115-123.
[15] GUEDES R M C, GEBHART C J, ARMBRUSTER G A, et al. Serologic follow-up of a repopulated swine herd after an outbreak of proliferative haemorrhagic enteropathy[J].CanJVetRes, 2002, 66(4): 258-263.
[16] KNITTEL J P, JORDAN D M, SCHWARTZ K J, et al. Evaluation of antemortem polymerase chain reaction and serologic methods for detection ofLawsoniaintracellularis-exposed pigs[J].AmJVetRes, 1998, 59(6): 722-726.
[17] BOESEN H T, JENSEN T K, MØLLER K, et al. Evaluation of a novel enzyme-linked immunosorbent assay for serological diagnosis of porcine proliferative enteropathy[J].VetMicrobiol, 2005, 109: 105-112.
[18] LAWSON G H, MCORIST S, JASNI S, et al. Intracellular bacteria of porcine proliferative enteropathy: cultivation and maintenanceinvitro[J].JClinMicrobiol, 1993, 31(5): 1136-1142.
[19] MCCLUSKEY J, HANNIGAN J, HARRIS J D, et al. LsaA, an antigen involved in cell attachment and invasion, is expressed byLawsoniaintracellularisduring infectioninvitroandinvivo[J].InfectImmun, 2002, 70(6): 2899-2907.
[20] 陈玉红, 郑新添, 李晓华, 等. 胞内劳森氏菌lsaA基因克隆与序列分析[J]. 福建畜牧兽医, 2015, 37(6): 18-20.
CHEN Y H, ZHENG X T, LI X H, et al. Cloning and sequence analysis oflsaA gene ofLawsoniaintracellularis[J].FujianJournalofAnimalHusbandryandVeterinaryMedicine, 2015, 37(6): 18-20. (in Chinese)
[21] 肖爱欢, 谢丽华, 廖承球, 等. 猪胞内劳森氏菌GXNN株4个抗原性候选基因抗原性分析[J]. 广西农业科学, 2010, 41(1): 62-65.
XIAO A H, XIE L H, LIAO C Q, et al. Analysis of antigenicity in four antigenic candidate genes ofLawsoniaintracellularisGXNN strain[J].GuangxiAgriculturalSciences, 2010, 41(1): 62-65. (in Chinese)
[22] 刘 磊. 猪胞内劳森氏菌抗原候选蛋白的原核表达及间接ELISA检测方法的建立与初步应用[D]. 南宁: 广西大学, 2013.
LIU L. Prokaryotic expression the candidate antigen protein of porcineLawssoniaintracellularis, establishment of an inderect ELISA for detection of antibody againstLawsoniaintracellularisand the preliminary application[D]. Nanning: Guangxi University, 2013. (in Chinese)

