藜麦种子总黄酮的提取及体外抑菌作用
董 飞,郭晓农
(西北民族大学科学与工程学院,甘肃 兰州 730000)
藜麦(Chenopodium quinoa)是在安第斯地区种 植的具有高营养价值的天然食用植物,属一年生的藜科(Chenopodiaceae)双子叶草本植物[1-3]。藜麦种子内含丰富的黄酮、多种氨基酸、类黄酮、皂苷、和维生素C等多种对人体有益的化合物。藜麦种子的蛋白质以及油脂质量分数丰富,至今仍作为安第斯地区的主要蛋白质来源之一,因此在世界范围内得以普遍种植[4-5]。近年来,在我国西北地区已经有一定的适应性种植并取得良好成果。2015年由国家粮食局颁布的LS/T 3245-2015《藜麦米》行业标准,使我国的藜麦种植更加科学和规范。
黄酮类化合物在多种植物体内其含量丰富,且种类多样,具有多种药用功效。研究证明,一些植物黄酮类化合物具有抑菌活性,并从中提取分离得到具有广谱抗菌效果且低毒的黄酮类化合物,丰富了天然抗菌药物的种类[6]。迄今为止,国内外对藜麦生理抗逆性相关研究较多,而藜麦次生代谢产物抑菌活性的研究鲜有报道[7-10]。我们提取分离藜麦种子总黄酮并研究了其对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、白色念珠菌、铜绿假单胞菌的抑菌作用,以期为藜麦相关次生代谢产物的研究及开发利用提供支持。
1 材料与方法
1.1 供试材料
1.1.1 原料 指示藜麦品种为陇藜1号,由甘肃省农业科学院提供。
1.1.2 菌种大肠杆菌(Escherichia coli)、金色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、白色念珠菌(Moniliaalbican)、铜绿假单胞菌(Pseudomonas aeruginosa)均由西北民族大学实验中心提供。
1.1.3 试剂与药品 牛肉膏蛋白胨培养基由北京奥博星生物技术有限责任公司提供,细菌级琼脂粉由杭州微生物试剂有限公司提供,营养肉汤培养基由青岛高科园海博生物技术有限公司提供,其余试剂均购自上海生工有限公司分析纯试剂。
1.2 仪器与设备
旋转蒸发仪(RE-2000E),上海耀裕仪器设备有限公司;电子天平(YP1201N),上海精密科学仪器有限公司;立式压力蒸汽灭菌器(LDZX-75KB),上海申安医疗器械厂;恒温振荡器(THZ-98AB),上海一恒科学仪器有限公司;恒温恒湿箱(HWS-270),宁波东南仪器有限公司;洁净工作台(SW-CJ-2F),苏州苏洁净化设备有限公司;冰箱(BCD-312WDPV),青岛海尔股份有限公司。
1.3 方法
1.3.1 藜麦种子的预处理 将用蒸馏水冲洗过后的藜麦种子在60℃烘箱烘24 h,充分干燥[11],粉碎备用。
1.3.2 脱脂 称量烘干后的藜麦种子粉末30 g,加入10倍体积(V/m)的石油醚(沸程为60~90℃)浸泡[12],利用索氏提取器进行3次脱脂操作,弃去石油醚,自然挥干后可得到藜麦种子脱脂粉末。
1.3.3 总黄酮的提取 称取经脱脂处理的藜麦种子粉末30 g,按料液质量体积比1∶30加入80%乙醇,加热煮沸回流提取3次,每次1 h,合并3次提取液,然后用旋转蒸发仪蒸发以上合并提取液至原体积的1/4,得到浓缩液。将所得浓缩液于90℃水浴锅中水浴2 h至叶绿素完全析出,滤除叶绿素沉淀后加3倍体积95%乙醇静置48 h进行醇沉(醇沉3次)以去除杂蛋白[11],过滤后用旋转蒸发仪加热浓缩至浸膏备用。
1.3.4 总黄酮质量分数的测定 按照标准芦丁-吸光度测定法,精密称取藜麦种子提取物约10 mg,加60%乙醇定容至100 mL,取出0.5 mL置于10 mL具塞试管中,按照芦丁标准曲线制备进行操作,以样品液作空白对照溶液,于510 nm波长下测得样品吸光度值。根据标准芦丁标准曲线所得的芦丁标准方程[9],可求得藜麦种子的总黄酮质量分数。计算公式如下:
总黄酮的得率(%)=[(C×V1×V2×10-3)/M]×V0
式中C为测定样品的质量浓度(g/L);V0为测定吸光度所用样品的体积(mL);V1为测定时的稀释体积(mL);V2为样品定容后的体积(mL);M为样品质量(g)[1]。
1.4 菌种的活化
分别将金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、铜绿假单胞菌、白色念珠菌从4℃冰箱取出自然升温至室温,然后接种于牛肉膏蛋白胨斜面培养基上,于37℃恒温培养箱下培养24 h进行活化[13],于4℃冰箱保存备用。
1.5 菌悬液的制备
用接种环分别挑取活化后的菌种接种于营养肉汤中,在37℃恒温震荡培养箱中震荡培养10 h后作为原菌液,采用比浊法用0.5麦氏比浊管对比配制菌体悬浮液,用灭菌生理盐水将各原菌液稀释,使菌体悬液的菌数为1×107~8个/mL。
1.6 药液配制
严格无菌操作,用无菌水将待测原液依次配制成质量浓度分别为 1 024、512、256、128、64、32、16、8、4、2 mg/mL的溶液。
1.7 藜麦种子总黄酮的抑菌实验
1.7.1 96孔板微量法 取无菌96孔板,每孔按浓度梯度加入药液0.1mL,第11个孔为庆大霉素(8万单位/mL)阳性对照,第12个孔为不含药物的无菌生理盐水的阴性对照。此时各孔的药物浓度依次为1 024、512、256、 128、 64、 32、16、 8、4、2 mg/mL。再分别向各孔加入稀释好的菌液0.1 mL[14],使每孔的最终菌液浓度约为5×106CFU/mL。第1个孔至第10个孔的最终药物浓度分别为512、256、128、64、32、16、8、4、2、1 mg/mL[15]。继续将其于37℃下培养18~24 h,观察肉汤透明度,浑浊说明孔内有微生物生长,孔内澄清不长菌时的最高稀释度即为该微生物的最低抑菌浓度。阴性对照孔应有微生物生长,阳性对照孔应无微生物生长,否则实验无效。
1.7.2 牛津杯法[12]吸取各稀释好的菌液0.2 mL加入营养琼脂平板,用无菌三角涂布棒将菌液涂布均匀以制备染菌培养皿。将平板在超净工作台放置3 min,培养皿干燥后待用。所有操作在无菌的超净工作台内严格执行。
在无菌的超净工作台内严格操作,在每个染菌培养皿内垂直贴放2个牛津杯(内径6 mm、外径8 mm、高10 mm的圆形小管),用无菌镊子取经高压灭菌后的牛津杯,轻轻贴放于染菌培养基表面,保证牛津杯与平皿的边缘相距约10 mm以上,牛津杯间距20 mm以上,牛津杯之间对称放置。放好后,轻压牛津杯上沿使其与培养基接触无缝隙,在各牛津杯中加入各浓度的药液0.1 mL,以加入无菌生理盐水0.1 mL作为阴性对照,同时选用庆大霉素(市售8万单位/mL)0.1 mL作为阳性对照。每组浓度做3个平行,盖好培养皿,做好分类标记和日期,置于37℃培养箱培养18~24 h后进行实验结果的观察。观察抑菌实验结果并测量抑菌圈时,使用数显游标卡尺对完全透明且形状均匀的抑菌圈进行测量,实验重复3次取其平均值。若抑菌环直径大于8.0 mm,则判为有抑菌作用,反之,则判为无抑菌作用。阴性对照应没有抑菌圈产生,否则判定实验结果无效。
2 结果与分析
2.1 藜麦种子总黄酮质量分数
通过图1曲线可以得到回归方程A=0.130 9 C-0.106 3(R2=0.995 3)。用标准芦丁-吸光度测定法测得1 mg/mL质量浓度的藜麦种子总黄酮提取物的吸光值A为0.039 0,根据标准曲线可得出藜麦种子总黄酮质量浓度为0.017 0 mg/mL,3.825 6 g藜麦种子总黄酮提取物中黄酮的质量分数为0.44%。

图1 藜麦种子总黄酮质量浓度的测定
2.2 藜麦种子总黄酮的抑菌效果
2.2.1 96孔板微量法 从表1可以看出,藜麦种子总黄酮对供试微生物有一定的抑制作用,抑菌浓度(MIC值)分别为大肠杆菌32 mg/mL、枯草芽孢杆菌64 mg/mL、铜绿假单胞菌256 mg/mL、白色念珠菌128 mg/mL、金黄色葡萄球菌512 mg/mL。
2.2.2 牛津杯法 由表2可以看出,藜麦种子总黄酮对几种供试微生物有一定的抑菌作用,对大肠杆菌、枯草芽孢杆菌、白色念珠菌、铜绿假单胞菌的敏感度不同。并且随着浓度的降低,其抑菌效果也在逐步降低。由图2可以看出,藜麦种子总黄酮对几种微生物的抑菌效果由大到小依次为大肠杆菌、枯草芽孢杆菌、白色念珠菌、铜绿假单胞菌、金黄色葡萄球菌。

表1 藜麦种子总黄酮对几种微生物的最小抑菌浓度①
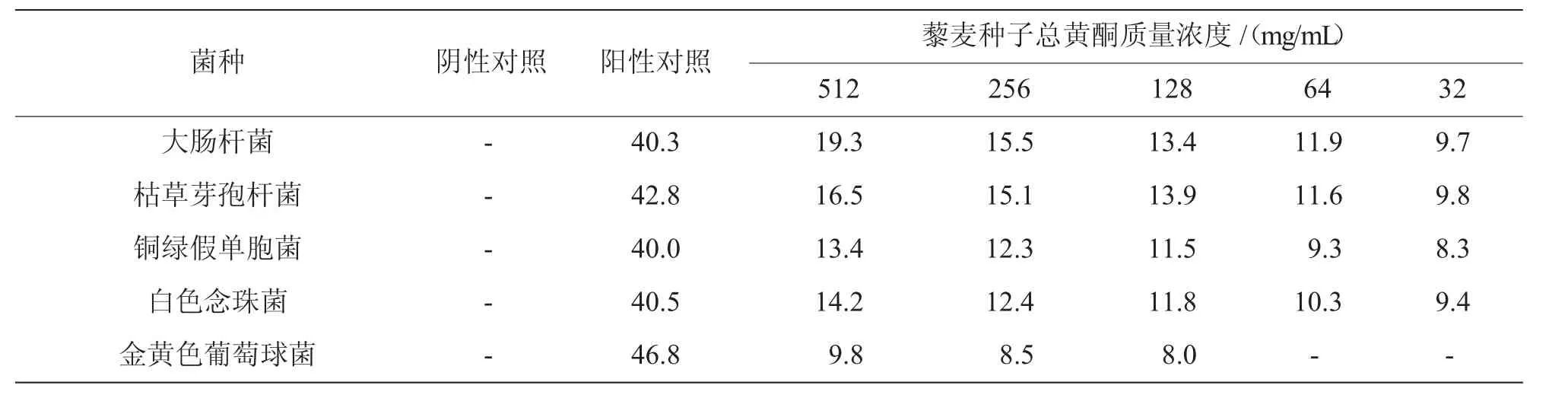
表2 藜麦种子总黄酮对几种微生物的抑菌圈直径① mm

图2 藜麦种子总黄酮对几种微生物的抑菌作用
3 小结与讨论
探究了藜麦种子总黄酮金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、铜绿假单胞菌、白色念珠菌的抑菌效果,结果表明,藜麦种子总黄酮对革兰氏阴性菌大肠杆菌和革兰氏阳性菌的枯草芽孢杆菌具有良好的抑菌作用,对革兰氏阴性菌的铜绿假单胞菌和真菌中的白色念珠菌具有一定的抑菌作用,对金黄色葡萄球菌基本没有抑菌作用。这与其他研究者的结论并不吻合[16-18],可能是由于藜麦种子总黄酮成分并不单一,其抗菌活性可能受到多种化学成分的联合效应,而一些非活性物质有可能相互干扰并影响其抑菌效果,其中有些成分还可成为很好的细菌培养基成分,促进了微生物的生长。
从植物中提取的天然产物一直以来备受关注。张金杰等[19]研究发现,野菊花中的蒙花苷单体对葡萄牙假丝酵母的体外抗菌活性较好,杨静等[20]等在甘草中确定甘草素、甘草查尔酮A为主要抑菌成分,戴航等[21]苦槛蓝叶中分离得到的桔皮素、甜橙素、二氢山柰酚、木犀草素这四种黄酮类化合物具有较好的抑菌活性,杨秀芳等[22]水杨梅中得到的β-谷甾醇、熊果酸、山奈酚、槲皮素、山奈酚-3-O-β-D-葡萄糖苷、槲皮素-3-O-β-D-葡萄糖苷和胡萝卜苷对测试的5种细菌具有不同的抑制作用,李晶晶等[23]在牛耳枫果实中分离出山奈酚并测定其对3种植物病原菌的抑菌作用。
藜麦种子中黄酮含量较为丰富,天然黄酮类化合物种类多样且结构复杂,但其中究竟是哪种物质抑菌活性最强目前尚不明确。本文仅限于对藜麦种子总黄酮的粗提物抑菌活性的研究,对藜麦种子总黄酮粗提取物中抑菌活性成分分离纯化及其抑菌机理尚需进一步研究探讨。
参考文献:
[1]陆敏佳,蒋玉蓉,陈国林,等.藜麦叶片黄酮类物质的提取及基因型差异[J].浙江农林大学学报,2014,31(4):534-540.
[2]杨发荣.藜麦新品种陇藜1号的选育及应用前景[J].甘肃农业科技,2015(12):1-5.
[3]黄 杰,刘文瑜,魏玉明,等.4个藜麦品种在陇东旱作区幼苗生长量及生理生化指标分析[J].甘肃农业科技,2017(10):35-38.
[4]孙雪婷,袁俊杰,蒋玉蓉,等.藜麦种子总黄酮提取及其抗氧化性[J]. 江苏农业科学,2015,43(10):355-358.
[5]王晨静,赵习武,陆国权,等.藜麦特性及开发利用研究进展[J]. 浙江农林大学学报,2014,31(2):296-301.
[6]游庭活,刘 凡,温 露,等.黄酮类化合物抑菌作用研究进展[J]. 中国中药杂志,2013,38(21):3645-3650.
[7]RAZZAGHI F,AHMADI S H,JACOBSEN S-E,et al.Effects of salinity and soil-drying on radiation use efficiency, water productivity and yield of quinoa(Chenopodium quinoa Willd.)[J].Journal of Agronomy and Crop Science,2012,198(3):173-184.
[8]RAZZAGHI F,JACOBSEN S-E,JENSEN,et al.Ionic and photosynthetic homeostasis in quinoa challenged by salinity and drought-mechanisms of tolerance[J].Functional Plant Biology,2015,42(2):136-148.
[9]YANG A Z,AKHTAR S S,IQBAL S,et al.Enhancing salt tolerance in quinoa by halotolerant bacterial inoculation [J].Functional Plant Biology,2016,43(7):632-642.
[10]NOWAK R,SZEWCZYK K,GAWLIK-DZIKI U,et al.Antioxidative and cytotoxic potential of some Chenopodium L.species growing in Poland [J].Saudi Journal of Biological Sciences,2016,23(1):15-23.
[11]刘立新,郑春辉,徐 成,等.大豆茎中黄酮类化合物的提取及抗氧化作用研究[J].黑龙江医药科学,2011,34(5):60-61.
[12]孙天宇.沙棘叶黄酮的提取分离及降血脂作用小鼠试验的研究[D].大庆:黑龙江八一农垦大学,2012.
[13]苏 驰,薛桥丽,胡永金,等.云南古树茶上寄生的“螃蟹脚”提取物的体外抑菌效应研究[J].安徽农业科学,2012,40(13):7919-7920.
[14]邱家章,邓旭明,罗永煌.甘草查尔酮E对金黄色葡萄球菌的抗菌活性[J].中国兽医学报,2012,32(8):1194-1198.
[15]杨 宏,伊淑莹,翟 静.紫草提取物抗肿瘤的作用机制[J]. 生命的化学,2013,33(2):49-53.
[16]张英华,关 雪.刺五加叶中黄酮类提取物的抗氧化性及抑菌作用研究[J].东北农业大学学报,2012,43(3): 85-90.
[17]刘 岚,李 荣.山银花药用成分的提取及抑菌活性研究[J]. 中南医学科学杂志,2012,40(3):298-300.
[18]刘 平,陈光晖,邓淑华,等.金莲花总黄酮抗菌作用的实验研究[J].国际药学研究杂志,2013,19(6):207-210.
[19]张金杰,吕文文,翁 远,等.超野菊花中黄酮类成分的抗菌活性及指纹图谱[J].国际药学研究杂志,2013,40(6):807-812.
[20]杨 静,常小强,王 霞,等.甘草活性成分提取及抑菌活性研究[J]. 河南科学,2017,35(10):1587-1591.
[21]戴 航,黄立兰,郭育晖.苦槛蓝叶中的黄酮类化合物[J]. 热带亚热带植物学报,2013,21(3):266-272.
[22]杨秀芳,王改利,马养民,等.水杨梅中化学成分活性的研究[J].陕西科技大学学报(自然科学版),2014(1):123-127.
[23]李晶晶,曾东强.牛耳枫果实中抑菌活性成分的初步分离[J]. 农药学学报,2013,15(3):261-266.

