白蛾周氏啮小蜂普通气味受体OR1的进化分析
张新玥 ,王凤竹 ,范伟健 ,潘丽娜 ,朱耿平 ,林艳平 ,王 静 ,李 敏
(1.天津师范大学生命科学学院,天津300387;2.天津师范大学天津市动植物抗性重点实验室,天津300387;3.漯河市豫中南林业有害生物天敌繁育研究中心,河南 漯河 462300)
周氏啮小蜂(Chouioia cunea Yang)为世界性检疫害虫美国白蛾(Hypanthia cunea Drury)蛹期重要的内寄生性天敌,以寄主蛹中的血淋巴、器官和营养物质为食,其卵期、幼虫期和蛹期均在寄主蛹体内度过,发育至老熟幼虫期时在寄主的蛹壳中化蛹,之后羽化出蜂[1].周氏啮小蜂的繁殖量大,寄生范围广,在林木害虫生物防治方面有广阔的应用前景[2-3].寄生蜂在自然界中找寻寄主时主要依靠嗅觉系统.嗅觉系统由气味剂结合蛋白(odorant binding proteins,OBPs)、感觉神经元膜蛋白(sensoryneuronmembraneprotein,SNMP)、气味受体(olfactoryreceptors,ORs)、气味降解酶(odordegrading enzymes,ODEs)等蛋白共同参与[4],其中,气味受体ORs为G蛋白耦联受体,分布在嗅觉感觉神经元树突的膜表面,气味分子或气味分子与气味结合蛋白OBPs的复合物通过激活对应的气味受体ORs传递嗅觉信号,使昆虫产生相应的反应[5].一般将ORs分为两类:一类为普通气味受体(conventional odorant receptor,ORs),在不同昆虫间保守性较低;另一类为非典型气味受体(olfactory receptor co-receptor,ORco),通常命名为OR83b受体,在不同昆虫间的同源性较高,可与普通ORs共表达形成异源二聚体,从而提高对外界气味分子的敏感度[6-7].
赵燕妮等[8]首次对C.cunea触角转录组进行测序并得到了80个CcORs,并且对CcOR83b进行了分子进化分析[9],在此基础上,王凤竹等[10]对CcOBPI进行了进化分析.本研究从周氏啮小蜂触角转录组中鉴定了一个普通气味受体OR1的cDNA全序列,对该基因进行了多角度的进化分析,为深入了解OR1的功能和进一步探究C.cunea的嗅觉机制提供理论参考.
1 材料与方法
1.1 材料
以中国辽宁鞍山柞蚕养殖基地的柞蚕(Antheraea pernyi)蛹为白蛾周氏啮小蜂的替代寄主,于PQX-350H人工气候箱(中仪国科(北京)科技有限公司)中进行传代培养.周氏啮小蜂饲养条件:温度为25℃,相对湿度为70%,光照周期为14 h∶10 h(白天∶夜晚).取当日羽化活力强健的雌性及雄性周氏啮小蜂触角,每200头小蜂触角贮存于一个1.5mL离心管中,搜集8管样品后立即浸于RNA later(AM7020,美国Ambion公司)中,-20℃下保存.由华大基因科技服务有限公司(http://www.genomics.cn/index)进行转录组测序.
1.2 基因序列分析
利用Illumina HiSeqTM2000平台对周氏啮小蜂触角样本进行转录组测序,使用Trinity软件对单个读取序列片段进行聚类后拼接成Unigene,结合生物信息学软件得到目标序列cDNA全长.应用BioEdit7.2.1分析序列的氨基酸残基数量及其相对分子质量,使用EXPASY平台中的Signal P 3.0 Serve程序(http://www.cbs.dtu.dk/services/SignalP/)软件预测氨基酸序列信号肽的位置 , 使 用 HMMTop(http://www.enzim.hu/hmmtop/html/submit.html)预测跨膜结构域.
在NCBI上对OR1进行BLASTs搜索,选择匹配分值(Maxscore)大于170且与目标序列相似度高的18条膜翅目同源序列,分别为短管赤眼蜂(Trichogramma pretiosum)OR2-like[XM_014379607]([XP_014235093]括号里为对应蛋白质序列号,下同)、丽蝇蛹集金小蜂(Nasonia vitripennis)OR236[NM_001190663]([NP_001 177592])、红火蚁(Solenopsis invicta putative)OR85d[XM_011167977]([XP_011166279])、小火蚁(Wasmannia auropunctata) OR49b-like[XM_011709094]([XP_01 1707396])、埃氏扁胸切叶蚁(Vollenhoviaemeryi)OR49blike[XM_012027062]([XP_011882452])、 红 收 获 蚁(Pogonomyrmex barbatus)OR49b-like[XM_011641626]([XP_011639928])、东方大黄蜂(Bombus impatiens)OR49b-like[XM_003486857]([XP_003486905])、弓 背蚁(Camponotus floridanus)OR9a-like[XM_011254156]([XP_011252458])、欧洲熊蜂(Bombusterrestris)OR13alike[XM_003401107]([XP_003401155])、多胚跳小蜂(Copidosoma floridanum)OR49b-like[XM_014350606]([XP_014206092])、中华蜜蜂(Apis cerana cerana)OR141[KT246483]([ALR87041])、切叶蚁(Acromyrmex echinatior) OR49b-like[XM_011050838]([XP_0110491 40])、子弹蚁(Dinoponera quadriceps)putative OR85d[XM_014626390]([XP_014481876])、 苜 蓿 切 叶 蜂(Megachile rotundata)putative OR92a[XM_003705930]([XP_003705978])、美洲大头阿塔切叶蚁(Atta cephalotes)OR49b-like[XM_012202902]([XP_012058292])、对叶榕传粉榕小蜂(CeratosolensolmsimarchaliOR2-like[XM_011503526]([XP_011501828])、意大利蜜蜂(Apis mellifera)OR13-like[XM_006563582]([XP_006563645])、排蜂(Apisdorsata)putativeOR56a-like[XM_006608094]([XP_006608157]).
应用BioEdit7.2.1进行序列比对,应用EMBOSS Pairwise Alignment Algorithm(http://www.ebi.ac.uk/emboss/align/)分析氨基酸序列的一致性和相似性.
1.3 系统发育树的构建
在GenBank上收集膜翅目18条同源序列数据的蛋白序列以及外群黑腹果蝇(Drosophila melanogaster)OR47a[AEB91932]、CcOR1共20 条序列,BioEdit7.2.1比对后使用 MEGA 6.0 邻接法(neighbor-joining,NJ)[11]和最大似然法(maximum likelihood methods,ML)[12]构建氨基酸进化树,节点支持率通过自举检验法(bootstrap methods)进行评估,重复次数1000,其他设为默认参数.
1.4 选择压力分析
使用 Single Likelihood Ancestor Counting(SLAC)软件包(http://www.datamonkey.org/)对 OR1 基因进行选择压力检测.将来自GenBank上膜翅目的18条同源序列与OR1序列一并在线提交,利用邻接法(neighbor joining tree)构建祖先序列,计算非同义替代与同义替代的比值Ka/Ks(即dN/dS).利用双尾法检验得出P值(P<0.05为样本相关性具有统计学意义,P<0.01为相关性具有高度统计学意义).
1.5 替代速率
使用MEGA6.0 Nei-Gojobori(Proportion)方法[13]计算所得核苷酸序列的非同义替代速率(Ka)和同义替代速率(Ks)[14].将周氏啮小蜂与18种膜翅目昆虫进行同源序列比对,所有比对gap成对删除.
1.6 密码子使用偏好性
通过内嵌于DnaSP version 4.0[15]的Effective Number of Codons(ENC)[16]、Codon Bias Index(CBI)[17]和Scaled Chi-square(Scaled χ2)[18]3 种方法分析 OR1 及其同源基因的密码子偏好性.
2 结果与分析
2.1 基因序列分析
经触角转录组测序及序列聚类拼接后,成功得到含完整开放阅读框的OR1基因的cDNA(GenBank登录号:KX264502),其长度为 1 257 bp,编码 418 个氨基酸,相对分子质量为47 985.42.软件预测发现该蛋白无信号肽,具有7个跨膜结构域,分别位于第33~57、72 ~91、130 ~147、182 ~206、295 ~314、345 ~363 和395~414位氨基酸残基上.
周氏啮小蜂OR1氨基酸序列与其他18种膜翅目昆虫之间的一致性范围是26.1%~75.7%,与短管赤眼蜂和丽蝇蛹集金小蜂的一致性较高,数值约为75%,与其他昆虫的一致性为30%左右;与18种膜翅目昆虫氨基酸之间的相似性范围为46.1%~86.2%,仍与短管赤眼蜂和丽蝇蛹集金小蜂的相似性数值最高,约为85%,与其他昆虫的相似性约为50%.
2.2 系统发育树的构建
利用氨基酸构建的系统发育树如图1所示.由图1可以看出,周氏啮小蜂OR1与短管赤眼蜂Trichogramma pretiosum Or2-like首先聚为一支,即周氏啮小蜂与短管赤眼蜂的亲缘关系最近,与多胚跳小蜂、丽蝇蛹集金小蜂等寄生蜂的亲缘关系较为接近.

图1 根据氨基酸序列构建的系统发育树Fig.1 Phylogenetic tree of amino acid sequences
2.3 选择压力分析
分析周氏啮小蜂与其他18种膜翅目昆虫的OR基因编码区受到的选择压力,得到平均Ka/Ks(即dN/dS)值为0.658 943,即整个编码区主要接受负选择.在0.1的显著性水平上检测到5个正选择位点和33个负选择位点;在0.2的显著水平上检测到26个正选择位点和72个负选择位点.
2.4 替代速率
分析19条序列的非同义与同义替代速率,共得到核苷酸位点1 506个,其中有1 261个核苷酸位点存在变异,简约信息位点(parsimony information sites)共1 036个,单突变位点(single ton sites)共 167个.将寄主广泛的周氏啮小蜂及寄主专一小蜂分别与非寄生性的膜翅目昆虫相比较,分析替代速率,结果如表1所示.
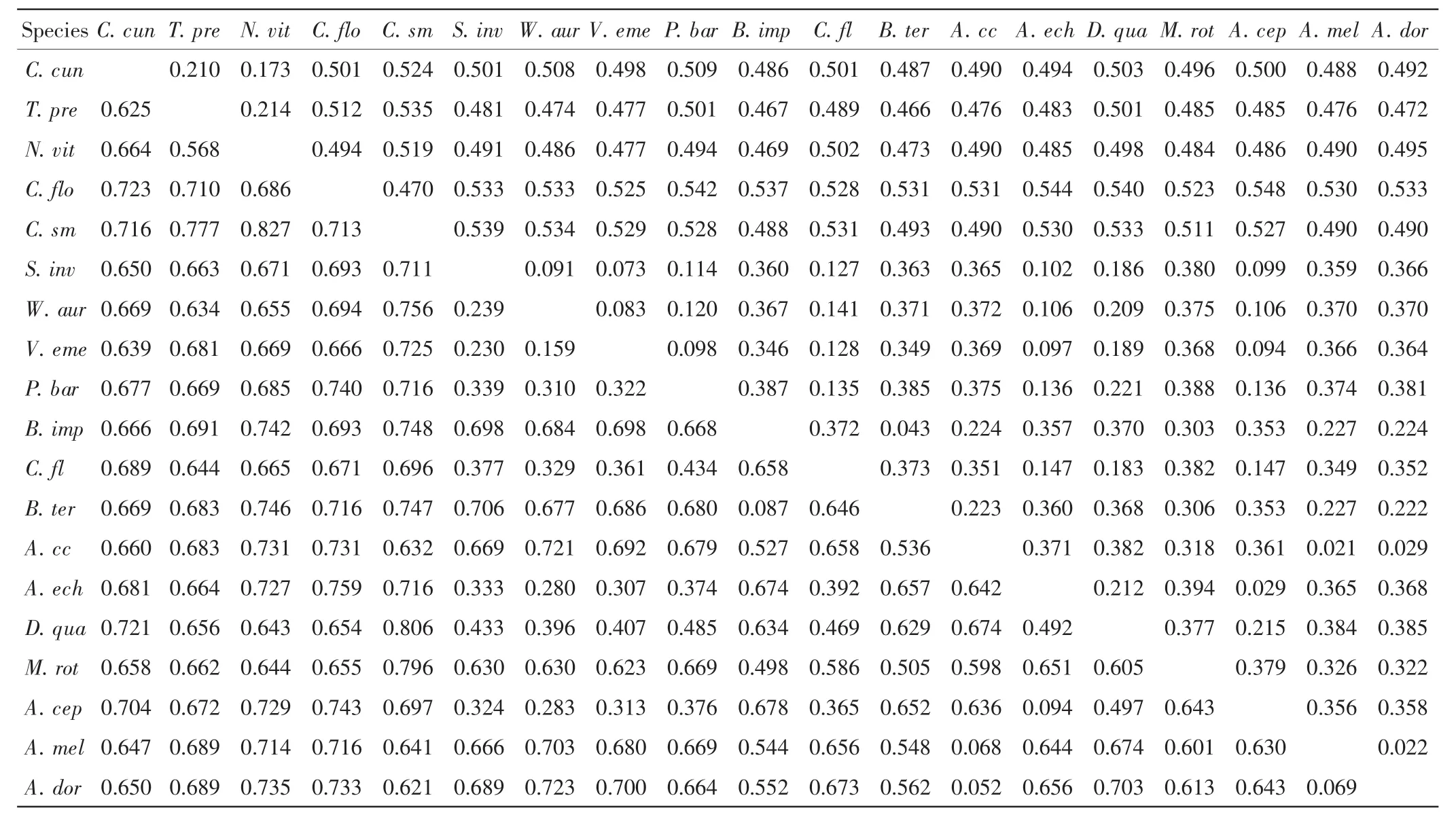
表1 OR1同源基因的同义及非同义替代速率Tab.1 Synonymous and non-synonymous divergence of OR1 genes
由表1可以看出,寄主广泛的周氏啮小蜂、短管赤眼蜂、丽蝇蛹集金小蜂和多胚跳小蜂与膜翅目非寄生性昆虫之间的同义分异差异范围为0.634~0.759,非同义分异差异范围为0.466~0.548.寄主专一的对叶榕传粉榕小蜂与膜翅目非寄生性昆虫之间的同义分异差异范围为0.621~0.806,非同义分异差异范围为0.488~0.539.
2.5 密码子使用偏好性分析
分析19条序列的密码子偏好性,结果如表2所示.由表2可以看出,寄主广泛的周氏啮小蜂、短管赤眼蜂、丽蝇蛹集金小蜂和多胚跳小蜂密码子偏好性指数(CBI)均小于30%,寄主专一的对叶榕传粉榕小蜂的密码子偏好性相对较大.周氏啮小蜂密码子第2位的G+C含量(G+C2)在5种寄生性小蜂中差异较小,第3位的G+C含量(G+C3)在寄主广泛的4种小蜂中较高,而对于寄主专一的小蜂来说含量较小,因此造成了G+C总含量不等.

表2 OR1同源基因的密码子偏好性Tab.2 Estimates of codon bias in OR1 genes
3 讨论
分析气味受体的进化趋势可以更好地了解气味结合蛋白的功能.本研究从周氏啮小蜂触角的转录组中得到了一个普通气味受体OR1的cDNA全序列,使用HMMTop软件预测其氨基酸序列,结果显示周氏啮小蜂OR1具有7个跨膜结构域,符合昆虫气味受体具有7个跨膜结构域的典型特点[19].昆虫气味蛋白家族庞大且高度分化.例如果蝇的各个嗅觉受体基因的同源性为17%~26%,极少数昆虫才可达到40%~60%[20-21].将周氏啮小蜂的OR1氨基酸序列与18种膜翅目昆虫进行比对,发现其一致性和相似性的范围较大,在不同昆虫之间有高度分异.其中,周氏啮小蜂OR1与丽蝇蛹集金小蜂OR236的一致性和相似性最高,分别为75.7%和86.2%;其次是与短管赤眼蜂OR2-like的一致性及相似性较高,分别为74.3%和82.9%,这与构建的系统发育树结果大致相符.氨基酸建树时,周氏啮小蜂先与短管赤眼蜂OR2-like聚合,之后与丽蝇蛹集金小蜂OR236聚成一支,节点支持率较高,证明其亲缘关系较近.
周氏啮小蜂与18种膜翅目昆虫的OR基因的平均Ka/Ks值为0.658 943,整个编码区主要受负选择压力的影响,即进化速率缓慢,具有功能分化的潜力[22].但在显著性为0.1及以上时,与非典型气味受体基因OR83b相比[9],周氏啮小蜂OR1基因的正选择位点较多,可能意味着在物种形成过程中该基因受到了某些选择压力的影响.位点的特异性分析为基因进化提供了某些证据,受正向选择作用的位点可能在气味分子传递与结合方面起到了重要作用[23],这也可解释传统ORs与非典型的OR83b基因之间生物学功能上的差异或许是由某些特异性选择位点决定的.
为了维持基因功能的保守性,在负选择压力作用下,大部分基因的非同义替代速率会远远低于同义替代速率[24],这与所得替代速率结果相符.从同义突变率的结果中可以看出,相对于寄主单一的榕小蜂,周氏啮小蜂与其他寄主广泛小蜂的同义突变率相对较低,说明作用于该物种的基因受自然选择影响较大.所有昆虫物种的非同义突变率很相似,证明负选择压力对该基因作用的强弱程度一致.密码子的使用差异性一般可以反映出自然选择的强度,基于对19种昆虫密码子偏好性的分析,结果发现寄主广泛的周氏啮小蜂显示出了较低的密码子偏好性,由于承受的进化约束力不同,寄主单一的寄生蜂密码子偏好性高可能是由于选择压力造成的,且专一寄生蜂和寄主广泛寄生蜂在反映中性同义突变程度的密码子第3位上的G+C含量方面相差较大,往往也暗示了选择压力的强弱有差别[24].
参考文献:
[1]杨忠岐.中国寄生于美国白蛾的啮小蜂一新属一新种(膜翅目,姬小蜂科,啮小蜂亚科)[J].昆虫分类学报,1989,6(1/2):117-123.YANG Z Q.A new genus and species of Eulophidae(Hymenoptera:Chalcidoidea)parasitizing Hyphantria cunea (Drury)(Lepidoptera:Arctiidae)in China[J].Entomotaxonomia,1989,6(1/2):117-123(in Chinese).
[2]苏智,杨忠岐,魏建荣,等.白蛾周氏啮小蜂转主寄主的研究[J].林业科学,2004,40(4):106-116.SU Z,YANG Z Q,WEI J R,et al.Studies on alternate hosts of the parasiotidChouioiacunea(Hymenoptera:Eulophidae)[J].ScientiaSilvae Sinicae,2004,40(4):106-116(in Chinese).
[3]邹立亚,顾宇书,陈军,等.白蛾周氏啮小蜂对几种昆虫蛹的寄生率以及林间释放效果[J].辽宁林业科技,2006(5):32-33.ZOU L Y,GU Y S,CHEN J,et al.The parasitic rate of Chouioia cunea Yang on several insect pupae and the effect of forest release[J].Journal of Liaoning Forestry Science&Technology,2006(5):32-33(in Chinese).
[4]SATOK,TOUHARAK.Insectolfaction:Receptor,signaltransduction,andbehavior[J].ResultsandProblemsinCellDifferentiation,2009,47:121-138.
[5]HALLEM E A,CARLSON J R.Coding of odors by a receptor repertoire[J].Cell,2006,125(1):143-160.
[6]SMITH D P.Odor and pheromone detection in Drosophila melanogaster[J].PflügersArchivEuropeanJournalofPhysiology,2007,454(5):749-758.
[7]LEAL W S.Odorant reception in insects:Roles of receptors,binding proteins,and degrading enzymes[J].Annual Review of Entomology,2013,58:373-391.
[8]ZHAO Y,WANG F,ZHANG X,et al.Transcriptome and expression patterns of chemosensory genes in antennae of the parasitoid wasp Chouioia cunea[J].Plos One,2016,11(2):doi:1.1371/journal pone.0142159.
[9]王凤竹,张新玥,范伟健,等.周氏啮小蜂气味结合蛋白Ⅰ基因的进化分析[J].天津师范大学学报(自然科学版),2017,37(1):46-50.WANG F Z,ZHANG X Y,FAN W J,et al.Phylogenetic analysis on the odorant binding proteinⅠgene of Chouioia cunea Yang[J].Journal of Tianjin Normal University(Natural Science Edition),2017,37(1):46-50(in Chinese).
[10]赵燕妮,刘强,李敏.周氏啮小蜂非典型气味受体基因的cDNA序列及进化分析[J].应用昆虫学报,2014,51(4):1026-1034.ZHAO Y N,LIU Q,LI M.Identification and evolution of the Or83b olfactory gene of Chouioia cunea Yang[J].Chinese Journal of Applied Entomology,2014,51(4):1026-1034(in Chinese).
[11]TAKEZAKI N.Tie trees generated by distance methods of phylogenetic reconstruction[J].Molecular Biology and Evolution,1998,15(6):727-737.
[12]MYUNG I J.Tutorial on maximum likelihood estimation[J].Journal of Mathematical Psychology,2003,47(1):90-100.
[13]ZHANG J Z,ROSENBERG H F,NEI M.Positive Darwinian selection after gene duplication in primate ribonuclease genes[J].PNAS,1998,95(7):3708-3713.
[14]NEI M,GOJOBORI T.Simple methods for estimating the numbers of synonymous and nonsynonymous nucleotide substitutions[J].Molecular Biology&Evolution,1986,3(5):418-26.
[15]ROBERTSON H M,WARR C G,CARLSON J R.Molecular evolution of the insect chemoreceptor gene superfamily in Drosophila melanogaster[J].Proceedings of the National Academy of Sciences,2003,100(Suppl2):14537-14542.
[16]WRIGHT F.The‘effective number of codons’used in a gene[J].Gene,1990,87(1):23-29.
[17]MORTON B R.Chloroplast DNA codon use:Evidence for selection at the psb a locus based on tRNA availability[J].Journal of Molecular Evolution,1993,37(3):273-280.
[18]SHIELDS D C,SHARP P M,HIGGINS D G,et al.“Silent”sites in Drosophila genes are not neutral:Evidence of selection among synonymouscodons[J].MolecularBiology&Evolution,1988,5(6):704-716.
[19]BENTON R,SACHSE S,MICHNICK S W,et al.Atypical membrane topology and heteromeric function of Drosophila odorant receptors in vivo[J].Plos Biology,2012,4(2):240-257.
[20]CLYNE P J,WARR C G,FREEMAN M R,et al.A novel family of divergent seven-transmembrane proteins:Candidate odorant receptors in Drosophila[J].Neuron,1999,22(2):327-338.
[21]VOSSHALL L B,STOCKER R F.Molecular architecture of smell and taste in Drosophila[J].Annual Review of Neuroscience,2007,30:505-533.
[22]曹德盼.生物信息学方法在昆虫嗅觉基因识别的应用研究[D].武汉:华中农业大学,2015.CAO D P.Identification of Insect Olfactory Related Genes Using Bioinformatics[D].Wuhan:HuazhongAgriculturalUniversity,2015(in Chinese).
[23]陈明,彭作刚,何舜平.青鳉与三刺鱼嗅觉受体(OR)基因的鉴定与进化分析[J].中国科学,2009,39(11):1057-1068.CHEN M,PENG Z G,HE S P.Identification and evolution analysis of Oryzias latipes and Gasterosteus aculeatus olfactory receptor(OR)gene[J].Science in ChinaPress,2009,39(11):1057-1068(inChinese).
[24]张文娟.基于密码子水平的生物信息学分析及进化研究[D].上海:复旦大学,2006.ZHANG W J.Codon Analysis and Its Applieation in Bioinformaties and EvolutionaryStudies[D].Shanghai:FudanUniversity,2016(inChinese).

