KIBRA基因多态性影响脑功能连接的fMRI研究
张宁男楠,张璋
肾脑表达蛋白(kidney and brain expressed protein,KIBRA)基因rs17070145单核苷酸多态性与人类记忆及阿尔茨海默病(Alzheimer’s disease,AD)有关。欧美高加索健康人群的相关研究显示,KIBRA基因多态性存在多种行为学测评及脑功能区差异,但研究存在不一致性[1-8]。因此本研究将基于功能连接密度(functional connective density,FCD)方法,分析天津地区汉族健康青年人群KIBRA基因多态性对记忆测评及脑功能连接的影响,并探讨其病理生理机制。
1 对象与方法
1.1 研究对象 于2015年3—8月连续收集在天津医科大学总医院查体的天津地区健康青年人。入组标准:年龄18~35岁,汉族,性别不限,右利手,无神经及精神系统疾患,无脑创伤、药物和乙醇依赖史或其他可能影响脑结构与功能的疾病。最终纳入研究的267例受试者均具有完整的行为学、遗传学资料和磁共振影像学数据,其中男118例,女149例,年龄18~29岁,中位年龄23(21,24)岁。本研究以书面形式告知受试者研究内容并征得同意,研究内容经天津医科大学总医院伦理委员会批准。
1.2 行为学测评资料 (1)中国修订版的韦氏记忆量表,包括①长时记忆:1~100、100~1、积累;②短时记忆:图片、再认、再生、联想、触觉、理解;③瞬时记忆:背数;④记忆商数。(2)威斯康星卡片分类试验中的持续性错误百分比。以上量表全面评估受试者的记忆及执行功能。
1.3 遗传学资料 KIBRA rs17070145基因型检测:从3 000 μL全血中利用EZgeneTM血液gDNA小量提取试剂盒纯化提取DNA,应用聚合酶链反应(polymerase chain reaction,PCR)和连接酶检测反应(ligation detection reaction,LDR)检测C/T等位基因(委托上海翼和应用生物技术有限公司完成)。
1.4 磁共振影像学数据 采用GE 3.0T Signa HDx磁共振扫描仪及8通道头线圈,对所有受试者进行全脑3D高分辨率T1结构像和静息态功能磁共振(functional magnetic resonance imaging,fMRI)扫描。全脑3D高分辨率T1WI结构像采用颅脑容积成像序列进行矢状位扫描。扫描参数:重复时间/回波时间/反转时间8.1/3.1/450.0 ms,视野256 mm×256 mm,矩阵256×256,翻转角度(FA)13°,层厚1.0 mm,无间隔,层数176。静息态fMRI采用梯度回波单次激发回波平面成像(echo planar imaging,EPI)技术。扫描参数:重复时间/回波时间2 000/30 ms,视野240 mm×240 mm,矩阵64×64,FA 90°,层厚4.0 mm,无间隔,层数40,采集180个时相。
1.5 数据处理
1.5.1 静息态fMRI数据预处理 采用基于Matlab的SPM8进行数据预处理。去除前10个时间点的数据。对剩余170个时间点数据进行层面时间校正和时间点之间的头动校正(去除三维平移超过2 mm、三维旋转超过2°的受试者数据)。此外,计算不同时相之间头动位置的改变,即帧位移量(framewise displacement,FD),以反映某帧图像相对于前一个时间点的平均位移量。随后对每个受试者的结构像和功能像线性配准。采用3 mm再采样进行归一化,并将个体头像配准到MNI(montreal neurological institute)标准空间。通过线性回归,去除头动、脑白质及脑脊液的平均信号。在0.01~0.08 Hz频率范围内,通过带通滤波去掉数据的线性漂移和高频背景噪声等非生理信号。
1.5.2 全脑FCD计算 经过时间校正、头动校正及空间标准化后的数据用于计算FCD。基于Zhang等[9]研究,通过Linux平台的内部脚本计算FCD值,即某一体素与全脑其余灰质体素间存在功能连接的个数。基本原理是当两个体素的时间序列Pearson相关系数大于0.6时,认为两个体素间存在功能连接。在全脑灰质模板内得到每个体素FCD值后,除以全脑的平均FCD值,得到每个受试者标准化的全脑FCD(global FCD,gFCD),并利用全宽半高(full-width at half-maximum,FWHM)为8 mm的高斯核进行空间平滑,进一步提高数据的正态分布性。
1.6 统计学方法 采用SPSS 23.0统计软件包分析数据。采用Kolmogorov-Smirnov检验对所有连续变量数据进行正态性检验,所有数据均符合正态分布。连续变量数据组间差异比较采用独立样本t检验。分类变量组间比较采用χ2检验。将性别、年龄、受教育年限作为协变量,采用独立样本t检验比较C基因携带者和TT纯合子携带者之间的差异,得到组间差异的gFCD脑区。该结果需要进行蒙特卡洛模拟(Monte Carlo simulation)校正,校正的方法及参数为:每个体素阈值设定在P<0.001,团块大小为≥64个体素时认为差异有统计学意义(相当于校正后阈值达到P<0.05的效果),校正后的gFCD脑区作为最终结果。P<0.05为差异有统计学意义。
2 结果
2.1 人口学、基因及行为学数据 通过KIBRA基因分型检测,267例受试者中,TT、TC、CC基因型携带者分别为155例(58.05%)、99例(37.08%)、13例(0.05%),T、C等位基因频率为76.05%和23.41%;112例为C基因携带者,即TC+CC,基因型分布频率符合Hardy-Weinberg平衡(χ2=0.310,P>0.05)。
TC+CC基因型组和TT型组间年龄、性别和受教育年限差异无统计学意义(均P>0.05)。韦氏记忆量表中,TC+CC基因型组代表长时记忆测试的积累分测验得分高于TT基因型组(P=0.05),不同基因型组间其余各项测验评分及记忆商数差异无统计学意义(P>0.05)。威斯康星卡片分类试验中,不同基因型组间代表执行功能的持续性错误百分比差异无统计学意义(P>0.05),见表1。
2.2 基因型组间的全脑FCD分析 KIBRA C基因携带者(TC+CC)与TT纯合子携带者间gFCD存在差异的脑区为右侧枕中回(图1A,峰值点MNI坐标x=27,y=-75,z=36,团块大小64个体素,峰值点T值=4.139;校正后P<0.05)。相对于TT纯合子携带者,C基因携带者的FCD值增高(图1B)。
3 讨论
本研究对AD候选基因KIBRA在天津地区健康汉族人群中脑功能连接密度的影响进行了探索性研究。结果表明,KIBRA不同基因型间存在记忆评分和脑功能的差异,TT纯合子携带者的长时记忆好于C基因携带者;两个基因型的差异脑区为枕中回,C基因携带者的脑功能激活程度高于TT纯合子携带者。

Tab.1 Comparison of demographic and behavior data between genotypic subgroups表1 不同基因型受试者人口学及行为学数据的比较
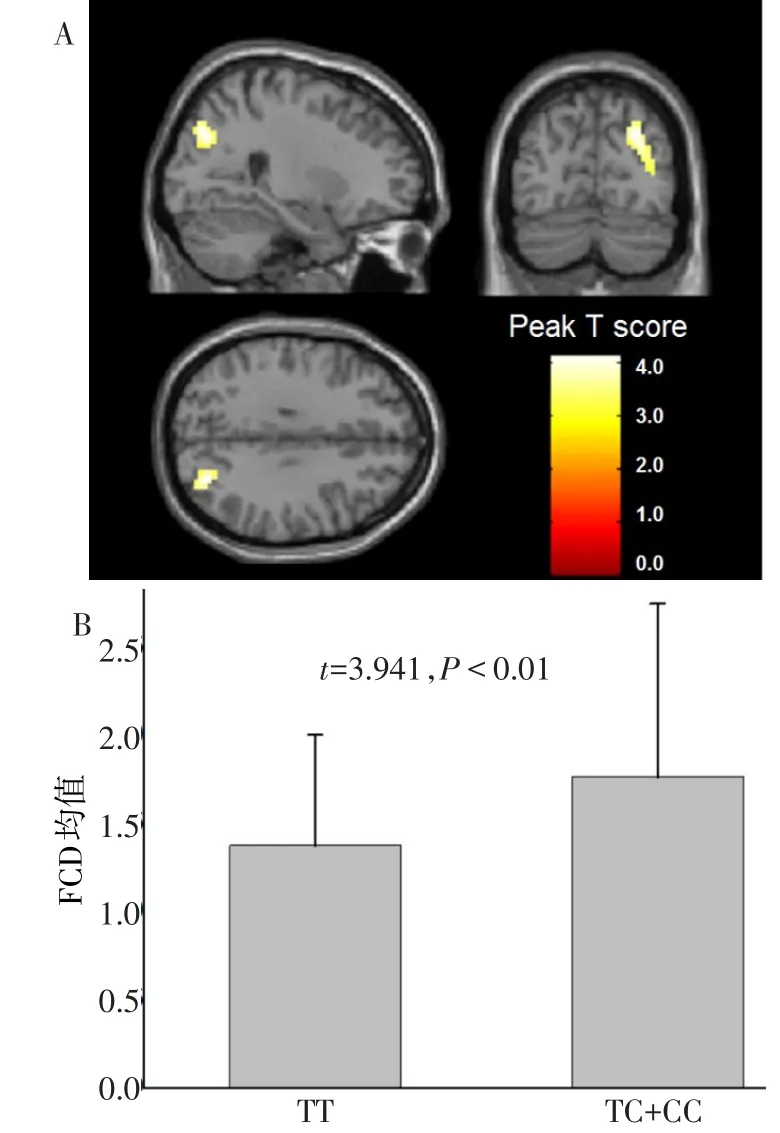
Fig.1 Significant FCD difference found in right occipital gyrus in KIBRA genotypic subgroups图1 右侧枕中回的FCD存在KIBRA不同基因型间表达差异
3.1 影像遗传学与AD 近年来,快速发展的影像遗传学将功能影像学和遗传学方法相结合,将脑功能作为中间表型,相比于单纯行为学评价的表型更能直接反映基因功能,为研究基因多态性对大脑功能及行为的潜在作用提供了独特的视角。FCD是一种不依赖脑图谱模板来构建脑网络的功能影像学方法,计算每个体素与全脑体素存在功能连接的数目,从全局角度发现功能连接数目最多的节点。该方法不依赖脑图谱模板来构建脑网络,可以更全面、客观地反映全脑信息,适合对机制不明的中枢神经系统退行性疾病进行探索性研究(如AD)。遗传因素在AD的发生中起重要作用,且具有不随时间病程变化而改变的特点,影像遗传学可作为早期识别AD的一种研究手段。已有研究显示,AD候选基因KIBRA在AD的重要脑区海马和颞叶高表达,KIBRA基因多态性与AD危险存在正相关。
3.2KIBRA基因多态性对行为学、脑功能的影响 本研究发现,KIBRATT纯合子携带者的长时记忆好于C基因携带者,这里所说的长时记忆仍属于短期记忆的范畴,应区别于AD患者长期记忆保留特点中的长期记忆概念,TT纯合子和C基因携带者这两个基因型间行为学的差异可能与KIBRA基因单核苷酸多态性有关。KIBRA基因单核苷酸多态性表现在等位基因T→C碱基转换。正常表达情况下,KIBRA基因编码的蛋白位于染色体5q35.1上,包含1 113个氨基酸,其中第953~996氨基酸区是与蛋白激酶Cζ(PKCζ)的结合区,PKCζ水解形成的异构体蛋白激酶M是维持后期长时程增强作用(LTP)的必要条件[10-11]。LTP是突触可塑性的表现形式,而人类记忆的重要神经基础为突触可塑性。因此,KIBRA对维持持久性记忆,而且很可能对维持长期记忆都是重要的。当发生T→C碱基转换后,影响上述过程的正常进行,推测可能是C基因携带者的长期记忆存在潜在损伤的原因。无论是亚洲人群还是欧美人群[1-5],KIBRAT基因携带者在言语记忆、情景记忆、瞬时记忆及短时延迟记忆的表现优于CC携带者,提示C基因型可能影响记忆功能。
另外,本研究发现,静息状态下长时记忆较差的C基因携带者的FCD值高于TT纯合子携带者。对于KIBRA基因多态性影响脑功能的研究有多种发现。一项针对欧美高加索健康青年人的任务态影像遗传研究发现,选择记忆评分一致的CC基因型和T等位基因携带者两组中,CC携带者出现激活脑区,推测可能的原因是为了维持同等水平的行为学功能,出现脑功能的代偿激活[1]。而对欧美高加索老年人的任务态研究认为,T基因携带者记忆评分较好,同时发现脑区激活增加,是由于该脑区功能强的原因[3]。对亚洲青年人群的研究则发现,C基因携带者默认网络中的多个脑区同步一致性增加,但同时网络内的部分脑区灰质体积减小,可能存在脑结构-功能代偿[5]。存在以上结果差异的原因可能有两点:第一,KIBRA不同基因型的脑功能表现受年龄影响,目前文献报道较少,需要更多的研究验证;第二,不同种族人群KIBRA基因型分布不同,例如T等位基因在欧洲高加索人的频率约为25%,在非裔美国人群约为50%[1],而在亚洲人群中却占到近75%,这也是本研究中将TT纯合子作为一组、C等位基因携带者作为另一组的依据。
3.3 枕叶与AD相关基因关系 本研究中,KIBRA基因单核苷酸多态性影响脑功能改变的脑区是枕中回。AD尸检神经病理结果显示,淀粉样蛋白被认为是AD标志物,枕叶皮质是该淀粉样蛋白早期出现的脑区之一[12]。影像学上有相关的研究证实,AD患者枕叶具有结构、静息态和任务态功能及功能网络的损伤。例如,AD患者的枕叶灰质体积减少,且与大脑静息状态默认网络的功能连接减低有关[13]。另一项早期AD患者的脑网络与任务表现有效性关系的研究显示,表现有效性高的AD患者在颞枕叶脑区出现了增强的脑功能连接度,而这种增强的表现被认为是一种对神经退变的代偿机制[14]。另外,枕叶的静息状态出现α节律被认为是轻度认知功能障碍(mild cognitive impairment,MCI)的重要脑电图(electroencephalographic,EEG)标志,早期AD的认知功能和灰质密度与枕叶的α节律的幅度呈正相关[15]。正电子发射计算机断层显像(PET-CT)研究发现,为了维持较好的定向能力,AD患者的枕中回代谢增加[16]。更进一步研究显示,在AD的早期阶段MCI患者中,携带载脂蛋白E(ApoE)ε4基因的MCI-AD转归者具有更显著的枕叶萎缩,而非ApoEε4基因的MCI-AD转归者仅有额顶叶体积的减少[17]。以上研究提示,在AD的早期及晚期阶段均有枕叶的受累,表现为体积的减少及功能的减退。ApoEε4基因能增加晚发型AD的风险或年龄相关的认知功能减退,该基因被认为是AD的风险基因。一项研究纳入了26~45岁的正常中青年人群,通过比较携带ApoEε4基因与非携带者的脑灰质体积发现,携带ApoEε4基因人群的枕叶皮质灰质体积相对增加[18]。且本研究发现KIBRAC基因携带者的FCD增高。这些研究反映了在AD发生之前,长期存在的基因差异可持续性地影响脑结构和功能,这些结构和功能的改变可能会最终导致AD候选基因携带者在步入老年时易患AD。
3.4 局限性及展望 本研究存在一定的局限性。首先,虽然入组人数已达到近300例,但是对于影像遗传研究来说,单个等位基因的样本量仍显不足;最终入组的受试者主要是天津地区的汉族大学生人群,在不同地区、种族间有无差异需进一步扩大样本量并验证当前研究的结果。其次,KIBRA基因为AD候选基因,因此下一步的研究对象将扩展为老年人及AD患者。最后,本研究结果显示KIBRA不同基因型间只有右侧枕中回的FCD存在差异,其原因未明,我们会进一步扩大样本量并验证左、右两侧枕中回FCD的差异。
综上,本研究探讨了天津地区健康汉族青年人群KIBRA基因多态性对认知及脑功能的影响,有助于发现AD遗传风险因素造成记忆功能损害的神经机制,为建立早期识别AD风险人群的遗传及影像学指标奠定基础。
[1]Papassotiropoulos A,Stephan DA,Huentelman MJ,et al.Common Kibra alleles are associated with human memory performance[J].Science,2006,314(5798):475-478.doi:10.1126/science.1129837.
[2]Yasuda Y,Hashimoto R,Ohi K,et al.Association study of KIBRA gene with memory performance in a Japanese population[J].World J Biol Psychiatry,2010,11(7):852-857.doi:10.3109/15622971003797258.
[3]Kauppi K,Nilsson LG,Adolfsson R,et al.KIBRA polymorphism is related to enhanced memory and elevated hippocampal processing[J].J Neurosci,2011,31(40):14218-14222.doi:10.1523/JNEUROSCI.3292-11.2011.
[4]Witte AV,Köbe T,Kerti L,et al.Impact of KIBRA polymorphism on memory function and the hippocampus in older adults[J].Neuropsychopharmacology,2016,41(3):781-790.doi:10.1038/npp.2015.203.
[5]Wangd,Liu B,Qin W,et al.KIBRA gene variants are associated with synchronization within the default-mode and executive control networks[J].Neuroimage,2013,69:213-222.doi:10.1016/j.neuroimage.2012.12.022.
[6]Werschingh,Guske K,Hasenkamp S,et al.Impact of common KIBRA allele on human cognitive functions [J].Neuropsychopharmacology,2011,36(6):1296-1304.doi:10.1038/npp.2011.16.
[7]Burgess JD,Pedraza O,Graff-Radford NR,et al.Association of common KIBRA variants with episodic memory and AD risk[J].Neurobiol Aging,2011,32(3):557.e1-9.doi:10.1016/j.neurobiolaging.2010.11.004.
[8]Sédille-Mostafaie N,Sebesta C,Huber KR,et al.The role of memory-related gene polymorphisms,KIBRA and CLSTN2,on replicate memory assessment in the elderly[J].J Neural Transm(Vienna),2012,119(1):77-80.doi:10.1007/s00702-011-0667-9.
[9]Zhang N,Liuh,Qin W,et al.APOE and KIBRA interactions on brain functional connectivity in healthy young adults[J].Cereb Cortex,2017,27(10):4797-4805.doi:10.1093/cercor/bhw276.
[10]Tracy TE,Sohn PD,Minami SS,et al.Acetylated tau obstructs KIBRA-mediated signaling in synaptic plasticity and promotes tauopathy-related memory loss[J].Neuron,2016,90(2):245-260.doi:10.1016/j.neuron.2016.03.005.
[11]吴静,杨睿,刘树业.蛋白激酶C抑制剂的研究新进展[J].天津医药,2016,44(1):114-117.Wu J,Yang R,Liu SY,et al.New progress in the study of protein kinase C(PKC)inhibitors[J].Tianjin Med J,2016,44(1):114-117.doi:10.11958/20150079.
[12]Braakh,Braak E.Neuropathological stageing of Alzheimerrelated changes[J].Acta Neuropathol,1991,82(4):239-259.
[13]Hafkemeijer A,Möller C,Dopper EG,et al.Resting state functional connectivity differences between behavioral variant frontotemporal dementia and Alzheimer’s disease[J].Front Hum Neurosci,2015,9:474.doi:10.3389/fnhum.2015.00474.
[14]De Marco M,Duzzid,Meneghello F,et al.Cognitive efficiency in Alzheimer’sdisease isassociated with increased occipital connectivity[J].J Alzheimers Dis,2017,57(2):541-556.doi:10.3233/JAD-161164.
[15]Babiloni C,Del Percio C,Boccardi M,et al.Occipital sources of resting-state alpha rhythms are related to local gray matter density in subjects with amnesic mild cognitive impairment and Alzheimer’s disease[J].Neurobiol Aging,2015,36(2):556-570.doi:10.1016/j.neurobiolaging.2014.09.011.
[16]Weissberger GH,Melrose RJ,Fanale CM,et al.Cortical metabolic and cognitive correlates of disorientation in Alzheimer’s disease[J].J Alzheimers Dis,2017,60(2):707-719.doi:10.3233/JAD-170420.
[17]Morgen K,Frölich L,Tosth,et al.APOE-dependent phenotypes in subjects with mild cognitive impairment converting to Alzheimer’s disease[J].J Alzheimers Dis,2013,37(2):389-401.doi:10.3233/JAD-130326.
[18]Alexander GE,Bergfield KL,Chen K,et al.Gray matter network associated with risk for Alzheimer’s disease in young to middleaged adults[J].Neurobiol Aging,2012,33(12):2723-2732.doi:10.1016/j.neurobiolaging.2012.01.014.

