内质网应激对小鼠卵巢卵泡发育的影响
黄宁,于洋
内质网是真核细胞内的重要细胞器之一,与细胞内分泌蛋白及膜蛋白的合成折叠、脂质代谢、甾体激素合成密切相关,同时作为钙离子贮存库,发挥细胞内钙离子稳态维持的重要作用[1-3]。一些生理或病理情况,如低氧[4]、能量不足[5]、钙离子浓度异常[6]以及游离脂肪酸含量过多[7]均会干扰内质网功能,导致大量未折叠或错误折叠的蛋白质积聚在内质网,诱发内质网应激。为了减轻内质网应激对细胞的损伤,细胞激活未折叠蛋白质应答(UPR)可维持内质网稳态,促进细胞存活。UPR通过激活三条经典通路——PERK通路、IRE1α通路、ATF6通路,将内质网内蛋白质折叠异常的信号传递至细胞核、细胞质乃至整个细胞,通过减少内质网蛋白质流入负担,增强蛋白质折叠能力,诱导错误折叠蛋白质的降解,从而促使内质网恢复稳态[8]。
目前,已有文献报道内质网应激与卵巢生理功能及疾病发病密切相关,但是其具体的分子途径尚不清楚。卵泡的生长主要表现为卵母细胞体积的增长及颗粒细胞的增殖。颗粒细胞的快速增殖需要大量蛋白质的支持,同时可能会造成局部的缺氧环境,从而诱导内质网功能异常,导致大量未折叠或错误折叠的蛋白质积聚在内质网,激活内质网应激和UPR[9-10]。本研究旨在探索内质网应激在体内环境中对卵巢生理功能的调节作用,利用经典内质网应激诱导物衣霉素经腹腔注射建立小鼠卵巢内质网应激模型,通过与对照组比较UPR标志分子的表达差异,明确小鼠卵巢内质网应激激活状态。
1 材料与方法
1.1 动物模型的建立 实验动物为10只C57品系雌性小鼠。所有小鼠均购自北京维通利华实验动物中心,均为SPF级。实验中所使用动物的操作流程均经我院伦理委员会审核批准。所有小鼠饲养于北京大学医学部实验动物中心,饲养温度(23±2)℃,相对湿度为(55±10)%,SPF环境,光照时间为12h光照/12h黑暗,自由摄食饮水。动物随机分为对照组和实验组,对照组4只,实验组6只。对照组每只小鼠腹腔注射150 mmol/L葡萄糖溶液溶解的二甲基亚砜(DMSO),而实验组每只小鼠注射150 mmol/L葡萄糖溶液溶解的衣霉素。分别于0、24、48h各注射1次药物,第3次注射后4h处死小鼠,收集小鼠卵巢。
1.2 HE染色 将收集的小鼠卵巢立即放入4%的多聚甲醛固定过夜,石蜡包埋切片。二甲苯脱蜡,100%、95%、90%、80%及70%的乙醇由高到低至切片入水。将已入蒸馏水后的切片放入苏木精水溶液中染色数分钟。切片放入自来水中洗去多余的苏木精染料。70%乙醇配制的0.5%~1%盐酸对切片分色数秒到数十秒。放入0.5%~1%氨水中30~60 s蓝化。0.5%~1%伊红染料染色2~3 min。100%、95%、90%、80%及70%的乙醇从低到高脱水,再经二甲苯使切片透明,树胶封片。
1.3 RNA的提取及RT-qPCR实验 采用Quick-RNA MiniPrep kit(ZYMO Research)试剂盒提取组织 RNA,使用NanoDrop分光光度计检测提取的RNA的浓度和纯度。取1 μg RNA使用 RevertAid First Strand cDNA Synthesis Kit(Thermo Scientific)试剂盒将RNA反转录为cDNA。qPCR实验采用7500 Real-Time PCR仪(Applied Biosystems)完成。以β-actin为内参照,引物序列见表1。体系为:1 μL cDNA样品,各 1 μL 上下游引物,7 μL 水,10 μL SYBR green mix(Applied Biosystems)。反应条件:50℃ 2 min,95℃ 2 min;40个循环:95 ℃ 15 s,60 ℃ 1 min。采用2-ΔΔCT法分析结果。

Tab.1 The primer sequences used for real-time quantitative PCR表1 实时定量PCR中使用的引物序列
1.4 统计学方法 采用SPSS 19.0进行统计学分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠卵巢内质网应激模型的建立 与对照组相比,实验组小鼠卵巢内质网应激相关分子HSPA5、CHOP、ATF4mRNA表达显著上调,差异有统计学意义(P<0.05),见表2。
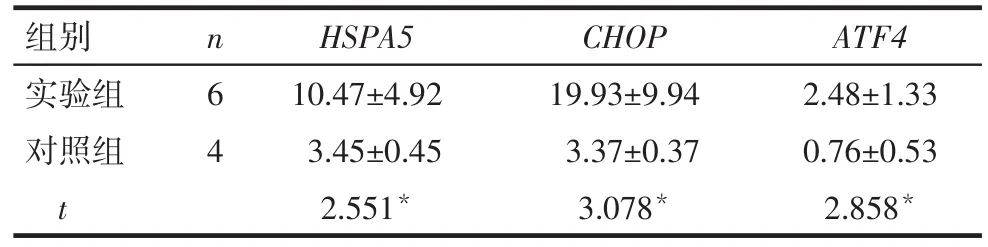
Tab.2 Expression of ER stress related genes表2 内质网应激相关分子表达情况
2.2 内质网应激对小鼠卵巢卵泡发育的影响 对照组小鼠卵巢中可以看到各期发育的卵泡,在衣霉素处理后,小鼠卵巢中卵泡数量明显减少,只有少数极小的卵泡,见图1。
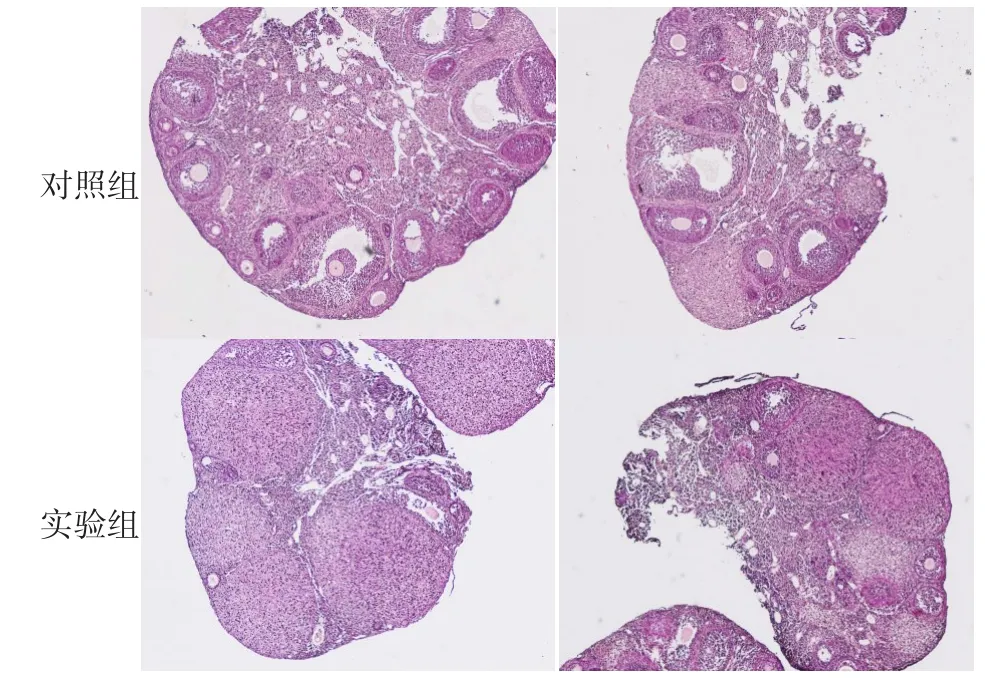
Fig.1 HE staining showing ovaries of mice(×40)图1 HE染色检测小鼠卵巢变化(×40)
3 讨论
卵巢是一个长期处在动态变化中的器官。成年人的卵巢,无论是其结构还是功能,都存在周期性变化的特征。卵巢既具有产生卵母细胞和维持卵母细胞分裂生长的生殖作用,也具有分泌性激素的内分泌功能,而卵泡是执行卵巢生殖和内分泌功能的基本单位,卵泡的质量和数量决定着生殖潜能和生殖周期。卵泡主要包括了最内层的卵母细胞、包裹卵母细胞的颗粒细胞以及卵泡最外层的膜细胞,其发育经历了4个过程:即始基卵泡、次级卵泡、窦前卵泡及排卵前卵泡[11]。在卵泡发育的整个过程中,只有有限的卵泡(大约300~400个或者整体的1%)发育成熟并进行排卵,大多数卵泡在发育的各个阶段逐渐退化,发生卵泡闭锁。大量研究已经明确了下丘脑-垂体-卵巢轴在卵泡闭锁中的重要作用[12],但对于卵巢局部微环境及卵泡内生殖细胞体细胞对卵泡闭锁的影响尚未完全阐明。
内质网应激诱导激活的UPR是一个集适应性应答和凋亡性应答于一体的双重反应途径,轻度或短暂的内质网应激通过激活三条经典通路改善内质网蛋白折叠能力,促进细胞恢复稳态,当内质网应激持续激活时,UPR会诱导激活下游凋亡通路,促使细胞凋亡以避免对整个器官的损害[13]。UPR对于改善内质网稳态,维持内质网稳态至关重要,但过度激活的内质网应激造成UPR凋亡途径的启动被认为参与了多种疾病的发生。
目前已有研究发现内质网应激的激活会促进颗粒细胞凋亡,颗粒细胞可能参与卵泡闭锁过程[14]。颗粒细胞是卵泡的主要细胞成分,不仅对维持卵母细胞的生长发育至关重要,也是性激素合成的主要场所。研究发现,在卵泡闭锁的早期阶段,凋亡主要发生在颗粒细胞层,而非卵母细胞或膜细胞层,因此颗粒细胞被视为卵泡闭锁的启动者[15]。有实验在羊卵巢各级卵泡颗粒细胞中检测了内质网应激相关分子的表达情况,结果发现在羊卵巢的闭锁卵泡和未闭锁卵泡的颗粒细胞中均检测到了UPR标志分子GRP78(HSPA5)的表达,而UPR中与凋亡密切相关的CHOP分子的表达仅在闭锁卵泡的颗粒细胞中检测到,未闭锁卵泡中并没有检测到;另外,闭锁卵泡中GRP78和CHOP的分布与闭锁卵泡中凋亡的颗粒细胞分布一致,均位于闭锁卵泡卵泡腔侧颗粒细胞[14]。也有研究利用体外实验探索内质网应激对颗粒细胞的影响,通过加入内质网应激诱导物衣霉素或加入无血清培养液模拟营养缺乏环境诱导颗粒细胞发生内质网应激,导致了颗粒细胞凋亡[14],这进一步验证了UPR在调节颗粒细胞凋亡中的重要作用。在已建立的小鼠内质网应激模型中,本研究结果显示与对照组相比,衣霉素处理后的小鼠卵巢各期卵泡数均明显减少,说明内质网应激明显抑制了小鼠卵巢卵泡的发育。产生这一结果的原因可能与内质网应激激活凋亡反应途径促进颗粒细胞凋亡的作用有关,而颗粒细胞凋亡是导致卵泡闭锁的重要因素。此外,内质网是甾体激素合成的重要场所,雌、孕、雄激素的合成依赖于内质网和线粒体的精密配合,内质网应激的激活会造成内质网功能紊乱,不仅会破坏激素合成的局部环境,也可能干扰激素合成相关酶的表达,因此内质网应激很可能影响了性激素合成水平,从而影响了卵泡发育。
[1]Wang Q,Groenendyk J,Michalak M.Glycoprotein quality control and endoplasmic reticulum stress[J].Molecules,2015,20(8):13689-13704.doi:10.3390/molecules200813689.
[2]Daniele T,Schiaffino MV.Lipid transfer and metabolism across the endolysosomal-mitochondrial boundary[J].Biochim Biophys Acta,2016,1861(8 Pt B):880-894.doi:10.1016/j.bbalip.2016.02.001.
[3]Duan XQ,Li YH,Zhang XY,et al.Mechanisms of intracellular calcium homeostasis in MC3T3-E1 cells and bone tissues of Sprague-Dawley rats exposed to fluoride[J].Biol Trace Elem Res,2016,170(2):331-339.doi:10.1007/s12011-015-0465-6.
[4]Gao Y,Jia P,Shu W,et al.The protective effect of lycopene on hypoxia/reoxygenation-induced endoplasmic reticulum stress in H9C2 cardiomyocytes[J].Eur J Pharmacol,2016,774:71-79.doi:10.1016/j.ejphar.2016.02.005.
[5]Marjon PL,Bobrovnikova-Marjon EV,Abcouwer SF.Expression of the pro-angiogenic factors vascular endothelial growth factor and interleukin-8/CXCL8 by human breast carcinomas is responsive to nutrient deprivation and endoplasmic reticulum stress[J].Mol Cancer,2004,3:4.doi:10.1186/1476-4598-3-4.
[6]Zhou Y,Sun P,Wang T,et al.Inhibition of calcium influx reduces dysfunction and apoptosis in lipotoxic pancreatic beta-cells via regulation of endoplasmic reticulum stress[J].PLoS One,2015,10(7):e0132411.doi:10.1371/journal.pone.0132411.
[7]Cui W,Ma J,Wang X,et al.Free fatty acid induces endoplasmic reticulum stress and apoptosis of beta-cells by Ca2+/calpain-2 pathways[J].PLoS One,2013,8(3):e59921.doi:10.1371/journal.pone.0059921.
[8]Rond,Walter P.Signal integration in the endoplasmic reticulum unfolded protein response[J].Nat Rev Mol Cell Biol,2007,8(7):519-529.doi:10.1038/nrm2199.
[9]Monniauxd,Michel P,Postel M,et al.Multi-scale modelling of ovarian follicular development:From follicular morphogenesis to selection for ovulation[J].Biol Cell,2016,108(6):149-160.doi:10.1111/boc.201500087.
[10]Harada M,Nose E,Takahashi N,et al.Evidence of the activation of unfolded protein response in granulosa and cumulus cells during follicular growth and maturation[J].Gynecol Endocrinol,2015,31(10):783-787.doi:10.3109/09513590.2015.1062862.
[11]McGee EA,Hsueh AJ.Initial and cyclic recruitment of ovarian follicles[J].Endocr Rev,2000,21(2):200-214.doi:10.1210/edrv.21.2.0394.
[12]Hong IS,Cheung AP,Leung PC.Gonadotropin-releasing hormonesⅠ and Ⅱ induce apoptosis in human granulosa cells[J].J Clin Endocrinol Metab,2008,93(8):3179-3185.doi:10.1210/jc.2008-0127.
[13]Tabas I,Rond.Integrating the mechanisms of apoptosis induced by endoplasmic reticulum stress[J].Nat Cell Biol,2011,13(3):184-190.doi:10.1038/ncb0311-184.
[14]Lin P,Yang Y,Li X,et al.Endoplasmic reticulum stress is involved in granulosa cell apoptosis during follicular atresia in goat ovaries[J].Mol Reprod Dev,2012,79(6):423-432.doi:10.1002/mrd.22045.
[15]Asselin E,Xiao CW,Wang YF,et al.Mammalian follicular development and atresia:role of apoptosis[J].Biol Signals Recept,2000,9(2):87-95.doi:10.1159/000014627.

