稳定表达GFP-LC3蛋白的THP-1细胞系的构建
雷蕾,黄珊,于明航,刘志强,刘师伟,李婷,赵秀娟,李泽兴△,王玺△
自噬是真核生物的应激调控机制,通过循环利用细胞自身的一些细胞器、蛋白质等生物大分子来满足细胞的代谢更新和细胞内稳态维持。上世纪60年代,科学家通过电子显微镜发现了自噬的存在,确认自噬是细胞的“自食”现象。微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)通过剪切修饰定位于自噬体膜上,成为指示自噬的标志蛋白[1-2]。人急性单核细胞白血病细胞(THP-1)是从急性单核细胞性白血病患者外周血中分离建立的细胞系[3],是体外研究单核-巨噬细胞分化、免疫功能和信号通路机制等常用的细胞系[4-5]。为了更直观地检测单核-巨噬细胞中的自噬现象,本研究通过慢病毒质粒系统使THP-1细胞稳定表达GFP-LC3融合蛋白,为在单核-巨噬细胞中深入研究自噬提供可靠的细胞模型。
1 材料与方法
1.1 细胞与质粒 THP-1细胞、293T细胞为天津医科大学细胞生物学系发育与肿瘤发生表观遗传学实验室保存;pCDH-CMV-MCS-EF1α-puro、pAS-TMX、pMD-1G质粒由中国科学院动物研究所孙钦秒研究员惠赠;pCDH-CMV-GFPLC3-EF1α-puro由本实验室按标准分子生物学技术构建。
1.2 主要试剂及仪器 DMEM高糖培养基、RPMI 1640培养基、青霉素-链霉素购自天津市中奥天元科技有限公司;胎牛血清购自乌拉圭Lonsera公司;胰蛋白酶和Opti-MEM I减血清培养基购自英潍捷基(上海)贸易有限公司;嘌呤霉素(Puromycin)购自上海源叶生物科技有限公司;Earle’s平衡盐溶液(EBSS)购自江苏凯基生物技术股份有限公司;雷帕霉素(Rapamycin)购自美国LC Laboratories公司;聚乙烯亚胺(PEI)溶液由Milli Q水配制成1 g/L(pH=7.2)储存液;聚凝胺(polybrene)溶液由Milli Q水配制成1 g/L储存液;佛波酯(PMA)购自Sigma公司,由DMSO配制成2.5 g/L储存液;细胞裂解液[0.5%Triton X-100,50 mmol/L Tris-HCl,pH=7.2,150 mmol/L NaCl,10%Glycerol,10 mmol/L MgCl2,蛋白酶抑制剂(100 mmol/L PMSF;100 mg/L Aprotinin)];Western blot ECL发光液(德国默克公司);LSRFortessa流式细胞仪(美国BD公司);AI 600系列超灵敏多功能成像仪(美国GE公司);电泳仪、转膜仪(美国Bio-Rad公司);倒置荧光显微镜、激光共聚焦显微镜(日本OLYMPUS公司)。
1.3 抗体 鼠抗GFP单克隆抗体、鼠抗α-Tubulin单克隆抗体、HRP标记的羊抗兔IgG抗体(天津三箭生物技术股份有限公司),兔抗LC3A/B抗体、辣根过氧化物酶(HRP)标记的鼠抗IgG抗体(CST公司)。
1.4 稳定表达GFP-LC3的THP-1细胞系的建立
1.4.1 PEI转染293T细胞包装慢病毒 转染前1d对293T细胞进行计数,将4×106个细胞接种于直径为100 mm细胞培养皿中;第2天,取1 mL Opti-MEM置于1.5 mL EP管中,加入20 μL PEI后轻轻震荡混匀,加入20 μg DNA(10 μg pCDHCMV-GFP-LC3-EF1α -puro,5 μg pAS-TMX,5 μg pMD-1G),轻轻震荡混匀,室温静置5 min;将DNA-PEI混合物逐滴加入293T细胞中,轻轻晃动培养皿使沉淀分散均匀,正常培养;转染8h后将293T细胞DMEM培养基更换为5 mL RPMI 1640培养基。
1.4.2 慢病毒感染THP-1细胞系 转染48h后收集293T细胞及培养基,2 000 r/min离心5 min取上清,使用0.45 μm滤器过滤,加入polybrene使其终浓度为8 mg/L;将THP-1细胞离心后去掉正常培养基,使用上述配制好的病毒液重悬细胞,感染12h后更换正常RPMI 1640培养基。
1.4.3 Puromycin筛选稳定细胞株 病毒感染48h后,换为Puromycin终浓度为0.1 mg/L的RPMI 1640培养基进行抗性筛选,每3d更换1次含Puromycin的RMPI 1640培养基,同时以未感染病毒的THP-1细胞作为阴性对照。培养6d后,阴性对照组细胞全部死亡,病毒感染组细胞正常生长,荧光显微镜观察感染的THP-1细胞表达GFP蛋白。
1.5 稳定表达GFP-LC3蛋白THP-1细胞系的鉴定
1.5.1 倒置荧光显微镜观察THP-1细胞中GFP-LC3蛋白的表达 倒置荧光显微镜观察培养皿中表达GFP-LC3蛋白的THP-1细胞,镜下任意选取视野,分别于明暗视野观察细胞,检测绿色GFP蛋白表达的高低。
1.5.2 流式细胞术检测THP-1细胞中GFP-LC3蛋白的表达 将表达GFP-LC3的感染组THP-1细胞和未感染组THP-1细胞,分别制备成1×106个/mL的细胞悬液;取0.5 mL用流式细胞仪488 nm激光器激发,FITC荧光通道收集荧光信号,获取5 000个细胞,以未感染组THP-1细胞作阴性对照,分析GFP阳性细胞的百分率和平均荧光强度。
1.5.3 Western blot检测THP-1细胞中GFP-LC3蛋白的表达 分别收集5×106个感染组THP-1细胞和未感染组THP-1细胞,1 000 r/min离心5 min,去掉培养基后,使用1 mL PBS洗涤1次;加入适量细胞裂解液,超声破碎后,将总蛋白煮沸5 min使其变性;取适量蛋白样品进行SDS-PAGE,并电转移至NC膜,5%脱脂奶粉/TBST室温封闭1h,加入一定比例稀释的一抗(GFP 1∶500,LC3A/B 1∶1 000,α-Tubulin 1∶5 000),4℃孵育过夜,TBST洗膜3次后,分别加入HRP标记的IgG二抗(鼠抗HRP 1∶4 000,羊抗兔HRP 1∶2 000),室温孵育1h,TBST洗膜3次,加入ECL液暗室孵育适当时间,利用GE AI 600系列超灵敏多功能成像仪进行显色,Image J软件进行分析。
1.6 饥饿及药物诱导THP-1稳定表达细胞系的自噬发生
1.6.1 激光共聚焦法观察饥饿和药物诱导细胞自噬体的形成 对获得的稳定表达GFP-LC3的THP-1细胞,按1×105个/孔接种于预置爬片的12孔板中,生长24h后将其分为3组。(1)正常对照组:正常培养基中加入100 μg/L PMA,培养7h。(2)饥饿处理组:EBSS溶液培养同时加入100 μg/L PMA孵育7h。(3)药物处理组:正常培养基中加入500 nmol/L雷帕霉素和100 μg/L PMA共同孵育7h。以上3组处理结束后,用1×PBS洗涤细胞,之后用4%甲醛/PBS对细胞进行固定,使用激光共聚焦显微镜观察3组细胞,各组随机取10个视野,观察GFP蛋白的表达和细胞内自噬体的形成。
1.6.2 Western blot检测饥饿和药物诱导自噬的形成 对获得的稳定表达GFP-LC3蛋白的THP-1细胞,按1×106个/孔接种于6孔板中,生长24h后将其分为3组。(1)正常对照组:正常培养基中加入100 μg/L PMA培养12h。(2)饥饿处理组:EBSS溶液培养同时加入100 μg/L PMA共同孵育12h。(3)药物处理组:正常培养基中加入500 nmol/L雷帕霉素和100 μg/L PMA共同孵育12h。分别收集3组细胞,按1.5.3方法进行Western blot实验,检测自噬的形成。
1.7 统计学方法 采用SPSS 16.0统计软件进行数据处理和分析,计量资料以均数±标准差(x ±s)表示,组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 稳定表达GFP-LC3蛋白的THP-1细胞系鉴定结果
2.1.1 倒置荧光显微镜观察的结果 倒置荧光显微镜下观察稳定表达GFP-LC3蛋白的THP-1细胞,可看到GFP阳性细胞数目较多,且呈悬浮状态,见图1。
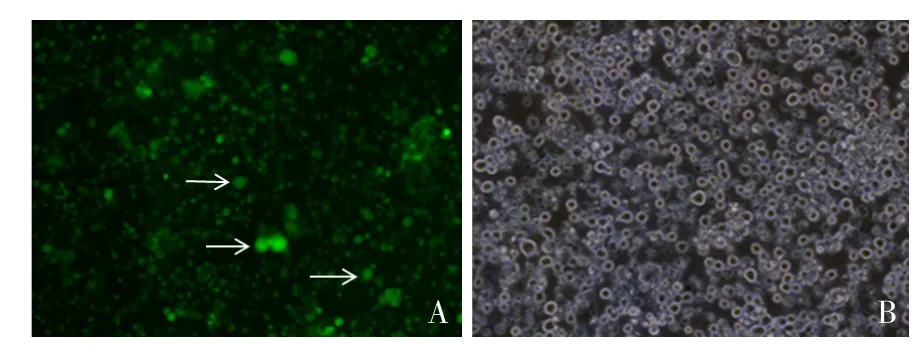
Fig.1 Expression of GFP in THP-1 cells observed by fluorescent microscope(×20)图1 荧光显微镜下观察GFP蛋白在THP-1细胞中的表达(×20)
2.1.2 流式细胞术检测结果 流式细胞术结果显示,以未感染组THP-1细胞为阴性对照,感染组THP-1细胞GFP阳性百分比高达92.7%,见图2。
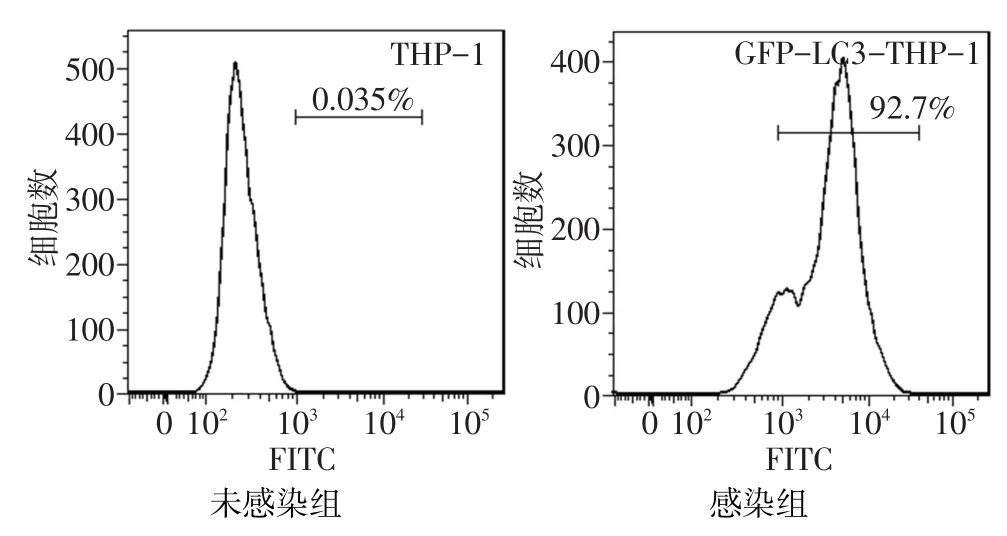
Fig.2 The expression levels of GFP in THP-1 cells detected by FACS图2 流式细胞术检测THP-1细胞中的GFP的表达效率
2.1.3 Western blot检测结果 结果显示,未感染组中仅可以检测到内源LC3蛋白(Ⅰ型-16 ku;Ⅱ型-14 ku);感染组除了内源性LC3有表达,在45 ku附近也有GFP-LC3融合蛋白表达,其表达量与设计一致,见图3。
2.2 饥饿及药物诱导自噬体形成的结果
2.2.1 激光共聚焦法观察结果 激光共聚焦显微镜下观察,正常对照组的绿色荧光在细胞中呈散在分布;饥饿处理组和药物处理组诱导自噬后,多数细胞胞质中出现绿色荧光点状聚集的自噬体,见图4。
2.2.2 Western blot检测结果 正常对照组中的GFP-LC3蛋白在45 ku附近为单一条带;饥饿处理组和药物处理组中,GFP-LC3融合蛋白发生剪切,从GFP-LC3-Ⅰ型向GFP-LC3-Ⅱ型转化,蛋白的分子质量变小。Western blot灰度分析显示,与正常对照组相比,饥饿处理组和药物处理组GFP-LC3融合蛋白从Ⅰ型向Ⅱ型转化明显增加(P<0.05)。见图5。
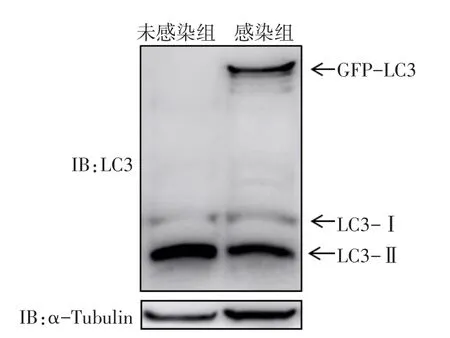
Fig.3 The expression of GFP-LC3 and LC3-Ⅰ/LC3-Ⅱin THP-1 cells图3 THP-1细胞感染后GFP-LC3和内源LC3-Ⅰ/LC3-Ⅱ蛋白的表达结果
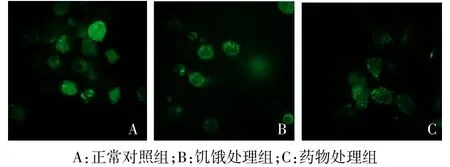
Fig.4 Aggregates of GFP-LC3 in THP-1 cell line observed by confocal microscope(×60)图4 激光共聚焦显微镜观察THP-1稳定细胞系中GFP-LC3的聚集(×60)
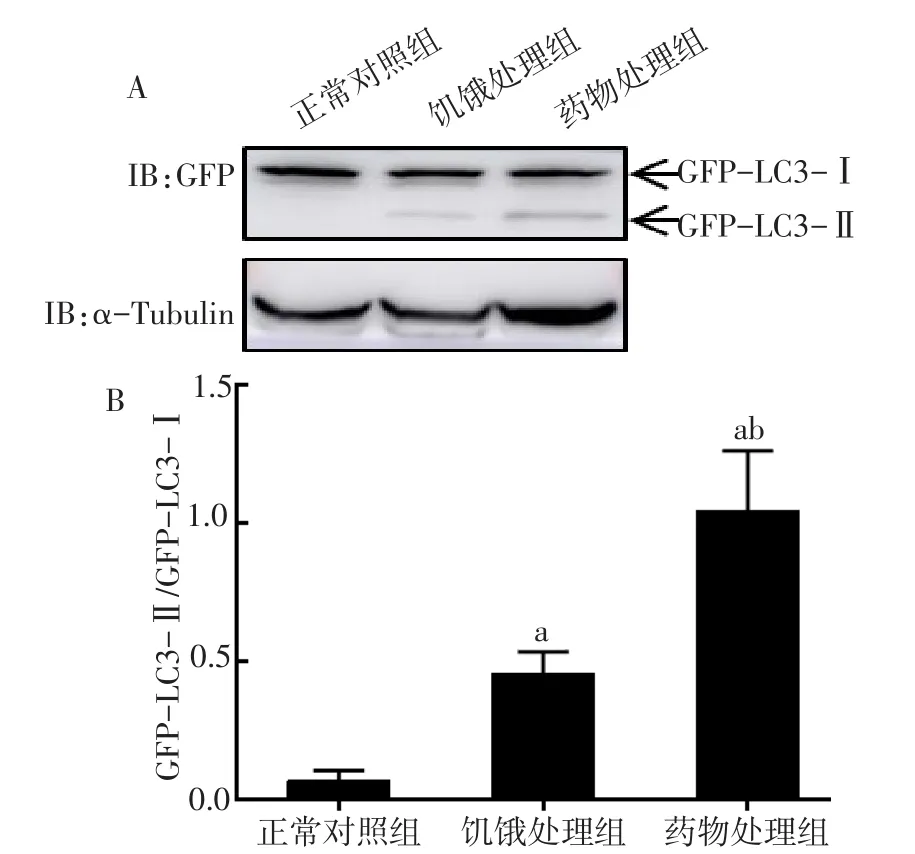
Fig.5 Expression of GFP-LC3-Ⅱ/Ⅰin the EBSS-or rapamycintreated THP-1 cells图5 饥饿及药物处理GFP-LC3-THP-1细胞后GFP-LC3-Ⅰ型蛋白向GFP-LC3-Ⅱ型蛋白转化的表达结果
3 讨论
3.1 自噬在临床疾病中的研究进展 近年的研究表明,自噬和许多疾病的发生发展有密切联系。自噬可通过与先天免疫信号共同调节炎症[6-7]。自噬相关基因通过调控肿瘤微环境,对肿瘤的生长与增殖产生双重调节作用,为发现肿瘤治疗的潜在靶点提供了新思路[8]。另外,在阿尔茨海默病、帕金森病等神经退行性疾病中,通过自噬来控制蛋白质质量是神经元存活和功能的重要保证,一旦自噬功能缺失,神经元中错误折叠蛋白质或受损细胞器不断累积,这就可能成为各种神经退行性疾病发生和发展的基础[9]。
3.2 自噬的诱导及检测方法 通过电镜检测自噬体及其相关结构是检测自噬的金标准,但由于电镜操作及数据分析专业性要求较高,目前的文献报道中最常用的方法有Western blot检测自噬标志蛋白LC3-Ⅰ(16 ku)与LC3-Ⅱ(14 ku)之间的转化和比例变化,以及通过荧光显微镜观察LC3点状聚集物的形成[10-12],这些方法都可以监测自噬发生的程度。2006年首次报道了雷帕霉素机制性靶标(the mechanistic target of rapamycin,mTOR)与自噬的关系,并证实抑制mTOR可以提高自噬水平[13-14],由此利用雷帕霉素诱导自噬成为经典模型之一。饥饿状态下细胞也可以通过调控AMPK、mTOR等信号通路来提高自噬水平,促进细胞内组分加快降解循环以维持细胞正常生存[15]。基于以上方法检测稳定表达GFP-LC3蛋白的THP-1细胞系,操作简便,自噬现象易于观察,证实此细胞系可作为判断自噬水平的一种细胞模型。
3.3 本研究的意义 慢病毒感染相较其他转染方法使THP-1细胞的转染效率更高[16],由此利用慢病毒质粒系统构建稳定表达GFP-LC3蛋白的THP-1细胞系,此细胞系在诱导自噬的条件下,融合蛋白GFP-LC3随着自噬体的形成发生聚集,通过观察GFP-LC3融合蛋白的变化,反映出内源性LC3的类型转化。因此,稳定表达GFP-LC3蛋白的THP-1细胞系为进一步探讨单核-巨噬细胞的自噬机制奠定了实验基础。
[1]Ohsumi Y.Historical landmarks of autophagy research[J].Cell Res,2014,24(1):9-23.doi:10.1038/cr.2013.169.
[2]Ravanan P,Srikumar IF,Talwar P.Autophagy:The spotlight for cellular stress responses[J].Life Sci,2017,188:53-67.doi:10.1016/j.lfs.2017.08.029.
[3]Tsuchiya S,Yamabe M,Yamaguchi Y,et al.Establishment and characterization of a human acute monocytic leukemia cell line(THP-1)[J].Int J Cancer,1980,26(2):171-176.
[4]Chanput W,Mes JJ,Wichers HJ.THP-1 cell line:an in vitro cell model for immune modulation approach[J].Int Immunopharmacol,2014,23(1):37-45.doi:10.1016/j.intimp.2014.08.002.
[5]郭志霞,毛立斌,王会琴,等.中等强度静磁场对THP-1细胞分泌炎症因子的影响[J].天津医药,2016,44(3):290-294.Guo ZX,Mao LB,Wang HQ,et al. The effect of moderate static magnetic fields on secretion of pro-inflammatory factors in THP-1 cells[J].Tianjin Med J,2016,44(3):290-294.doi:10.11958/20150055.
[6]Hua Y,Shen M,McDonald C,et al.Autophagy dysfunction in autoinflammatory diseases[J].J Autoimmun,2017,pii:S0896-8411(17)30557-7.doi:10.1016/j.jaut.2017.10.012.
[7]Netea-Maier RT,Plantinga TS,van de Veerdonk FL,et al.Modulation of inflammation by autophagy:Consequences for human disease[J].Autophagy,2016,12(2):245-260.doi:10.1080/15548627.2015.1071759.
[8]White E.The role for autophagy in cancer[J].J Clin Invest,2015,125(1):42-46.doi:10.1172/JCI73941.
[9]Cai Y,Arikkath J,Yang L,et al.Interplay of endoplasmic reticulum stress and autophagy in neurodegenerative disorders[J].Autophagy,2016,12(2):225-244.doi:10.1080/15548627.2015.1121360.
[10]Wang Y,Li Y,Wei F,et al.Optical imaging paves the way for autophagy research[J].Trends Biotechnol,2017,35(12):1181-1193.doi:10.1016/j.tibtech.2017.08.006.
[11]Suzukih,Osawa T,Fujioka Y,et al.Structural biology of the core autophagy machinery[J].Curr Opin Struct Biol,2017,43:10-17.doi:10.1016/j.sbi.2016.09.010.
[12]Klionsky DJ,Abdelmohsen K,Abe A,et al.Guidelines for the use and interpretation of assays for monitoring autophagy(3rd edition)[J].Autophagy, 2016,12 (1) :1-222.doi:10.1080/15548627.2015.1100356.
[13]Ravikumar B,Berger Z,Vacher C,et al.Rapamycin pre-treatment protects against apoptosis[J].Hum Mol Genet,2006,15(7):1209-1216.doi:10.1093/hmg/ddl036.
[14]Yu L,McPhee CK,Zheng L,et al.Termination of autophagy and reformation of lysosomes regulated by mTOR[J].Nature,2010,465(7300):942-946.doi:10.1038/nature09076.
[15]White E,Mehnert JM,Chan CS.Autophagy,metabolism,and cancer[J].Clin Cancer Res,2015,21(22):5037-5046.doi:10.1158/1078-0432.CCR-15-0490.
[16]颜文杰,孙文逵,李培,等.三种不同方法转染THP-1巨噬细胞效果比较[J/CD].中华肺部疾病杂志(电子版),2015,8(1):7-12.Yan WJ,Sun WK,Li P,et al.Comparison of transfection of THP-1 macrophage by three different methods[J/CD].Chin J Lung Dis(Electronic Edition),2015,8(1):7-12.doi:10.3877/cma.j.issn.1674-6902.2015.01.003.

