Ecc36菌株hrpN基因的克隆、表达及HrpNEccPR蛋白的生物学活性
贾振华,刘 方,宋 聪,黄亚丽,马 宏 ,宋水山
(1.河北省科学院 生物研究所,河北 石家庄 050081;2.河北省主要农作物病害微生物控制工程技术研究中心,河北 石家庄 050081)
hrp基因(hrp,Hypersensitive response and pathogenity gene)广泛存在于革兰氏阴性植物病原细菌中,能够表达一种热稳定性Harpins蛋白,该蛋白不仅能够促进植物的生长发育[1-2],也会引起非寄主植物的过敏反应(HR,Hypersensitive response),Harpins蛋白能够广泛诱导植物对植物病虫害的防卫反应,增强植物的免疫反应[3-7]。研究表明,植物病原菌主要通过Ⅲ型分泌通路将Harpin蛋白分泌到植物细菌细胞外,能够激发非寄主植物的HR或诱导植物对病原菌产生抗病性[8-11]。因而,开发新型Harpin蛋白和研究Harpin诱导防卫机制已成为新研究热点。自1986 年Lindgren等[12]首次报道hrp基因以来,人们对hrp基因进行了广泛的研究。HarpinEa是一种从梨火疫欧文氏杆菌(Erwiniaamylovora)中分离到的Harpin蛋白,它能够诱发烟草HR反应[12-13]。1995年Cui等[14-15]借助分子生物学手段首次从胡萝卜软腐欧文氏菌(E.carotovorasubsp.carotovora)Ecc71中分离到hrpN基因并克隆该基因。国内科研人员越来越多地研究Harpin蛋白和hrp基因,其中对来源于胡萝卜软腐欧文氏菌的Harpin蛋白的研究有了很大的进展,对其表达hrp基因克隆的研究也有了很大的突破,科研人员分别从E.carotovorasubsp.carotovoraCSSY002、carotovoraCSDS001以及betavasculorumCSL101等菌株中克隆到不同基因序列的hrp基因,这些hrp基因均能表达氨基酸序列不同程度差异的Harpin蛋白,但这几种Harpin蛋白均能诱导烟草过敏反应。携带hrp基因的不同植物病原菌携带的hrp基因具有一定的保守性,但也存在着很大的差异性,而其表达的Harpin蛋白对诱导不同的植物产生抗性也不同。本研究主要报道高致病性病原菌胡萝卜软腐欧文氏 (E.carotovorapv.carotovora) Ecc36菌株的胞外酶活性,对其致病性进行了鉴定,克隆了Ecc36菌株中的hrpNEccPR基因,并进行了筛选和测序,通过构建的pET30a-EccPR质粒在大肠杆菌工程菌株BL21(DE3)中高效IPTG诱导表达HrpNEccPR蛋白,鉴定产物HrpNEccPR蛋白的生物学活性。
1 材料和方法
1.1 试验材料
Ecc36菌株由河北省科学院生物研究所生物工程实验室收藏;大肠杆菌工程菌株BL21(DE3) (大连宝生物工程有限公司);pET28a(+)质粒(大连宝生物工程有限公司);LB培养基利用文献[9-10]中的方法进行配制;抗性培养基为LB培养基中加入50 μg/mL卡那霉素(Km)。提取试剂盒(大连宝生物工程有限公司);DNA 纯化试剂盒(Qiagen公司);DNA标记系统(Promega公司)。
1.2 试验方法
1.2.1 菌株Ecc36 胞外酶的检测 参考文献[15-16]配制菌株Ecc36胞外酶的琼脂固体平板培养基,利用文献[17]中的方法检测Ecc36菌株分泌的多聚半乳糖醛酸酶(Polygalacturonase,Peh)、蛋白酶(Protease,Prt)、纤维素酶(Cellulase,Cel)及果胶酶(Pectate lyase,Pel)活性。通过平板上菌落周围的透明圈大小分析酶活性水平。
1.2.2 菌株Ecc36 对植物的致病性 挑取Ecc36菌株单菌落,培养24 h后,用无菌水将菌体稀释成5×109cfu/mL的菌悬液,利用悬浮液接种于大白菜,每个孔接种0.05 mL,28 ℃保湿培养,48 h后根据大白菜软腐程度判断菌株致病情况。
1.2.3 菌株Ecc36 过敏反应测试 将菌株Ecc36单菌落接种到LB 液体培养基,将菌株28 ℃培养24 h后,用无菌10 mmol/L氯化镁溶液稀释成2×108cfu/mL菌悬液,采用0.3 mL菌悬液注射到烟草叶片的方法来检测Ecc36过敏反应活性,用无菌10 mmol/L氯化镁溶液作为对照。接种24 h后,观察烟草叶片是否出现坏死斑现象。
1.2.4hrpNEccPR基因的鉴定 利用Southern杂交方法鉴定hrpNEccPR基因,用EcoRⅠ消化Ecc36菌株染色体DNA,以地高辛标记的Ecc36菌株hrpNDNA为探针进行Southern杂交。杂交条件见参考文献[18]。
1.2.5 携带hrpNEccPR工程菌的构建 参考hrpNEcc71基因,合成文献[19]中报道的hrpNEcc71上下游引物,进行PCR 扩增,反应条件如下:95 ℃ 5 min;95 ℃ 1 min,58 ℃ 1 min,72 ℃ 2 min,循环25次。将纯化的PCR产物,经内切酶BamHⅠ和Hind Ⅲ进行酶切构建到质粒载体pET30(+)上,形成了pET30a-EccPR表达质粒。基因测序由上海生工完成,根据测序结果,hrpNEccPR基因进行分析。基因扩增和克隆方法见文献[20-22]。将质粒pET30a-EccPR转化到大肠杆菌BL21(DE3),构建高效表达的大肠杆菌工程菌。
1.2.6 HrpNEccPR的诱导表达及检测 将工程菌BL21(DE3)在卡那霉素抗性的LB液体培养基中37 ℃培养,当培养菌液的OD600=0.6~0.8时,加入终浓度为0.8 mmol/L的 IPTG进行诱导培养,8 h后,离心收集菌体,4倍体积的缓冲溶液重悬,煮沸10 min,收集上清液。
HrpNEccPR蛋白的12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE) 检测方法参照文献[23]。
1.2.7 HrpNEccPR的活性检测 利用HrpNEccPR蛋白分别配制浓度为100,50,25 μg/mL蛋白水溶液,分别接种到烟草叶片,24 h后检查HR枯斑,水为对照。
2 结果与分析
2.1 菌株Ecc36 的致病性及其过敏反应
菌株Ecc36 是一种软腐病致病菌株,其致病性由植物细胞壁降解酶类(Plant cellwall-degrading enzymes,PCWDEs) 决定[24-25],这些酶类分别为果胶酶(Pel)、多聚半乳糖醛酸酶(Peh)、蛋白酶(Prt)和纤维素酶(Cel)。胞外酶检测结果显示,Ecc36菌株能分泌Pel、Peh、Prt、Cel,且这4种酶具有较高活性(图1)。将Ecc36菌株接种于大白菜并温育48 h,大白菜出现明显的软腐病斑块,而对照(CK)不产生软腐病症(图2),说明Ecc36菌株具有较强致病性,也推断出Ecc36菌株高致病性可能与胞外酶的活性有关系。为了检测Ecc36菌株过敏反应症状,将Ecc36菌株接种于烟草叶片,以MgCl2为阴性对照,试验结果表明,Ecc36菌株培养液及上清液均能引起烟草的过敏反应(图3),说明Ecc36菌株分泌物中含有Harpin蛋白或者相似的物质。
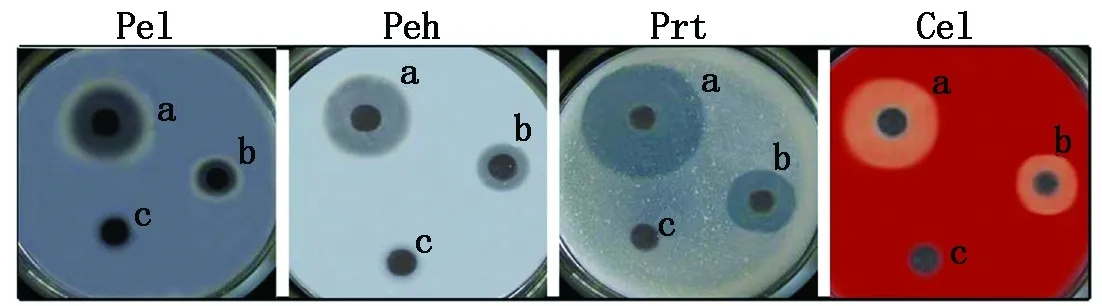
图1 Ecc36菌株分泌的胞外酶Fig.1 Extracellular enzymes produced by Ecc36

图2 Ecc36菌株引起大白菜软腐Fig.2 Soft rot caused by Ecc36 in chinese cabbage tissue
2.2 hrpNEccPR 基因的鉴定及克隆
成地高辛标记的hrpN基因核苷酸序列探针,建立Ecc36基因文库,通过菌落原位杂交技术,对Ecc36基因文库进行筛选。图4显示,从该文库中筛选出3个阳性克隆菌,分别为34号、63号和89号克隆菌斑。通过EcoRⅠ消化的89号菌斑(Ecc36-89)染色体DNA、Ecc71 DNA和大肠杆菌BL21 DNA,进行Southern杂交,试验结果显示,Ecc71具有阳性杂交带片段,Ecc36-89也出现了阳性杂交带片段,而阴性对照大肠杆菌BL21染色体DNA没有出现阳性克隆杂交带(图5)。结果表明,Ecc36基因组中含有hrpN基因。

A.MgCl2溶液;B.Ecc36培养液;C.Ecc36培养液上清液。A. MgCl2 solution;B. Culture solution with Ecc36;C. Supernatant of Ecc36 culture solution.

图4 原位杂交结果Fig.4 In situ hybridization
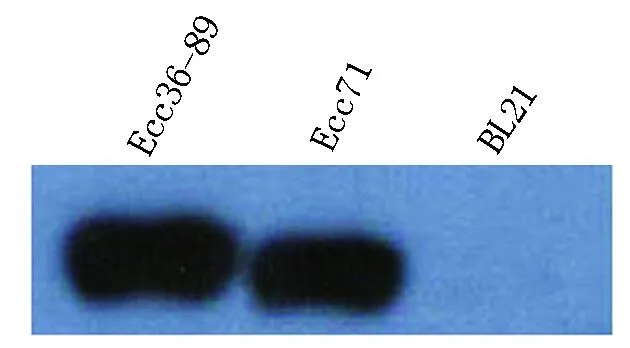
图5 hrpN基因Southern 杂交Fig.5 Southern Blot analysis of hrpN gene
2.3 hrpNEccPR 基因的核苷酸序列及HrpNEccPR 蛋白的氨基酸序列
将Ecc36-89基因组中克隆的hrpN基因命名为hrpNEccPR基因,hrpNEccPR基因测序结果表明,其编码开放阅读框(ORF)为1 254个核苷酸(图6),与来自其他hrpNEch、hrpNEcc编码基因相比分别具有87.8%和86.6%的序列同源性。
hrpNEccPR基因编码的蛋白HrpNEccPR由417个氨基酸残基组成,理论分子量45.27 ku,理论等电点5.73,序列中富含甘氨酸(G)。Ecc36 与其他几个菌株来源的hrpN编码氨基酸序列(HrpNEch、HrpNEcc)同源性较高,通过和其他hrpN基因编码的蛋白序列相比较,同源性达到43%(图7),而且C末端和N末端的同源性非常高,推测是其功能区域。这也和hrpN基因编码的蛋白功能一致,说明了生物的遗传多样性。

图6 hrpNEccPR基因序列Fig.6 HrpNEccPR gene sequence

图7 HrpNEccPR蛋白序列Fig.7 hrpNEccPR protein sequence
2.4 携带hrpNEccPR 基因的工程菌诱导表达
将hrpNEccPR基因构建在pET30a,命名为pET30a-EccPR,并转入BL21(DE3)中,获得大肠杆菌工程菌BL21(pET30a-EccPR),经IPTG诱导表达工程菌BL21(pET30a-EccPR),SDS-PAGE(浓度为12%)蛋白电泳结果显示(图8) ,含有空载体质粒的BL21(DE3)大肠杆菌经IPTG诱导后不产生目的蛋白条带,工程菌BL21(pET30a-EccPR)经IPTG诱导能够产生目的条带,不经IPTG诱导,也不会产生HrpNEccPR蛋白目的条带。这些结果表明,工程菌在IPTG诱导下能够表达HrpNEccPR蛋白。
2.5 HrpNEccPR 蛋白诱导过敏反应
植物过敏反应已经成为检测一种蛋白或者小分子化合物具备Harpin类蛋白条件的一种重要生物测试方法,为检测HrpNEccPR蛋白的生物学活性,将纯化的HrpNEccPR蛋白(图8)接菌于烟草叶片,结果显示,纯化的HrpNEccPR蛋白能诱导烟草叶片产生过敏反应(图9),这与已报道的其他Harpin类蛋白的生物学活性一致,也说明HrpNEccPR蛋白是Harpin类蛋白的一种。试验结果也显示,HrpNEccPR蛋白诱发的植物过敏反应斑块大小与其浓度有关,随着HrpNEccPR蛋白浓度的增加,过敏反应病斑随之扩大,50 μg/mL的HrpNEccPR蛋白即能显著诱导过敏反应,而对照处理不引起过敏反应。
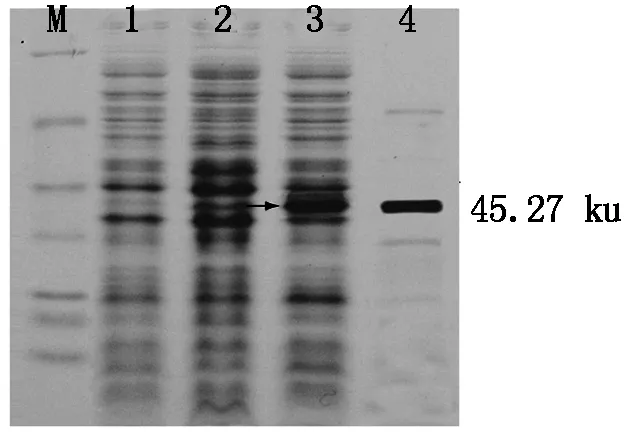
M.Marker; 1.BL21(DE3)/ pET-28a(+) + IPTG ; 2.BL21(DE3)/ pET30a-EccPR;3.BL21(DE3)/ pET30a-EccPR+IPTG ; 4.提纯的HrpNEccPR蛋白。
M.Marker; 1.BL21(DE3) carrying pET28a(+) + IPTG; 2.BL21(DE3) carrying pET30a-EccPR,no IPTG; 3.BL21(DE3) carryingpET30a-EccPR+IPTG; 4.Purified HrpNEccPR.
图8HrpNEccPR蛋白在工程菌中的IPTG诱导表达
Fig.8ExpressionofHrpNEccPRinducedbyIPTGinengineeringstrain

A.水;B.HrpNEccPR 50 μg/mL; C.HrpNEccPR 200 μg/mL;D. HrpNEccPR 100 μg/mL。A.H2O; B.HrpNEccPR 50 μg/mL; C.HrpNEccPR200 μg/mL; D.HrpNEccPR 100 μg/mL.
3 讨论与结论
Harpin蛋白是一类这些年来一直被关注的重要生物效应分子,Cui等[17]通过胡萝卜软腐欧文氏菌胡萝卜亚种Ecc71研究发现了由hrp基因编码的Harpin 蛋白,该蛋白是引发非寄主植物过敏性反应的重要因子,试验也证明,该蛋白能够诱导烟草叶片产生过敏反应,因而,hrp基因的遗传组成、表达调控及产物、功能已成为研究该领域的重点内容。通过对植物细胞壁降解酶类检测和分析,发现胡萝卜软腐欧文氏Ecc36菌株具有很强的胞外酶分泌活性,能够降解植物细胞壁[26],也是Ecc36的关键致病因子。hrpNEccPR基因测序结果显示,与其他几种来源于胡萝卜软腐欧文氏菌的Harpin蛋白编码基因序列具有很高的同源性,HrpNEccPR蛋白的氨基酸序列分析表明,其氨基酸序列与HrpNEcc蛋白、HrpNEch蛋白序列具有很高的同源性。而通过工程菌高效表达的HrpNEccPR蛋白仍具有Harpin蛋白的活性,能诱导植物产生HR反应,这些结果表明,HrpNEccPR蛋白能够提高植物本身的免疫机能,诱导植物对胁迫环境产生抗性。Harpin蛋白主要来源于革兰氏阴性植物病原细菌,在梨火疫欧文氏杆菌和胡萝卜软腐欧文氏菌中也存在Harpin蛋白表达基因,张珏等[20]报道了HarpinCSDS001诱导植物抗性、促进植物生长发育的作用机制,曹茂林等[27]报道了胡萝卜欧文氏菌CSSY002表达的Harpin蛋白生物学活性,Kariola等[28]报道,胡萝卜软腐欧文氏菌胡萝卜亚种细菌产生的Harpin蛋白能够诱导拟南芥的防卫反应。HrpNEccPR蛋白是胡萝卜软腐欧文氏菌Ecc36菌株表达的蛋白激发子,它能诱导植物产生免疫反应,使植物发生过敏坏死反应,笔者正在通过室内和田间试验研究HrpNEccPR蛋白的抗病性、抗虫性、抗逆性、促进生长和发育等特性。希望通过这一系列的基础和应用研究,能将HrpNEccPR蛋白开发成新型、安全、高效的植物诱抗剂,使HrpNEccPR蛋白在未来的农业高新生物技术领域中扮演重要角色。
利用烟草验证了胡萝卜软腐欧文氏菌Ecc36菌株能够引起过敏反应(HR),克隆了Ecc36菌株的hrpN基因(hrpNEccPR基因)的开放阅读框,通过基因测序和比对,与其他软腐欧文氏菌Harpin蛋白有较高的同源性,表明hrpNEccPR基因表达的蛋白具有Harpin蛋白特性。构建hrpNEccPR基因表达载体(pET30a-EccPR),并获得表达HrpNEccPR蛋白大肠杆菌工程菌,诱导获得的HrpNEccPR蛋白纯化后,具有激发植物免疫反应的生物活性。
参考文献:
[1] 罗树凯,梁虎军,陈 婧,等. 3种植物生长调节剂、免疫诱抗剂对促进棉花生长的效果[J]. 中国棉花,2016,43(3):24-26.
[2] Dong Y,Li P,Zhang C. Harpin Hpa1 promotes flower development inImpatiensandParochetusplants[J].Botanical Studies,2016,57:22.
[3] Tristan B,Sabrina S,Claude P,et al. The HrpN effector ofErwiniaamylovora,which is involved in type Ⅲ translocation,contributes directly or indirectly to callose elicitation on apple leaves[J]. Molecular Plant-Microbe Interactions,2011,24 (5):577-584.
[4] Kong X,Li D. Hydrogen peroxide is not involved in HrpN fromErwiniaamylovora-induced hypersensitive cell death in maize leaves[J]. Plant Cell Reports,2011,30(7):1273-1279.
[6] Zhang H J,Teng W J,Liang J A,et al. MADS1,a novel MADS-box protein,is involved in the response ofNicotianabenthamianato bacterial harpin(Xoo)[J]. Journal of Experimental Botany,2016,67(1):131-141.
[7] Liu H,Wang Y,Zhou X,Wang C,et al. Overexpression of a harpin-encoding genepopWfromRalstoniasolanacearumprimed antioxidant defenses with enhanced drought tolerance in tobacco plants[J]. Plant Cell Rep,2016,35(6):1333-1344.
[8] He S Y,Nomura K,Whittam T S. Type Ⅲ protein secretion mechanism in mammalian and plant pathogens[J]. Biochim Biophys Acta,2014,1694(1-3):181-206.
[9] 王 欢,田沂民,董汉松. 水稻水通道蛋白OsPIP1;3与白叶枯病菌harpin蛋白Hpa1互作关系研究[J]. 植物生理学报,2016,52(8):1223-1230.
[10] 李 芳,陈建明,陈忠其,等. 植物免疫诱抗剂对番茄灰霉病和早疫病的抑菌效果[J]. 农药,2016,55(3):214-216.
[11] Aljaafri W A,Mcneece B T,Lawaju B R,et al. A harpin elicitor induces the expression of a coiled-coil nucleotide binding leucine rich repeat (CC-NB-LRR) defense signaling gene and others functioning during defense to parasitic nematodes[J]. Plant Physiology and Biochemistry,2017,121:161-175.
[12] Lindgren P B,Peet R C,Panopoulos N J. Gene cluster ofPseudomonassyringaepv.phaseolicolacontrols pathogenicity of bean plants and hypersensitivity on nonhost plants[J]. Journal of Bacteriology,1986,168(2):512-522.
[13] Wei Z M,Laby R J,Zumoff C H,et al. Harpin,elicitor of hypersensitive response produced by the plant pathogen[J]. Erwinia amylovora Science,1992,257(5066):85-88.
[14] Delaney T,Ukness S,Vernooij B,et al. A control role of salicylic acid in plant disease resistence[J]. Science,1994,266(5188):1274-1250.
[15] Cui Y,Chatterjee A,Liu Y,et al. Identification of a global repressor gene,rsmA,ofErwiniacarotovorasubsp.carotovrathat controls extracellular enzymers,N-(3-Oxohexanoyl)-L-Homoserine lactone,and pathogenicity in Soft-RottingErwiniaspp. [J]. Journal of Bacteriology,1995,177(17):5108-5115.
[16] Dimlioglu G,Das Z A,Bor M,et al. The impact of GABA in harpin-elicited biotic stress responses inNicotianatabaccum[J]. Journal of Plant Physiology,2015,188:51-57.
[17] Cui Y,Madi L,Mukherjee A,et al. The RsmA-mutants ofErwiniacarotovorasubsp.Carotovorastrain Ecc71 overexpresshrpNEccand elicit a hypersensitive reaction-like response in tobacco leaves[J]. Molecular Plant-Microbe Interaction,1996,9(7):565-573.
[18] 周长发,张 锐,张 晓,等. 地高辛随机引物法标记探针的Southern杂交技术优化[J]. 中国农业科技导报,2009,11(4):123-128.
[19] Cui Y,Mukherjee A,Dumenyo C K,et al. rsmC of the soft-rotting bacteriumErwiniacarotovorasubsp.carotovoranegatively controls extracellular enzyme and harpin(Ecc)production and virulence by modulating levels of regulatory RNA(rsmB)and RNA-binding protein(RsmA)[J].Journal Bacteriology,1999,181(19):6042-6052.
[20] 张 珏,曹茂林,黄玉碧,等.HrpNCSDS001基因克隆及其表达产物诱导拟南芥基因表达谱变化的研究[J]. 遗传,2007,29(5):629-636.
[21] 萨姆布鲁克J,拉塞尔 D W.分子克隆实验指南[M]. 3版. 北京:科学出版社,2005.
[22] 林燕燕,陶宗娅,崔亚亚,等. EcbCSL101菌株hrpN基因的克隆、表达及HarpinEcbCSL101蛋白的生物学活性[J]. 微生物学通报,2008,35(6):888-892.
[23] Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature,1970,227(5259):680-685.
[24] Chatterjee A K,Dumenyo C K,Liu Y,et al. Erwinia:genetics of pathogenicity factors[J]. Academic Press,2015,2(6):236-260.
[25] Chang X,Seo M,Takebayashi Y,et al. Jasmonates are induced by the PAMP flg22 but not the cell death-inducing elicitor Harpin inVitisrupestris[J]. Protoplasma,2017,254(1):271-283.
[26] Cui Y,Chatterjee A,Chatterjee A K. Effects of the twocomponent system comprising GacA and GacS ofErwiniacarotovorasubsp.carotovraon the production of global regulatory rsmB RNA,extracellular enzymes,and HarpinEcc[J]. Mol Plant Microbe Interact,2001,14(4):516-526.
[27] 曹茂林,张 珏,汤 承,等. 胡萝卜软腐欧文氏菌CSSY002菌株hrpN基因的克隆、鉴定及其表达产物Harpin蛋白的活性分析[J]. 应用与环境生物学报,2007,13(2):161-165.
[28] Kariola T,Palomaki T A,Brader G,et al.Erwiniacarolavorasub sp.carotovoraand Erwinia-derived elicitors HrpN and PehA trigger distinct but interacting defense responses and cell death inArabidopsis[J]. Mol plant-Microbe Interact,2003,16(3):179-187.

