动力电池电解液用添加剂的研究进展
张晓妍,任宇飞,高 洁,张 兰,张海涛
动力电池电解液用添加剂的研究进展
张晓妍,任宇飞,高 洁,张 兰,张海涛
(中国科学院过程工程研究所,北京 100190)
动力电池是新能源汽车的核心部件,而电解液是制约动力电池发展的关键。电解液一般由碳酸酯类溶剂、锂盐和添加剂组成,其性质对电池的高低温、倍率、寿命等性能有显著影响。高比能动力电池所需电解液的主要开发策略是利用功能添加剂在电池正、负极同时形成稳定的保护膜,同时稳定界面。文章回顾了近年来匹配高压正极材料和高容量硅碳负极材料所需添加剂的组成和基本功能,论述了添加剂作用机理和发展趋势,认为300 W·h/Kg高能量密度电池电解液的关键在于开发新型多功能添加剂。
锂离子电池;电解液;添加剂;SEI膜
截至2017年中国的原油进口率已超65%,同时,中国汽车保有量已达2.17亿台,汽车用油占原油总消耗量的比例高达55%,大城市PM2.5排放中有25%来自汽车。使用传统燃油车不但给环境造成极大负担,还对国家能源安全造成重大威胁。基于此,中国开始加大新能源汽车的发展力度。2016年发布的“节能与新能源汽车技术路线图”[1],提出汽车百公里油耗需由2015年的7.97 L降至2030年的3.2 L,发展混合动力和纯电动汽车是实现这些目标的必由之路。基于此,中国“十三五”期间布局的国家重点研发计划拟在新能源汽车专项上投入28亿,以保障动力电池的能量密度在2020年实现300 W·h/kg的目标。
动力电池是电动汽车的关键部件,其性能直接决定了电动车的续航里程、环境适应性等关键参数。当前主流动力电池为锂离子电池,虽然相对其它类型电池其具有能量密度高、体积小、无记忆效应、循环寿命长等优点[2],但仍然存在续航里程不足的问题。锂离子电池也被称作为摇椅电池,其充放电过程是锂离子通过电解液在正极和负极之间的运动过程[3]。电极材料决定了电池的能量密度,而电解液基本决定了电池的循环、高低温和安全性能[4]。要实现300 W·h/kg的目标,目前普遍认为在技术上比较可行的路线[5]是正极采用具有较高脱/嵌锂电位的高镍三元材料(NCM)或者层状富锂锰基材料(LLO),负极采用高比容量硅碳材料。随着材料与电池工艺的日趋成熟,这些新材料的应用在更大程度依赖于电解液性能的提升[6],以LLO为例,其材料结构特征决定其首次充电电压要达到4.8 V左右才能激活全部容量,而一般电解液在4.3 V以上即出现明显的氧化分解,这就对电解液技术提出了更大的挑战。
如图1所示,锂离子电池电解液主要由锂盐、溶剂和添加剂三类物质组成。过去15年中电解液的基本构成变化不大,创新主要体现在对新型锂盐和新型添加剂的开发,以及锂离子电池中涉及的界面化学过程及机理深入理解等方面[6]。考虑到成本及现有电池制备工艺等因素,由碳酸酯类和LiPF6组成的液态电解质在未来至少5年内仍将是动力电池的首选。KANG等[6]指出电解液未来的主要发展方向是开发匹配高电压正极的电解液,同时兼顾高容量硅碳负极,避免硅负极在循环过程中体积膨胀带来的固体电解质膜(SEI膜)反复破裂、再生导致的电解液过量消耗等问题。添加剂是电解液的价值核心,其对电解液的浸润性、阻燃性能、成膜性能等均有显著的影响,也是高性能电解液开发的关键。
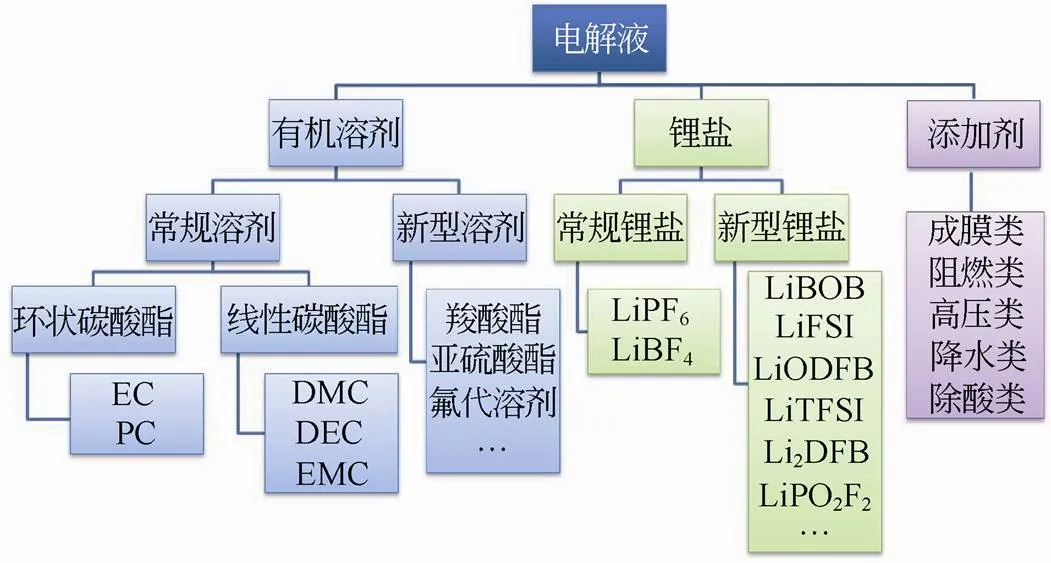
图1 电解液主要组成结构图
随着电动汽车市场的快速扩大,对高能量密度电池的需求持续激增,业界对新型添加剂的设计、合成及其作用机理研究也在逐渐增多。如图2所示,Web of Science数据库检索到的高压电解液及其添加剂方面的论文自2012年起开始快速增多。此外,硅碳电极用电解液及专用添加剂的研究论文自2010年起也呈现稳步增加的趋势。
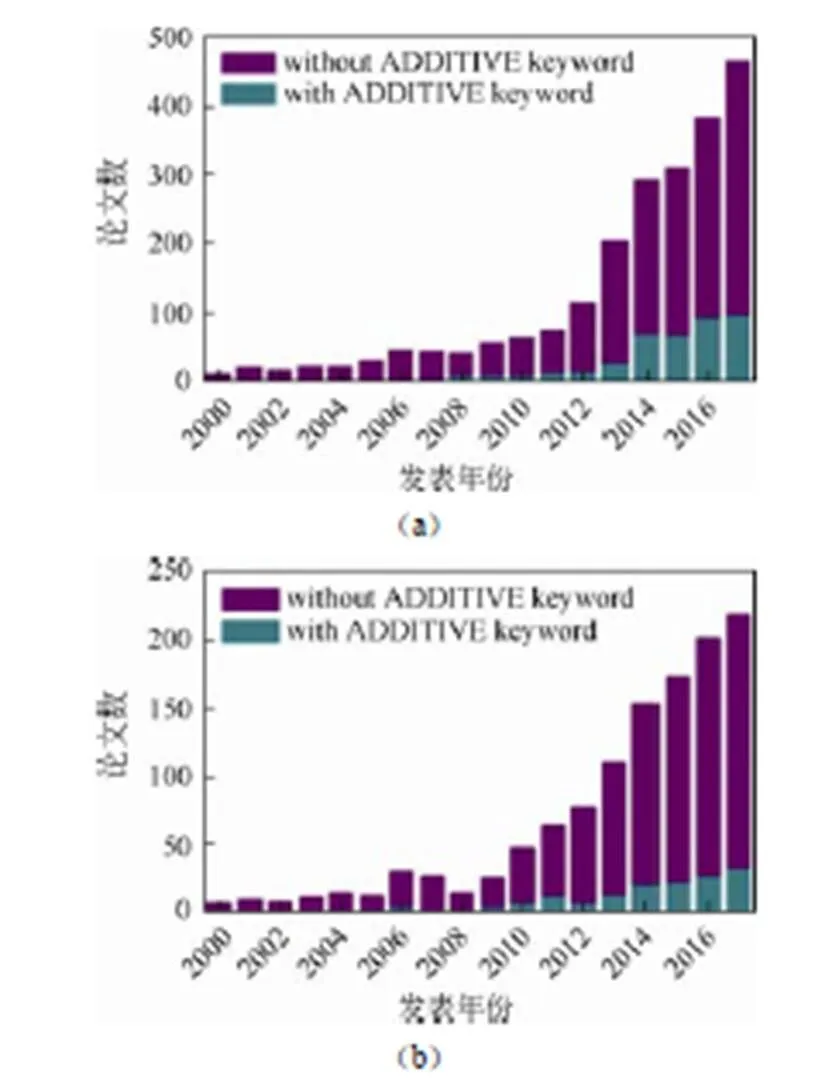
图2 Web of Science数据库对高压及硅负极电解液及采用添加剂的论文检索结果:(a)采用High voltage electrolyte + Lithium ion battery关键词,(b)采用Silicon anode + electrolyte关键词检索结果
综上所述,添加剂作为电解液的关键材料,是实现高容量动力电池的关键因素之一。本文将简述近年来匹配高压正极材料和硅碳负极材料电解液用添加剂的研究进展,并展望未来添加剂的发展趋势。
1 高压正极材料用添加剂
随着混合动力和电动汽车的大规模商业化应 用[7-9],具有更高能量密度和功率密度锂离子动力电池的研发显得越来越重要[10]。LiCoPO4、LiNi0.5Mn1.5O4、Li[LiM1-x]O2(M=Co、Ni、Mn)等大比容量、高工作电压正极材料是提高电池能量密度的最直接途径。然而,一方面,较高电压下(4.3 VLi/Li+)正极材料表面活性高、电解液易发生氧化分解,引发胀气的同时也消耗了活性材料,导致电池性能劣化[11];另一方面,电解液的氧化产物易攻击正极材料中的过渡金属元素,致使其在循环过程中发生溶解,进一步导致材料结构被破坏,电池容量衰减。常用正极材料所面对的主要问题和挑战如表1所示。

表1 锂离子电池常用正极材料面临的主要问题和挑战[12]
采用功能性添加剂来稳定正极材料和电解液的界面是避免电解液分解、开发高压电解液的有效途径,其作用机理主要包括两类:①优先于溶剂分解,在正极材料表面形成正极电解质膜,抑制电解液进一步氧化;②本身不参与成膜,但具备除水、降酸的作用,可减少过渡金属离子的溶解,从而稳定电极/电解液界面、改善循环稳定性。目前文献中报道的添加剂种类繁多,缺乏统一的评价标准,本文对部分研究相对集中、机理研究较为深入的添加剂做一综述,希望能为高能量密度电池电解液的开发有所贡献。
1.1 功能性添加剂
功能性添加剂对于能量密度、功率密度和循环性能都具有重要作用。这些添加剂通常含有不饱和的官能团(如双键、三键、环状结构、苯基等),主要可划分为有机磷类、氮化物、氟化物、硫化物和含硼类等。下文将着重介绍几类可稳定正极材料表面和电解液界面的功能添加剂。
1.1.1 含磷类添加剂
含磷类添加剂主要作用机理是通过在电极表面优先氧化形成保护膜来抑制电解液的分解和过渡金属溶解[13]。
具有高工作电位(≈4.7VLi/Li+)、高理论比容量(148 mA·h/g)、高锂离子扩散动力学等优点的尖晶石型镍锰酸锂(LiNi0.5Mn1.5O4)被认为是下一代高能量密度/高功率密度锂离子电池中最具有竞争力的正极材料之一[14-18],但在其工作电压下普通碳酸酯溶剂会持续分解,并且电解液和电极中的痕量水与LiPF6作用产生的HF会加速过渡金属离子(Ni、Mn)的溶解,使得材料结构遭到破坏。SOON等[19]研究了系列磷类物质,包括三(2, 2, 2-三氟乙基)亚磷酸酯(TFEP)、三苯基亚磷酸酯(TPP)、三(三甲基硅基)亚磷酸酯(TMSP)以及亚磷酸三甲酯(TMP)作为LiNi0.5Mn1.5O4的稳定添加剂。这类添加剂的HOMO能量远高于EC、EMC、DEC等溶剂分子(图3),表明亚磷酸酯类添加剂可优先在正极表面发生氧化,形成富含P—O化合物的保护膜。
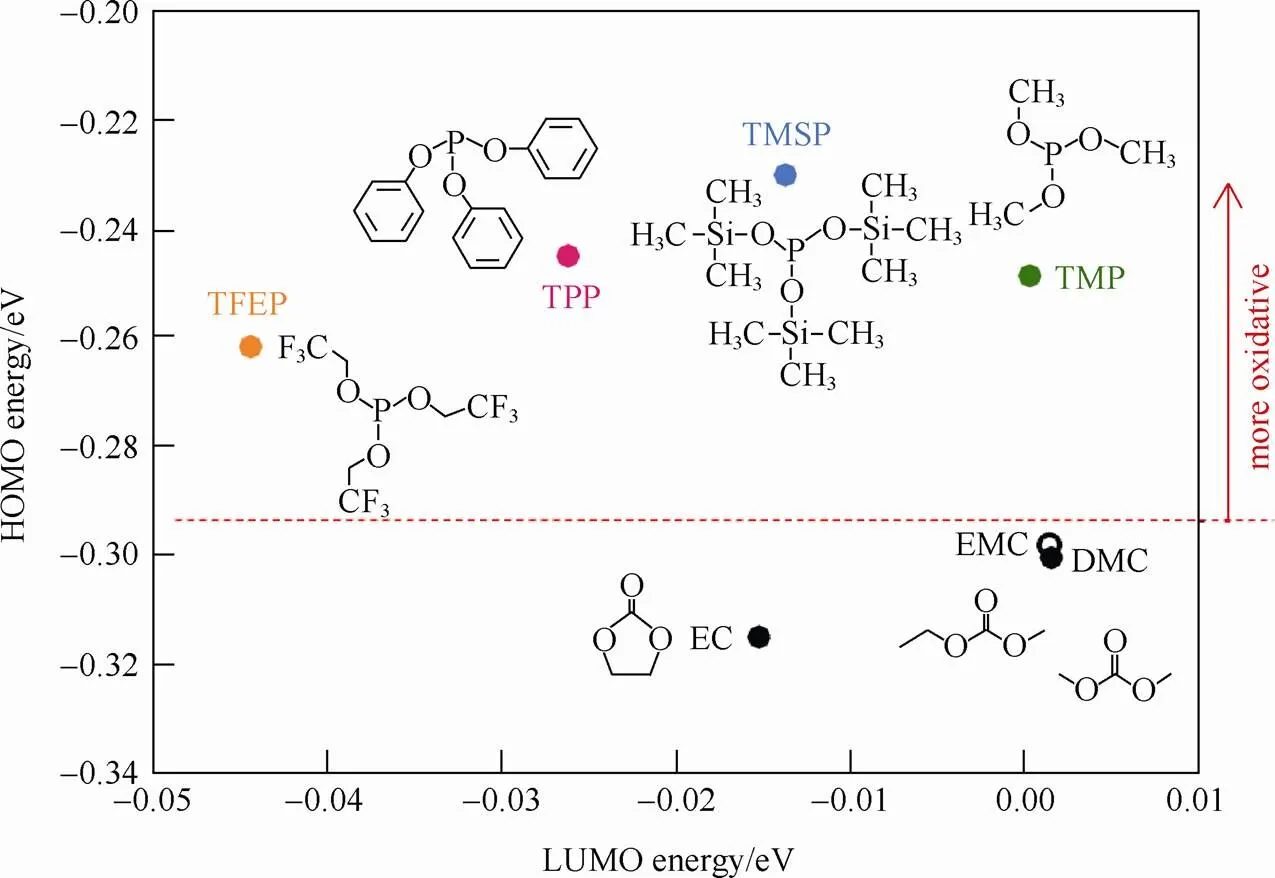
图3 TMP,TFEP,TPP,和TMSP与溶剂分子的HOMO/LUMO能量值[14]
在1.0 mol/L的LiPF6(EC/EMC/DMC=3/4/3,体积比)中分别加入0.5%(质量分数)的TMSP、TFEP、TMP、TPP添加剂。循环测试结果表明采用基础电解液的LiNi0.5Mn1.5O4/Li半电池在3.5~5.0 V电压区间、0.5C倍率、60 ℃高温条件下循环10次后库仑效率衰减严重,说明60 ℃高温循环基础电解液所形成的SEI膜不稳定,无法抑制电解液的持续分解。而加入0.5%的TMSP、TFEP、TMP添加剂的LiNi0.5Mn1.5O4/Li半电池循环140次容量保持率和库仑效率仍然处于稳定状态。研究表明这类添加剂的加入使得正极表面形成了电化学性能和热稳定性能更良好的SEI膜。
1.1.2 含硼类添加剂
常用含硼类添加剂包括三(三甲基硅烷)硼酸酯(TMSB)[20],二草酸硼酸锂(LiBOB)[21],硼酸三甲酯(TB)[22]等。这类添加剂在充放电循环过程中会对正极表面进行保护,通过提高电极/电解液间的界面稳定性来提高电池性能。
LLO材料具有电压窗口宽、比能量高(>200 mA·h/g)等优势,可提高电池能量密度[23-24]。然而在长循环过程中由于从层状结构到尖晶石结构的不可逆相变导致其无法保持高容量[24]。CHOI等[25]研究了含硼类添加剂—二氟草酸硼酸盐(LiDFOB)稳定LLO材料和电解液界面的作用机制。将1% (质量分数)的LiDFOB加入1.3 mol/L的LiPF6(EC/EMC/DMC为3/4/3,体积比)的基础电解液中可大大提升富锂材料和石墨的倍率性能。采用基础电解液在25℃,0.5 C倍率条件下循环100周容量保持率只有45.8%,而用含LiDFOB添加剂电解液容量保持率可达82.7%。研究表明LiDFOB在LLO材料表面生成含少量LiF的表面膜,其对正极材料表面SEI膜的修饰为电极-电解液界面提供了有效的电子和离子传输通道,可减少过渡金属的溶解,抑制不可逆相变,有效保留LLO材料的电化学性能,从而实现对高压LLO/石墨电池循环性能的有效改善。
1.1.3 硅氧烷类添加剂
硅氧烷类添加剂可通过选择性去除HF来作为高镍层状材料的界面稳定添加剂。随着锂离子电池能量密度的提升,高镍正极材料(LiNiCoMnO2,≥0.6, NCM)受到了广泛关注。因为Ni4+的电化学电势比Co4+低,所以增加层状结构中Ni的含量不仅可以提高NCM正极材料的比容量,还有助于降低材料成本[26]。当Ni含量增加至80%时,其比容量可提升至180 mA·h/g,但随着Ni含量的提升高镍材料的表面稳定性变差,电解液分解产生HF的化学反应急剧加速,HF侵蚀高镍NCM材料使得过渡金属元素溶解,导致电池循环性能变差。因此控制HF的浓度是提高锂离子电池电化学性能的重要途径之一。YIM等[27]报道了甲硅烷基化的二甲基二甲氧基硅烷(DODSi)对高镍正极材料电化学性能的影响。为了更清楚的阐明DODSi在清除HF上的作用,采用水分为1000 ppm(1 ppm=10-6mg/g)的电解液(目的是可原位产生HF)进行电池装配。实验结果表明加入1.0%的DODSi添加剂可提高NCM811半电池首次放电比容量,且循环100次容量保持率由普通电解液的38.0%提升至70.5%。以上结果表明使用可去除HF的添加剂DODSi是提高NCM811电化学性能的有效方法。其去除HF的反应机理来自DODSi中硅氧烷官能团(Si—O),O原子上的孤对电子容易和H+发生化学反应,Si对F具有较强的亲和力,可与F-反应[28-29]。O和H+、Si和F-配对的化学反应可清除电解液中的HF,减少HF对材料表面的侵蚀及抑制过渡金属溶解,从而使高镍正极材料表面稳定性得到改善。
1.2 添加剂的协同作用
单一功能性添加剂可以赋予电池某一特定功能,但同时可能会对其它性能产生不利影响。多种添加剂的混合使用所产生的协同作用,是改善这种情况的有效途径。
CUI等[30]研究了两种功能添加剂(三甲基硅基)亚磷酸盐(TMSP)和1,3-丙二醇环硫酸酯(PCS)的协同作用,发现它们可改善LiNi0.5Mn1.5O4/MCMB电池的常温及高温循环性能。在碳酸酯电解液中加入1%的TMSP和1%的PCS添加剂,充电至4.9 V,LiNi0.5Mn1.5O4/MCMB全电池常温0.5 C循环500次容量保持率为79.5%。两者作用机制如图4所示:TMSP具有较高的HOMO能量和较低的LUMO能量,根据分子轨道理论,其在正负极表面都可以优先分解,在正负极表面形成P—O化合物。LUMO能量较低的PCS可优先于溶剂分子在负极表面还原,形成亚硫酸类化合物,其中一些亚硫酸类化合物会迁移至正极表面被氧化生成烷基硫化物和硫酸盐类,又迁回负极表面至平衡状态,故正负极表面均有PCS的分解产物。TMSP和PCS的分解产物均参与正负极成膜,其协同作用所形成的正负极表面SEI膜具有高稳定性和高导电性,可有效抑制电解液的进一步氧化还原分解。特别是TMSP添加剂同时可稳定LiPF6,清除具有腐蚀作用的HF,从而抑制过渡金属离子的溶解。
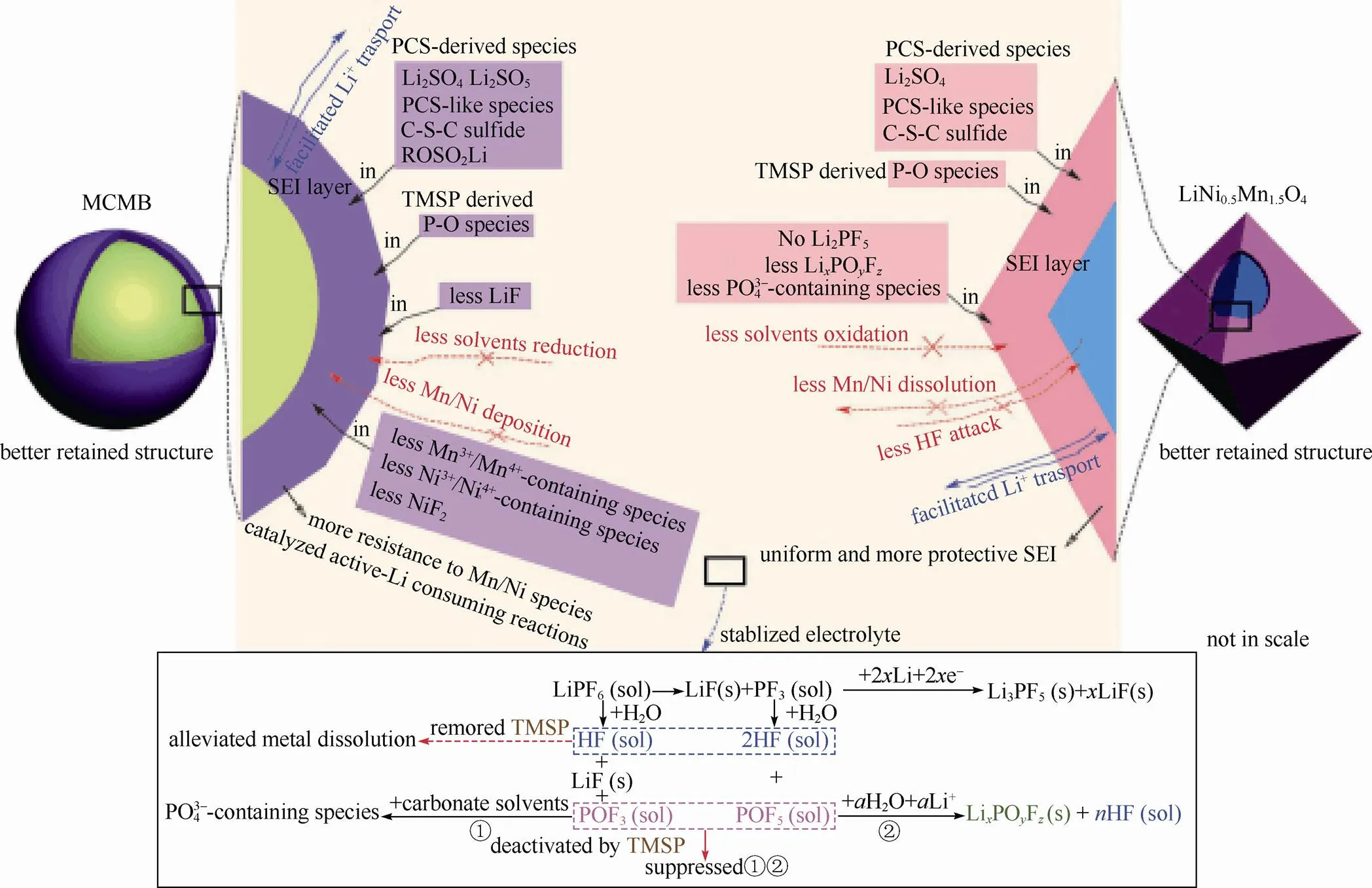
图4 TMSP和PCS添加剂的可能作用机制[30]
LiBOB是一种可在正极表面形成保护膜的添加剂,可减少Li1.2Ni0.15Mn0.55Co0.1O2/ 石墨电池的容量损失,但会在循环过程中增大电池的内阻。其增大电池内阻的缺陷可通过与三苯胺(Ph3N)或1,4-苯并二烷-6,7-二醇(BDOD)的联用来解决[31]。Ph3N和BDOD具有较低的氧化电位,可通过电化学聚合过程在正极表面形成导电聚合物保护正极,但当Ph3N或BDOD单独作用时并不能抑制电池循环性能衰减。采用LiDFOB和LiBOB添加剂协同作用同样可以提高Li1.2Ni0.15Mn0.55Co0.1O2/石墨电池的性能,降低正极阻抗。LiDFOB的氧化产物可钝化电极材料表面,阻止电解液的分解,减少过渡金属的溶解,进而降低阻抗[32]。
1.3 特殊分子结构添加剂
使用混合添加剂产生协同作用是弥补一种添加剂带来缺陷或增加新功能的有效方法,但从有机化学的角度分析,添加剂的选择应以分子为中心,寻找或设计可优先在电极表面进行化学反应或可以发生特定电化学反应的官能团,从而使该特殊分子结构具有多种添加剂的作用。ZHANG等[33]设计合成了一类基于环状氟化磷酸酯基的添加剂(TFEOP、PFPOP、HFiPOP)。该类添加剂的设计合并了现有的各种添加剂的功能,使其利用率实现最大化。在1.2 mol/L LiPF6的(EC/EMC为3/7)电解液中加入1.0%的TFEOP添加剂,LiNi0.5Mn0.3Co0.2O2(NMC532)/石墨电池容量保持率得到较大提升。XPS和NMR的结果表明,当充电电位高于4.6 V(Li+/Li),该类添加剂可通过自牺牲式的聚合反应在正极表面形成一层钝化膜,抑制电极/电解液反应,从而稳定界面。其作用机制为该添加剂中五元环P==O结构中的P和过渡金属表面的羟基由于亲核反应形成P—O键,随后经过质子转移形成一个质子化的中间产物。这种不稳定的中间产物经过另一个质子转移过程,后续经过开环聚合反应在材料表面形成良好的聚磷酸酯保护膜,且其中的—O—CH2—CH2—O—基团由于对Li+良好的亲和作用而提供了较高的离子电导率,同时避免了电解液与电极材料的直接接触,从而改善循环稳定性(图5)。值得注意的是—CF3吸电子取代基的存在使得环状磷酸酯中的P==O与未氟化的环状磷酸盐相比更易于发生亲核加成反应。这类同时含有五元环,氟化取代基和磷酸官能团的添加剂表明一个功能化选择原理,即将各种有用的官能团合并到一个分子中,这是一种发展新型添加剂的有效方法。
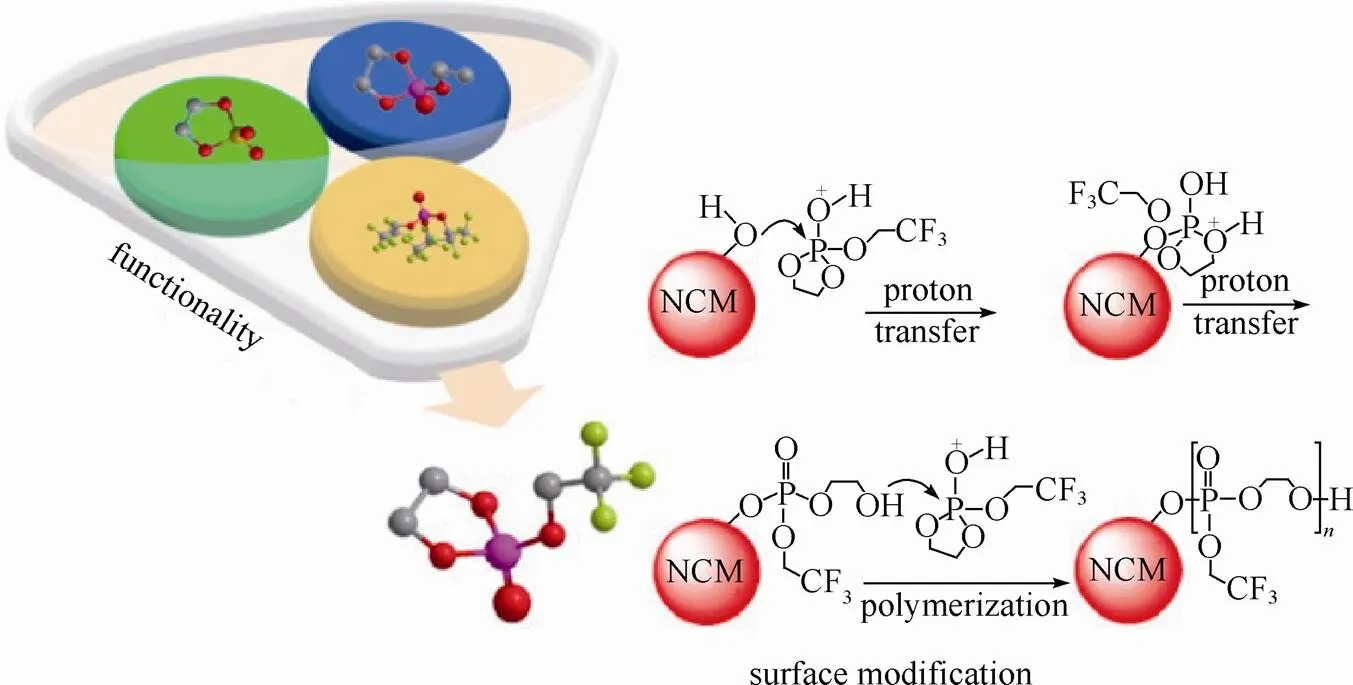
图5 TFEOP聚合作用形成正极钝化层的机理[33]
LLO材料和电解液的界面稳定性差,碳酸酯基电解液在较高工作电压下分解产生的HF腐蚀LLO材料表面,从而导致循环稳定性差。稳定的界面膜是提升LLO材料循环性能的有效途径之一。由于界面膜的成分主要由添加剂的分解产物组成,因此添加剂的分子结构将决定界面膜的物理化学稳定性和离子电导率。LI等[34]通过使用苯基乙烯基砜(PVS)这种具有特殊分子结构的添加剂在LLO材料表面构筑一层保护膜可避免电解液和电极材料的直接接触。在1.0 mol/L的LiPF6(EC/EMC/DEC为3/5/2,质量比)电解液中加入1.0%的PVS添加剂,Li(Li0.2Mn0.54Ni0.13Co0.13)O2(LR-NCM)电极0.5 C循环240次容量保持率将近80%,远远高于不含PVS的电解液(18%)(图6)。这种优良的性能得益于PVS特殊的分子结构。PVS中同时含有碳碳双键、芳香环和含硫官能团,碳碳双键赋予其优先氧化特性[35],芳香环由于稳定的化学结构确保界面膜的化学稳定性,硫可改善界面膜的离子电导率。这些官能团的存在使得PVS成为LLO材料最有效的添加剂之一。
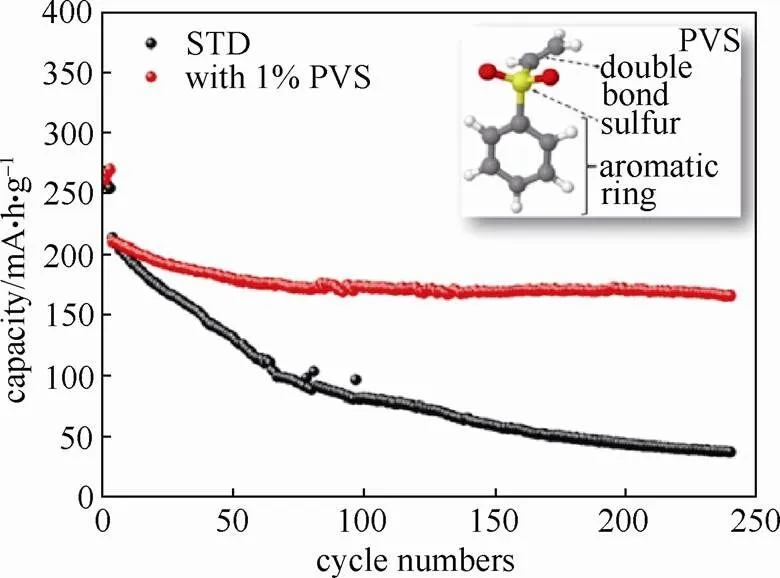
图6 LR-NCM在普通电解液(STD)以及含PVS添加剂电解液(加入1%PVS)中的循环性能(插图为PVS结构示意图)[34]
LIM等[36]采用三甲基硅基甲烷磺酸盐(TMSOMs)作为表面稳定添加剂,可改善LLO的电化学性能。含TMSOMs添加剂的LLO/石墨扣式全电池常温循环100次容量保持率为89.1%,不含添加剂的 电池循环100次容量保持率仅为51.9%(图7)。另外,含TMSOMs添加剂的电池呈现出优异的高温(60℃)电化学存储性能,其自放电行为也明显减弱,这与添加剂的加入提高了LLO电极材料界面稳定性有关。TMSOMs由—SO3—和—O—Si—官能团组成(图7)。硫酸酯可在LLO材料表面产生稳定的保护层,缓解电解液的大量氧化分解[37-42]。亲核的F-可以和亲电子的过渡金属发生化学反应加速正极材料的裂变,而Si对F有很强的亲和性,—O—Si—可清除电解液中的F-,从而减少F-与过渡金属(Ni、Co、Mn)氧化物的反应[43-47]。TMSOMs添加剂中包含的—SO3和—O—Si—两种不同功能的官能团显著提高了LLO电极材料整体的界面稳定性,使其电化学性能更加稳定。
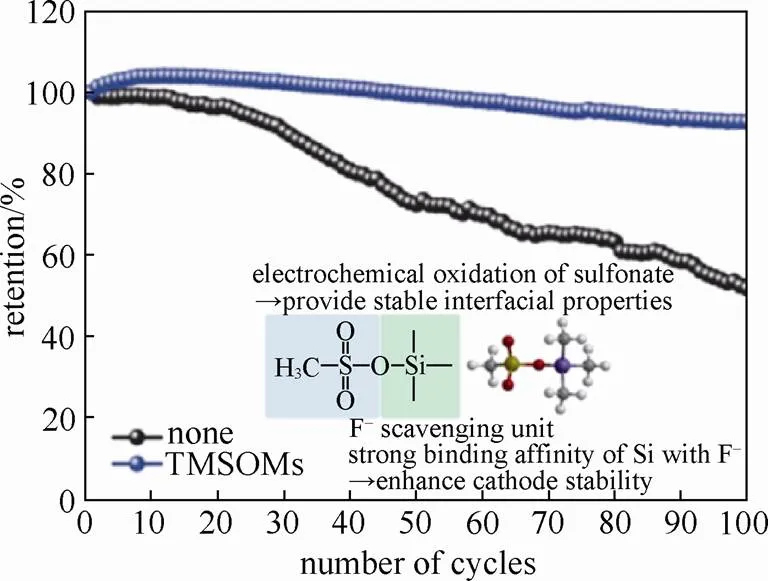
图7 TMSOMs对电池容量保持率的影响(插图为TMSOMs的结构及作用机制)[36]
2 负极材料用添加剂
单质硅由于具有理论比容量高、嵌脱锂电压低(约0.2 V)、价格优惠等特性而成为下一代锂离子电池首选的负极材料[48-49],但由于硅在嵌锂/脱锂过程中体积效应明显,电极在长期循环过程中易粉化、破碎、甚至从集流体脱落,循环性能较差[50-51]。目前主要解决措施包括将硅纳米化[52-53]、采用新型黏结剂[54]及与其它材料复合以缓解应变[55]等。以上几种方法一定程度上能够缓解硅体积膨胀而导致的负面影响,提高硅负极的循环稳定性和首效。此外,电解液对硅基电池的电化学性能也有极其重要的作用[56-57]。电解液在低电位下会被还原分解,并在负极表面形成SEI膜[58-59]。但硅负极在嵌锂/脱锂过程中持续的体积变化会导致SEI膜的不断破裂、再生,一方面会大量消耗电解液,另一方面也会增加电池阻抗,抑制Li+向活性材料的扩散,导致电池的循环稳定性能变差[60-61]。因此,在电极表面构造高质量的SEI膜是提高硅碳负极性能的关键,添加剂在不同电位下优先于电解液溶剂发生还原分解,产生的分解产物在电极表面组成SEI膜[58,62-63]。因此,添加剂是促进优异SEI膜形成的关键。
图8中呈现了部分常见负极电解液添加剂的分子结构:分别是氟代碳酸亚乙烯酯(FEC)、碳酸亚乙烯酯(VC)、丙烯基-1,3-丙磺酸内酯(PES)、亚硫酸乙二烯酯(PS)、1, 3, 2-二氧硫杂环戊烷-2, 2-二氧化物(DTD)、环丙烷硫酸(TMS)、亚硫酸丙烯酯(PS)和亚甲基甲烷二磺酸盐(MMDS)。下文着重介绍含硫添加剂及FEC的作用机理。

图8 几种常见的负极电解液添加剂的结构
2.1 含硫添加剂
LEGGESSE等[64]研究了乙烯基亚硫酸乙烯酯(VES)的还原分解机制及成膜稳定性,VES是ES的衍生物,理论计算结果表明VES与ES相比具有较高的还原电位(表2),与电子的亲和性比PC大,所以VES分子会在负极表面优先还原生成由Li2SO3、CH2(OSO2Li)2CHCH2和CH3CH(OSO2Li)2CH2OCO2Li组成的SEI膜,从而提高电池的循环性能。表2中列出了VES、ES和PC的理论计算与实验的还原电位。
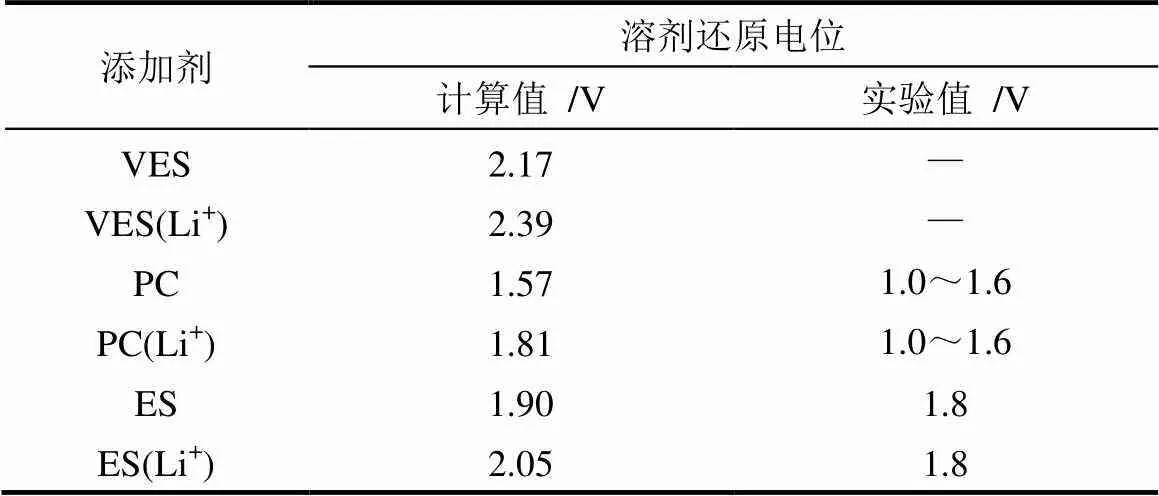
表2 VES、ES和PC的理论计算与实验的还原电位[64]
LI等[65]的理论计算表明PES的LUMO能级比PS或PC的更低,表明PES比PS或PC更易在负极还原,从而能更有效地抑制PC共嵌入石墨负极。实验表明在PC基电解液中使用PES比使用PS能呈现出更小的容量损失和更好的循环稳定性。图9是PES可能的反应路线。首先PES与Li+相作用生成(A),(A)在电子作用下开环形成烷基磺酸盐自由基(B),中间产物(B)可进一步分解为Li2SO3和炔烃气体,也可能经历若干其它反应得到(D)、(E)、(F)等其它产物。
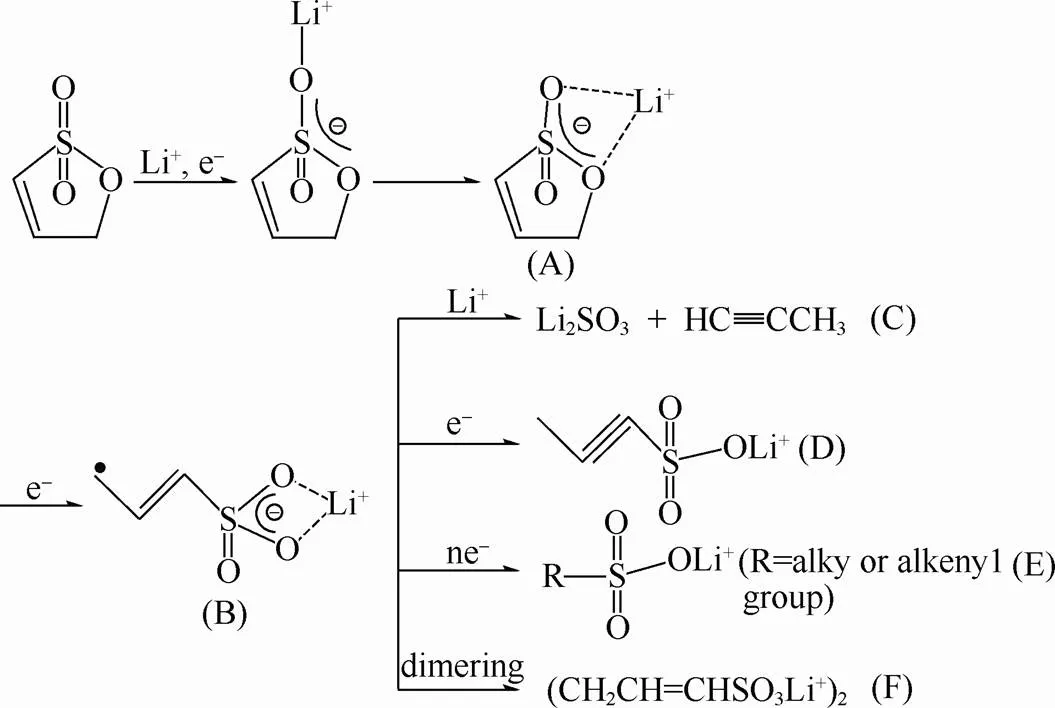
图9 PES在石墨负极表面可能的反应路线[65]
2.2 含氟添加剂
FEC作为添加剂被广泛研究,该添加剂也可用于硅电极,并有效提升其循环性能[66]。尽管如此,关于FEC的分解机理和获得的SEI膜组分仍有很大争议。一些研究[62,67]报道FEC脱掉一个氟后可形成VC和HF,认为形成高性能SEI膜的关键是由于这些添加剂分解成为半碳酸盐或有机物[68]。理论计算表明,FEC和VC能产生类似的还原产物[69],而对应SEI膜之间的差异主要在于LiF,因为LiF是FEC存在时SEI膜的主要成分之一[70]。另外,实现性能提高所需添加剂的浓度也是不同的,一些研究使用的FEC浓度高达50%[71]。
由于SEI膜对空气极其敏感,厚度小于100 nm的SEI膜很难进行实验研究。为了在实验上验证还原产物,ALISON等[72]模拟了一个类似于锂离子电池中可能发生的还原过程来还原FEC和VC,通过NMR、XPS和FTIR等测试手段证实,两种添加剂形成的SEI膜中只是组分[如Li2CO3、Li2C2O4、HCO2Li、聚(VC)]的相对质量不同。可能的反应机理是:FEC首先还原形成LiF和VC,随后VC进一步还原聚合生成聚VC,聚VC包含了通过交联位点连接的EC重复单元。
分析结果证明在聚合物中没有F—C存在,HCO2Li、Li2C2O4和Li2CO3少量存在。对于VC所生成的SEI膜中除了聚(VC)之外,还检测到大量的Li2CO3、Li2C2O4及HCO2Li等含锂物质。
图10所示TANG等[62]通过XPS研究的Si/C电极循环后表面组成,发现表层中含有C、O、F、Li和P元素。可以看到4种电解液中生成的SEI膜各元素含量有明显的变化,电极表面含F的量随着FEC浓度的增加而增加。低浓度的C和高浓度的F表明锂盐在持续分解,在含2%的FEC的电解液中,有较高浓度的C和较低浓度的F,表明形成了稳定的SEI膜可抑制LiPF6的持续分解。
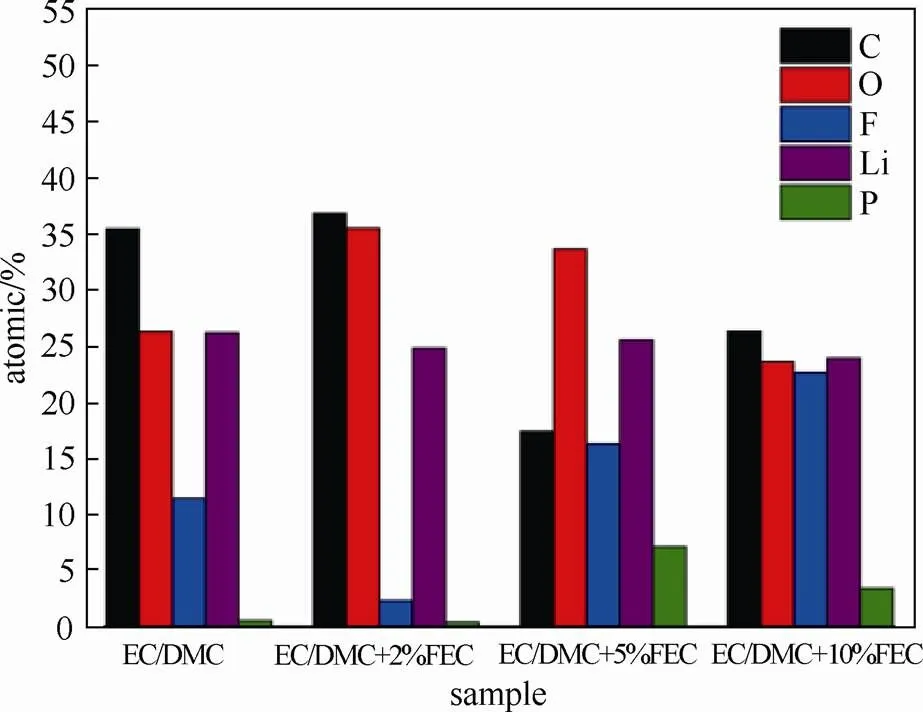
图10 不同浓度FEC的电解液循环50周后Si/C电极表面各元素的浓度分布[72]
GASTEIGER等[73]详细研究了FEC在硅碳复合电极表面成膜的机理。与其它文献报道的结果类似,电解液中加入适量FEC可抑制电解液组分的还原,显著改善了电池的循环稳定性。实验结果表明电池中的FEC一旦消耗完,电池容量就会急剧衰减,同时硅碳电极的极化程度加剧。研究发现容量快速衰减时所累积的不可逆容量与电池中FEC的量成线性关系。图11为FEC还原分解示意图,当1个FEC分子还原后会消耗4个电子并释放1个CO2分子,结合其它研究者所得到的结果,FEC分解的产物有CO2、LiF、Li2O、Li2CO3、H2和部分交联聚合物。
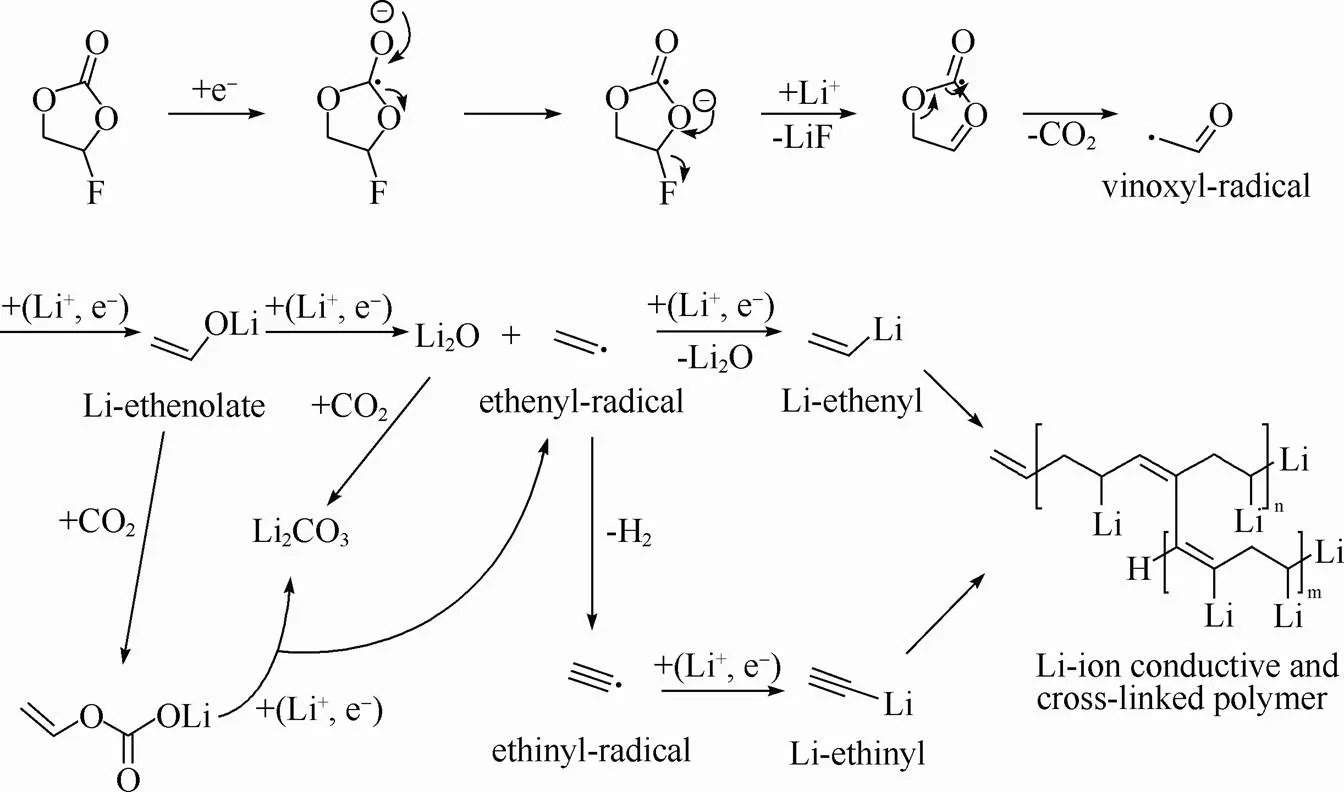
图11 FEC的还原分解机理示意图[73]
图12中为Si-Li半电池在含不同浓度FEC的电解液中的循环性能。含有75 μL和150 μL电解液的电池展现出两种不同的趋势,在同样浓度下,加入150 μL电解液的电池性能更好;而在浓度为1%和0% FEC两种电解液中,库仑效率和比容量较差,FEC的作用不明显,可能是最初在Si电极表面并没有形成较稳定的SEI膜。随着电解液中FEC含量的增加,可以看到库仑效率在提高,容量衰退也在减小,表明在Si电极表面逐渐形成了相对稳定的SEI膜,而在含20% FEC的电解液中没有观察到这种快速衰退的现象,这可能是在FEC消耗完之前就在Si电极表面形成了很厚的SEI膜,在FEC消失后对容量的影响较小,因此认为FEC的消耗是引起容量衰减的原因所在。XU等[74]通过比较硅负极半电池的循环性能和电极表面形貌来证明FEC的作用,发现在标准电解液中加入10%的FEC后,在硅电极表面形成了更均匀的SEI膜,较好地保留了电极原有形貌,减小了电极阻抗和极化,显著改善了电池的循环性能和库仑效率。此外利用PES技术分析了硅负极半电池首次充放电过程中在不同电压区间表面成膜的情况,发现在首次放电过程中,SEI膜的厚度会越来越厚,在充电过程中,SEI膜的厚度反而在减小,说明SEI膜的形成是一个动态的过程。生成的SEI膜成分主要为LiF、—CHF—OCO2、Li2O和碳酸类等化合物,其中Li2O存在于SEI膜的最内层,随着循环的增加SEI膜的厚度也会增厚。
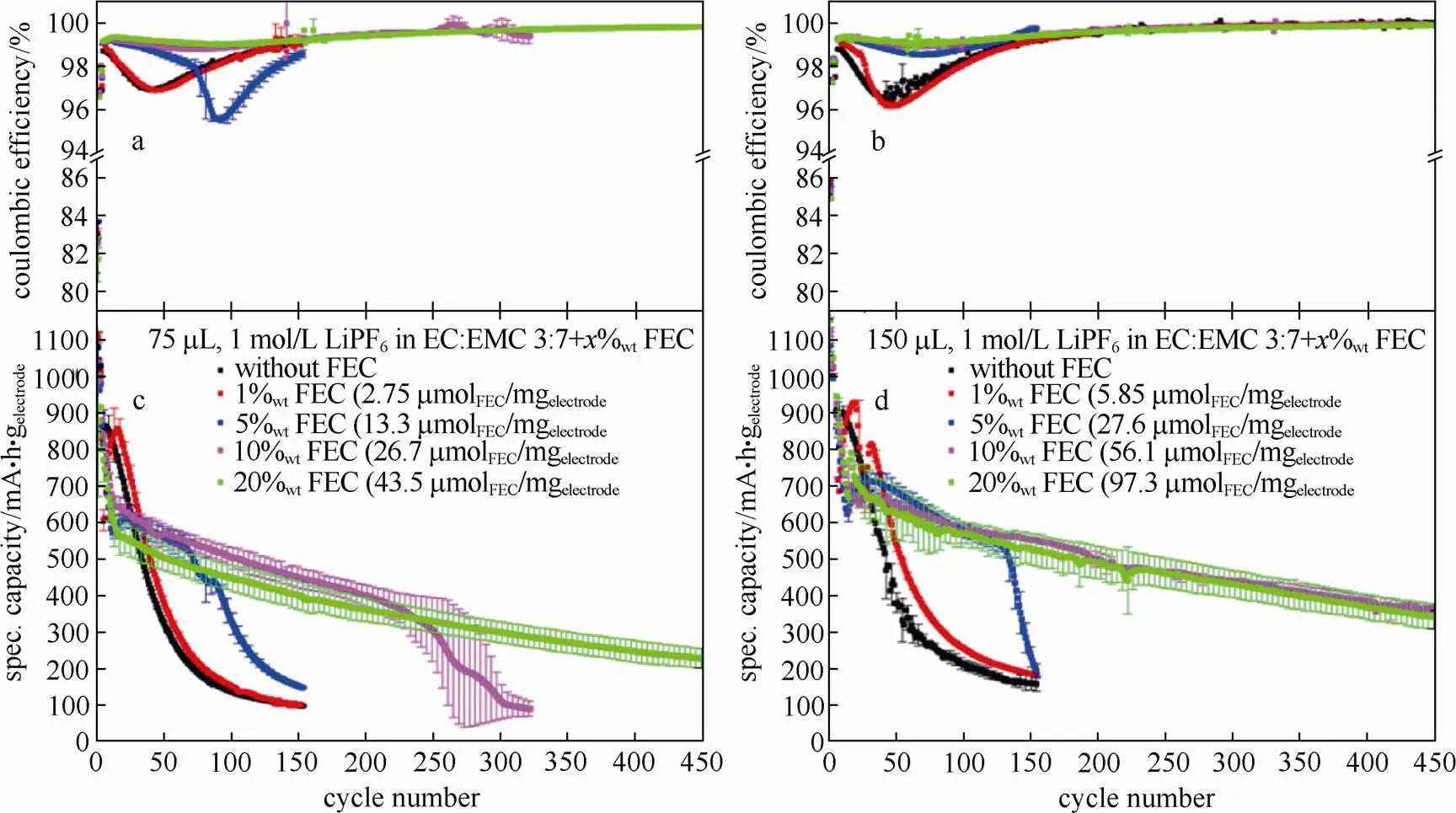
图12 SiC复合电极在含FEC浓度不同的电解液中的效率(a, b)和循环性能(c, d),电流密度:前3个循环为C/10,随后为C/3,电压范围:10 mV~1.2 V[74]
2.3 多种添加剂的协同作用
多种添加剂的混合使用可以解决单一添加剂所引起的问题。XIA等[75]和MADEC等[76]研究了ES和VC作为添加剂对电池性能的影响规律,发现单独使用ES时在循环过程中会产生大量气体。当1%的ES与2%的VC混合使用时,循环性能与单独使用VC类似,解决了由VC引起的阻抗上升和由ES产生气体的问题。这些结果表明ES可修复由VC在负极所制造的问题,VC可抑制ES产气,这是ES和VC协同作用的结果。
ZHANG等[77]研究了VC和PS共同作为添加剂对电池性能的影响。结果表明VC和PS都会优先于电解液溶剂发生还原反应,产生的还原产物在负极表面构成SEI膜,但是它们在负极表面形成的SEI膜结构不同,由VC还原形成的SEI膜含有聚VC,改善了SEI膜的稳定性;由PS形成的SEI膜含有烷基磺酸锂(RSO3Li),增强了SEI膜的导电性。当把VC和PS一起加入电解液中共同使用时,所构成的SEI膜同时具有高的导电性及热稳定性,同时还能减少在成膜期间产生的气体量,因此这两种添加剂的结合创造了一种具有优异性能的SEI膜。
3 其它类型添加剂
以上正负极添加剂的功能主要体现在成膜保护、消除HF等方面,除此之外添加剂的常用功能还有以下几个方面。①改善浸润性添加剂,如采用环己烷、癸酸甲酯[78]、乙酸十二酯[79]等来提高隔膜和电极的润湿性,增强电极材料的利用率,以满足越来越高的压实密度的需求;②低阻抗添加剂,如BDOD[31]、锂盐类添加剂LiDFOB[32]等来降低电池内阻;③阻燃添加剂,如甲基磷酸二甲酯(DMMP)[79]、TPP[80]、磷酸三丁酯(TBP)[80]等为锂离子电池提供优良的热安全性。
另外,值得注意的是锂离子电池的产气行为伴随着体积膨胀和性能衰退,是限制电池安全性能和寿命的关键问题之一[81-84]。常规碳酸酯基电解液分解的主要气体产物是C2H4、CO、CO2、CH4和C2H6等,EC基电解液的主要气体产物是由EC分解产生的C2H4和CO,FEC基电解液分解产物主要为CO2。采用γ-丁内酯(GBL)溶剂取代EC、FEC可有效抑制碳氢化合物及碳氧化合物的生成,增强锂离子电池的安全性能和电化学性能[85]。除了选用合适的溶剂外,添加剂也是抑制气体产生的重要途径。XIA等[86]研究了四种氟代碳酸酯类化合物,FEC、1,2-二氟碳酸乙烯酯(DiFEC)、二(2,2,2-三氟乙基)碳酸酯(TFEC)和2,2,3,4,4-六氟丁基碳酸甲酯(HFBMC)作为电解液添加剂在Li(Ni0.4Mn0.4Co0.2)O2/石墨软包电池中的产气问题。结果表明在4.2V、4.4V的超高精度充放电仪循环测试中含FEC和DiFEC添加剂的电池产气量最少。主要原因是FEC和DiFEC参与了负极表面成膜,SEI膜主要成分为LiF和Li2CO3等低聚化合物,可阻止痕量水和HF的分解、抑制更多的气体产生。与FEC添加剂相比加入2% DiFEC添加剂的电池在循环过程中的产气量最少,因此DiFEC是一个有效并可取代FEC的高压电解液用添加剂。另外在首次充放电过程中,含TFEC和HFBMC添加剂电池比普通电解液产气更多,说明添加剂的加入导致了产气。另外XIA等[87]还研究了三烯丙基磷酸酯(TAP)作为电解液添加剂抑制Li(Ni0.4Mn0.4Co0.2)O2/石墨软包电池的产气问题。实验表明TAP添加剂在正负极表面均可成膜,含TAP添加剂的电池在化成、循环和储存测试中与不含TAP添加剂相比有较少的气体析出。
4 结 语
添加剂是电解液的成本核心,也是提升其性能的关键。针对电动汽车对长寿命、高安全和高比能锂离子电池的需求,未来电解液添加剂的开发方向将主要体现在多功能性上。随着对添加剂作用认识的深入和技术的发展,未来添加剂的开发将具有以下趋势。
(1)原位分析表征技术的广泛采用:由于电池内部作用过程复杂、缺少原位分析工具,大部分添加剂的作用机理目前并无定论,因此未来需更多的分析技术来对电极/电解液界面反应过程进行更详细的原位研究以确定添加剂之间的协同机理。
(2)计算模拟方法与试验的紧密结合:目前添加剂的开发仍处于“trial and error”的阶段,缺乏理论指导、效率极低,未来应利用模拟计算等方式对添加剂进行筛选,同时建立一种添加剂评价标准,采用品质因子、高通量筛选等方式来统一评价添加剂及电解液是否适合该电池体系,从而进一步促进高比能锂离子电池的快速发展。
(3)电解液多种组分的协同作用:提高电解液性能的关键不仅仅取决于添加剂,在配方研制上还需引入新型锂盐、新型溶剂、离子液体等物质来协同地提高动力电池的安全性、比能量、循环寿命。
(4)与多种工艺技术的结合:针对硅碳负极体积效应明显、界面稳定性差等特点,还将采用新型黏结剂和预锂化技术来协同添加剂提高电池的综合性能。
[1] 节能与新能源汽车技术路线图战略咨询委员会, 中国汽车工程学会. 节能与新能源汽车技术路线图[M]. 北京: 机械工业出版社, 2016.
Energy Conservation and New Energy Vehicle Technology Roadmap Strategic Advisory Committee, Society of Automotive Engineers of China. Technology roadmap for energy saving and new energy vehicles[M]. Beijing: China Machine Press, 2016.
[2] 义夫正树, 拉尔夫・J.布拉德, 小泽昭弥, 等. 锂离子电池: 科学与技术[M]. 北京: 化学工业出版社, 2015.
YOSHIO M, BRODD R, KOZAWA A et al. Lithium-ion batteries, science and technologies[M]. Beijing: Chemical Industry Press, 2015.
[3] 吴娇杨, 刘品, 胡勇胜, 等. 锂离子电池和金属锂离子电池的能量密度计算[J]. 储能科学与技术, 2016, 5(4): 443-453.
WU J, LIU P, HU Y, et al. Calculation on energy densities of lithium ion batteries and metallic lithium ion batteries[J]. Energy Storage Science and Technology, 2016, 5(4): 443-453.
[4] 郑洪河. 锂离子电池电解质[M]. 北京:化学工业出版社, 2007.
ZHENG H. Electrolyte for lithium-ion battery[M]. Beijing: Chemical Industry Press, 2007.
[5] JOW T R, XU K, BORODIN M U. Electrolytes for lithium and lithium-ion batteries[M]. Berlin: Springer, 2014.
[6] U K. Electrolytes and interphases in Li-ion batteries and beyond[J]. Chem. Rev., 2014, 114(23): 11503-11618.
[7] TARASCON J M, ARMAND M. Issues and challenges facing rechargeable lithium batteries[J]. Nature, 2001, 414(6861): 359.
[8] ARMAND M, TARASCON J M. Building better batteries[J]. Nature, 2008, 451(7179): 652.
[9] GOODENOUGH J B, PARK K S. The Li-ion rechargeable battery: A perspective[J]. Journal of the American Chemical Society, 2013, 135(4): 1167.
[10] LIN F, MARKUS I M, NORDLUND D, et al. Surface reconstruction and chemical evolution of stoichiometric layered cathode materials for lithium-ion batteries[J]. Nature Communications, 2014, 5: 3529.
[11] ZHANG L, MA Y, DU C, et al. Research on the high-voltage electrolyte for lithium ion batteries[J]. Progress in Chemistry, 2014, 26(4): 553-559.
[12] HAREGEWOIN A M, WOTANGO A S, HWANG B J. Electrolyte additives for lithium ion battery electrodes: Progress and perspectives[J]. Energy & Environmental Science, 2016, 9(6): 1955-1988.
[13] YAN G, LI X, WANG Z, et al. Tris(trimethylsilyl)phosphate: A film-forming additive for high voltage cathode material in lithium-ion batteries[J]. Journal of Power Sources, 2014, 248(4): 1306-1311.
[14] KRAYTSBERG A A, EIN-ELI Y. A review of 5 volt cathode materials for advanced lithium-ion batteries[J]. Advanced Energy Materials, 2012, 2(8): 922-939.
[15] MEISTER P, JIA H, LI J, et al. Best practice: Performance and cost evaluation of lithium ion battery active materials with special emphasis on energy efficiency[J]. Chemistry of Materials, 2016, 28(20): 7203-7217.
[16] MANTHIRAM A, CHEMELEWSKI K, LEE E S. A perspective on the high-voltage LiNi0.5Mn1.5O4spinel cathode for lithium-ion batteries[J]. Energy & Environmental Science, 2014, 7(4): 1339-1350.
[17] YI T F, MEI J, ZHU Y R. Key strategies for enhancing the cycling stability and rate capacity of LiNi0.5Mn1.5O4as high-voltage cathode materials for high power lithium-ion batteries[J]. Journal of Power Sources, 2016, 316: 85-105.
[18] MA J, HU P, CUI G, et al. Surface and interface issues in spinel LiNi0.5Mn1.5O4: Insights into a potential cathode material for high energy density lithium ion batteries[J]. Chemistry of Materials, 2016, 47(31): 3578-3606.
[19] SONG Y M, KIM C K, KIM K E, et al. Exploiting chemically and electrochemically reactive phosphite derivatives for high-voltage spinel LiNi0.5Mn1.5O4cathodes[J]. Journal of Power Sources, 2016, 302: 30.
[20] LI J, XING L, ZHANG R, et al. Tris(trimethylsilyl)borate as an electrolyte additive for improving interfacial stability of high voltage layered lithium-rich oxide cathode/carbonate-based electrolyte[J]. Journal of Power Sources, 2015, 285: 360-366.
[21] XU M, TSIOUVARAS N, GARSUCH A, et al. Generation of cathode passivation films via oxidation of lithium bis(oxalato) borate on high voltage spinel (LiNi0.5Mn1.5O4)[J]. J. Phys. Chemc., 2012, 118(14): 7363-7368.
[22] WANG Z, XING L, LI J, et al. Trimethyl borate as an electrolyte additive for high potential layered cathode with concurrent improvement of rate capability and cyclic stability[J]. Electrochimica Acta, 2015, 184: 40-46.
[23] ROZIER P, TARASCON J M. Review-Li-rich layered oxide cathodes for nextgeneration Li-ion batteries: Chances and challenges[J]. Journal of the Electrochemistry Society, 2015, 162(14): A2490-A2499.
[24] YAN J H, LIU X B, LI B Y. Recent progress in Li-rich layered oxides as cathode materials for Li-ion batteries[J]. RSC Advances, 2014, 4(4): 63268-63284.
[25] CHA J, HAN J G, HWANG J, et al. Mechanisms for electrochemical performance enhancement by the salt-type electrolyte additive, lithium difluoro(oxalato)borate, in high-voltage lithium-ion batteries[J]. Journal of Power Sources, 2017, 357: 97-106.
[26] LIU W, OH P, LIU X, et al. Nickel-rich layered lithium transition-metal oxide for high-energy lithium-ion batteries[J]. Angewandte Chemie (International ed. in English), 2015, 46(26): 4440-4457.
[27] JANG S H, YIM T. Effect of silyl ether-functinoalized dimethoxydimethylsilane on electrochemical performance of a Ni-rich NCM cathode[J]. Chemphyschem : A European Journal of Chemical Physics and Physical Chemistry, 2017, 18(23): 3402-3406.
[28] WANG H, GE W, WANG F, et al. Facile fabrication of ethoxy-functional polysiloxane wrapped LiNi0.6Co0.2Mn0.2O2cathode with improved cycling performance for rechargeable Li-ion battery[J]. ACS Applied Materials Interfaces, 2016: 818439-18449.
[29] CAREY F A, SUNDBERG R J. Part A: Structure and mechanisms[M]. Advanced Organic Chemistry, 2009.
[30] XU G, PANG C, CHEN B, et al. Prescribing functional additives for treating the poor performances of high-voltage (5 V-class) LiNi0.5Mn1.5O4/MCMB Li-ion batteries[J]. Advanced Energy Materials, 2017, 1701398.
[31] ZHU Y, LI Y, BETTGE M, et al. Electrolyte additive combinations that enhance performance of high-capacity Li1.2Ni0.15Mn0.55Co0.1O2-graphite cells[J]. Electrochimica Acta, 2013, 110: 191-199.
[32] ZHU Y, LI Y, BETTGE M, et al. Positive electrode passivation by LiDFOB electrolyte additive in high-capacity lithium-ion cells[J]. Journal of the Electrochemical Society, 2012, 159(12): A2109-A2117.
[33] SU C C, HE M, PEEBLES C, et al. Functionality selection principle for high voltage lithium-ion battery electrolyte additives[J]. ACS Applied Materials & Interfaces, 2017, 9(36): 30686-30695.
[34] ZHENG X, WANG X, CAI X, et al. Constructing a protective interface film on layered lithium-rich cathode using an electrolyte additive with special molecule structure[J]. ACS Applied Materials & Interfaces, 2016, 8(44): 30116-30125.
[35] AURBACH D, GAMOLSKY K, MARKOVSKY B, et al. On the use of vinylene carbonate (VC) as an additive to electrolyte solutions for Li-ion batteries[J]. Electrochimica Acta, 2002, 47(9): 1423-1439.
[36] LIM S H, CHO W, KIM Y J, et al. Insight into the electrochemical behaviors of 5V-class high-voltage batteries composed of lithium-rich layered oxide with multifunctional additive[J]. Journal of Power Sources, 2016, 336: 465-474.
[37] XU K. Electrolytes and interphases in Li-ion batteries and beyond[J]. Chemical Reviews, 2014, 114(23): 11503.
[38] KANG X, ARTHUR VON C. Interfacing electrolytes with electrodes in Li ion batteries[J]. Journal of Materials Chemistry, 2011, 21(27): 9849-9864.
[39] XU K. Nonaqueous liquid electrolytes for lithium-based rechargeable batteries[J]. Chemical Reviews, 2004, 104(10): 4303-417.
[40] SHENG S Z. A review on electrolyte additives for lithium-ion batteries[J]. Journal of Power Sources, 2006, 162(2): 1379-1394.
[41] VERMA P, MAIRE P, NOVáK P. A review of the features and analyses of the solid electrolyte interphase in Li-ion batteries[J]. Electrochimica Acta, 2010, 55(22): 6332-6341.
[42] YIM T, KWON M S, MUN J, et al. Room temperature ionic liquid-based electrolytes as an alternative to carbonate-based electrolytes[J]. Israel Journal of Chemistry, 2015, 55(5): 586-598.
[43] THACKERAY M M, KANG S H, JOHNSON C S, et al. Li2MnO3-stabilized LiMO2(M = Mn, Ni, Co) electrodes for lithium-ion batteries[J]. Journal of Materials Chemistry, 2007, 17(30): 3112-3125.
[44] CHEN Z, QIN Y, AMINE K, et al. Role of surface coating on cathode materials for lithium-ion batteries[J]. Journal of Materials Chemistry, 2010, 20(36): 7606-7612.
[45] KIM J H, PARK M S, SONG J H, et al. Effect of aluminum fluoride coating on the electrochemical and thermal properties of 0.5Li2MnO30.5LiNi0.5Co0.2Mn0.3O2composite material[J]. Journal of Alloys & Compounds, 2012, 517: 20-25.
[46] HY S, FELIX F, RICK J, et al. Direct in situ observation of Li2O evolution on Li-rich high-capacity cathode material, Li[NiLi(1-2x)/3Mn(2-)/3]O2(0££0.5)[J]. Journal of the American Chemical Society, 2014, 136(3): 999-1007.
[47] KANG K S, CHOI S, SONG J H, et al. Effect of additives on electrochemical performance of lithium nickel cobalt manganese oxide at high temperature[J]. Journal of Power Sources, 2014, 253(5): 48-54.
[48] SHI L, WANG W, WANG A, et al. Understanding the impact mechanism of the thermal effect on the porous silicon anode material preparation via magnesiothermic reduction[J]. Journal of Alloys and Compounds, 2016, 661(Supplement C): 27-37.
[49] XIANG K, WANG X, CHEN M, et al. Industrial waste silica preparation of silicon carbide composites and their applications in lithium-ion battery anode[J]. Journal of Alloys and Compounds, 2017, 695(Supplement C): 100-105.
[50] ZHOU Y, GUO H, YONG Y, et al. Introducing reduced graphene oxide to improve the electrochemical performance of silicon-based materials encapsulated by carbonized polydopamine layer for lithium ion batteries[J]. Materials Letters, 2017, 195(Supplement C): 164-167.
[51] WANG D, GAO M, PAN H, et al. Enhanced cycle stability of micro-sized Si/C anode material with low carbon content fabricated via spray drying and in situ carbonization[J]. Journal of Alloys and Compounds, 2014, 604(Supplement C): 130-136.
[52] ZHANG W, CHEN X, YONG T, et al. Multiwalled carbon nanotube webs welded with Si nanoparticles as high-performance anode for lithium-ion batteries[J]. Journal of Alloys and Compounds, 2016, 688(Part B): 216-224.
[53] ZHU H, YANG K, LAN H, et al. Electrochemical kinetics of Na2Ti3O7as anode material for lithium-ion batteries[J]. Journal of Electroanalytical Chemistry, 2017, 788(Supplement C): 203-209.
[54] KIM J S, CHOI W, CHO K Y, et al. Effect of polyimide binder on electrochemical characteristics of surface-modified silicon anode for lithium ion batteries[J]. Journal of Power Sources, 2013, 244(Supplement C): 521-526.
[55] YU H, LUO M, QIAN S, et al. Ba0.9La0.1Li2Ti6O14: Advanced lithium storage material for lithium-ion batteries[J]. Electrochimica Acta, 2017, 232(Supplement C): 132-141.
[56] ZHANG S S. A review on electrolyte additives for lithium-ion batteries[J]. Journal of Power Sources, 2006, 162(2): 1379-1394.
[57] XU M, ZHOU L, HAO L, et al. Investigation and application of lithium difluoro(oxalate)borate (LiDFOB) as additive to improve the thermal stability of electrolyte for lithium-ion batteries[J]. Journal of Power Sources, 2011, 196(16): 6794-6801.
[58] LIU Y, LV J, FEI Y, et al. Improvement of storage performance of LiMn2O4/graphite battery with AlF3-coated LiMn2O4[J]. Ionics, 2013, 19(9): 1241-1246.
[59] WANG J, LIU Z, YAN G, et al. Improving the electrochemical performance of lithium vanadium fluorophosphate cathode material: Focus on interfacial stability[J]. Journal of Power Sources, 2016, 329(Supplement C): 553-557.
[60] WANG W, YANG S. Enhanced overall electrochemical performance of silicon/carbon anode for lithium-ion batteries using fluoroethylene carbonate as an electrolyte additive[J]. Journal of Alloys and Compounds, 2017, 695(Supplement C): 3249-3255.
[61] REZQITA A, SAUER M, FOELSKE A, et al. The effect of electrolyteadditives on electrochemical performance of silicon/mesoporous carbon (Si/MC) for anode materials for lithium-ion batteries[J]. Electrochimica Acta, 2017, 247: 600-609.
[62] MICHAN A L, PARIMALAM B S, LESKES M, et al. Fluoroethylene carbonate and vinylene carbonate reduction: Understanding lithium-ion battery electrolyte additives and solid electrolyte interphase formation[J]. Chemistry of Materials, 2016, 28(22): 8149-8159.
[63] LAGGESSE E G, WEI T, NACHIMUTHU S, et al. Theoretical study of the reductive decomposition of vinylethylene sulfite as an additive in lithium ion battery[J]. Journal of the Chinese Chemical Society, 2016, 63(6): 480-487.
[64] LI B, XU M, LI T, et al. Prop-1-ene-1,3-sultone as SEI formation additive in propylene carbonate-based electrolyte for lithium ion batteries[J]. Electrochemistry Communications, 2012, 17(Supplement C): 92-95.
[65] LI B, XU M, LI B, et al. Properties of solid electrolyte interphase formed by prop-1-ene-1,3-sultone on graphite anode of Li-ion batteries[J]. Electrochimica Acta, 2013, 105(Supplement C): 1-6.
[66] XU K. Electrolytes and interphasial chemistry in Li ion devices[J]. Energies, 2010, 3(1): 135-154.
[67] MARTINEZ DE LA HOZ J M, BALBUENA P B. Reduction mechanisms of additives on Si anodes of Li-ion batteries[J]. Phys. Chem. Chem. Phys., 2014, 16(32): 17091-17098.
[68] PROFATILOVA I A, STOCK C, SCHMITZ A, et al. Enhanced thermal stability of a lithiated nano-silicon electrode by fluoroethylene carbonate and vinylene carbonate[J]. Journal of Power Sources, 2013, 222(Supplement C): 140-149.
[69] SOTO F A, MA Y, MARTINEZ DE LA HOZ J M, et al. Formation and growth mechanisms of solid-electrolyte interphase layers in rechargeable batteries[J]. Chemistry of Materials, 2015, 27(23): 7990-8000.
[70] SCHRODER K, ALVARADO J, YERSAK T A, et al. The effect of fluoroethylene carbonate as an additive on the solid electrolyte interphase on silicon lithium-ion electrodes[J]. Chemistry of Materials, 2015, 27(16): 5531-5542.
[71] HUNT P A, KIRCHNER B, WELTON T. Characterising the electronic structure of ionic liquids: An examination of the 1-butyl-3-methylimidazolium chloride ion pair[J]. Chem. Eur. J., 2006, 12: 6762-6775.
[72] TANG W J, PENG W J, YAN G C, et al. Effect of fluoroethylene carbonate as an electrolyte additive on the cycle performance of silicon-carbon composite anode in lithium-ion battery[J]. Ionics, 2017, 23(12): 3281-3288.
[73] HERBERT E G, TENHAEFF W E, DUDNEY N J, et al. Mechanical characterization of LiPON films using nanoindentation[J]. Thin Solid Films, 2011, 520(1): 413-418.
[74] XU C, LINDGREN F, PHILIPPE B, et al. Improved performance of the silicon anode for Li-ion batteries: Understanding the surface modification mechanism of fluoroethylene carbonate as an effective electrolyte additive[J]. Chemistry of Materials, 2015, 27(7): 2591-2599.
[75] CAMMARATA L, KAZARIAN S G, SALTERB P A, et al. Molecular states of water in room temperature ionic liquids[J]. Phys. Chem. Chem. Phys., 2001, 3: 5192-5200.
[76] MADEC L, PETIBON R, TASAKI K, et al. Mechanism of action of ethylene sulfite and vinylene carbonate electrolyte additives in LiNi1/3Mn1/3Co1/3O2/graphite pouch cells: electrochemical, GC-MS and XPS analysis[J]. Phys. Chem. Chem. Phys., 2015, 17(40): 27062-27076.
[77] ZHANG B, METZGER M, SOLCHENBACH S, et al. Role of 1,3-propane sultone and vinylene carbonate in solid electrolyte interface formation and gas generation[J]. The Journal of Physical Chemistry C, 2015, 119(21): 11337-11348.
[78] SHENG S Z. A review on electrolyte additives for lithium-ion batteries[J]. Journal of Power Sources, 2006, 162(2): 1379-1394.
[79] XIANG H F, XU H Y, WANG Z Z, et al. Dimethyl methylphosphonate (DMMP) as an efficient flame retardant additive for the lithium-ion battery electrolytes[J]. Journal of Power Sources, 2007, 173(1): 562-564.
[80] HYUNG Y E, VISSER D R, AMIE K. Flame-retardant additives for lithium-ion batteries[J]. Journal of Power Sources, 2003, 119: 383-387.
[81] KIM Y, JEONG D Y, HAN S C. First-principles investigation of the gas evolution from the cathodes of lithium-ion batteries during the storage test[J]. Journal of Material Science, 2014, 49: 8444−8448.
[82] XIAO L F, AI X P, CAO Y L, et al. Electrochemical behavior of biphenyl as polymerizable additive for overcharge protection of lithium ion batteries[J]. Electrochimica Acta, 2004, 49: 4189-4196.
[83] YOSHIDA H, FUKUNAGA T, HAZAMA T, et al. Degradation mechanism of alkyl carbonate solvents used in lithium-ion cells during initial charging[J]. Journal of Power Sources, 1997, 68: 311-315.
[84] ZHUANG G V, YANG H, BLIZANAC B, et al. A study of electrochemical reduction of ethylene and propylene carbonate electrolytes on graphite using ATR-FTIR spectroscopy[J]. Electrochemical and Solid-State Letters, 2005, 8(9): A441-A445.
[85] TENG X, ZHAN C, BAI Y, et al. In-situ analysis of gas generation in lithium ion batteries with different carbonate-based electrolytes[J]. ACS Applied Materials Interfaces, 2015, 7(41): 22751-22755.
[86] XIA J, PETIBON R, XIAO A, et al. Some fluorinated carbonates as electrolyte additives for li(Ni0.4Mn0.4Co0.2)O2/graphite pouch cells[J]. Journal of the Electrochemical Society, 2016, 163(8): A1637-A1645.
[87] XIA J, MADEC L, MA L, et al. Study of triallyl phosphate as an electrolyte additive for high voltage lithium-ion cells[J]. Journal of Power Sources, 2015, 295: 203-211.
Progress of electrolyte additives for high-capacity power lithium ion batteries
ZHANG Xiaoyan, REN Yufei, GAO Jie, ZHANG Lan, ZHANG Haitao
(Beijing Key Laboratory of Ionic Liquids Clean Process, Key Laboratory of Green Process and Engineering, State Key Laboratory of Multiphase Complex Systems, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China)
Power batteries have significant influence on the development of electric vehicles.Lithium ion batteries are regarded as the most promising candidate among different electrochemical energy storage devices due to their outstanding characteristics. Cycling performances and safety issues of lithium ion batteries are highly concerned and tightly related to the properties of electrolytes. State-of-the-art electrolytes are composed of organic solvents, lithium salts,and additives, and among which the additive plays an important role and shows great influence on the electrochemical performances and cycle life of the batteries. This paper reviews the recent progress on electrolyte additives, especially the ones related to high-voltage cathode and silicon-carbon anode materials. The functionalities and mechanisms of typical additives are presented in details. We believe that high performance power batteries could be realized by developing novel multi-functional electrolyte additives.
lithium-ion battery; electrolyte; additive; solid electrolyte interphase
10.12028/j.issn.2095-4239.2018.0007
TM 911.3
A
2095-4239(2018)03-0404-14
2018-01-18;
2018-03-15。
国家重点研发计划新能源汽车专项(2016YFB0100303),国家自然科学基金“中韩合作项目”(51561145020),中科院国际创新团队(20140491518),河南省郑州市重大专项(174PZDZX570)。
张晓妍(1989—),女,硕士,研究实习员,研究方向为高压锂离子电池电解液,E-mail:xyzh@ipe.ac.cn;
张海涛,博士,研究员,研究方向为能源材料,E-mail:htzhang@ipe.ac.cn。

