小麦小孢子培养愈伤组织的高频诱导及其绿苗再生
何 婷,郭桂梅,陈志伟,张述伟,宗营杰,陆瑞菊,王亦菲,刘成洪
(上海市农业科学院生物技术研究所,上海市农业遗传育种重点实验室,上海 201106)
小麦(Triticum aestivum L.)是在世界各地广泛种植的禾本科植物,是最重要的粮食作物之一,在中国是仅次于水稻的第二大作物。在小麦育种中,加倍单倍体只用一个世代就可以得到纯合的二倍体植株。一直以来,花药培养是小麦获得单倍体的主要手段,游离小孢子培养是从花药培养发展而来的,在单细胞水平上获得纯系的培养方法,可以获得大规模单倍体(Haploid)和加倍单倍体(Doubled Haploid,DH)群体。小孢子离体培养技术为研究小孢子从配子体发育转向孢子体发育的影响因子及其调控机理提供了理想的实验系统;该技术与分子技术相结合可以提高目标基因的重组效率,并可为研究小孢子全能性表达的分子机制试验供试材料。小麦游离小孢子培养自1993年由Tuvesson等[1]进行报道后,近几年来又取得了一定的进展[2-6],但在预处理、诱导及分化等技术环节上有待于进一步研究。几乎所有麦类作物小孢子培养实验体系都采用胁迫处理诱导雄核发育,在离体条件下对幼穗、花药或小孢子进行物理、化学等预处理方法来启动或加强小孢子胚胎的发生过程。本试验所用材料是由墨西哥国际玉米小麦改良中心选育的小麦品种‘Alondra’,其具有农艺性状良好、株型紧凑、茎秆粗壮不易倒伏、结实多且籽粒饱满以及对锈病和白粉病有较好的抗性等优点,但重感赤霉病[7]。试验以‘Alondra’离体穗为外植体,探讨不同预处理方法对小孢子愈伤诱导过程的影响,阐明不同预处理方法对愈伤组织形成的促进或抑制作用,并建立高效稳定的愈伤诱导技术。该技术将为进一步使用小孢子培养与杂交、诱变、胁迫筛选等方法相结合对小麦进行利用和改良提供实验基础。
1 材料与方法
1.1 供试材料
以2017年8月上海市农业科学院人工气候室内种植的小麦品种‘Alondra’为试验材料,选取中部小花小孢子处于单核中-晚期的离体穗为外植体。
1.2 小孢子的游离与培养
将离体穗去除多余叶片,包裹保鲜袋放置于5℃暗培养箱内,冷藏10 d后接取花药,接种时,穗子用质量分数为10%消毒灵溶液浸泡10 min,无菌水冲洗3—4次,完全去除消毒液。每50 mL离心管接入1 000枚花药,加入12 mL提取液,匀浆机旋切至花药壁完全破碎,使小孢子完全释放出来;用300目筛网过滤至13 mL离心管中,滤液以400 r/min离心5 min,此时小孢子沉淀至离心管底部,吸出上清液,加入3 mL提取液吹打混匀,转入培养皿(60 mm×35 mm)中,封口膜封口,置于培养箱中暗处理2 d。将小孢子悬浮液转入13 mL离心管中,以600 r/min离心5 min,使小孢子沉淀于管底,吸出上清液。培养前将小孢子先用质量分数为21%麦芽糖溶液纯化,收集活的小孢子,然后用诱导培养基将小孢子密度调节至1.0×105个/mL,取1 mL小孢子悬浮液接种于培养皿(35 mm×15 mm)中,封口膜封口,26℃暗培养30 d。
1.3 小孢子的预处理方法
设置5组预处理试验:1)冷藏离体穗喷洒提取液和不喷洒提取液试验;2)游离小孢子33℃热激暗处理与26℃暗处理试验;3)提取液中添加6-苄氨基腺嘌呤(6-BA)和不添加6-BA试验;4)小花5℃、3 d冷藏后游离小孢子与直接游离小孢子试验;5)小孢子培养20 d后更换新鲜诱导培养基与不更换培养基试验。且每组试验4个重复。
1.4 提取液与诱导培养基
提取液为60 g/L甘露醇,添加1.1 g/L CaCl2和0.976 g/LMES(N-吗啡乙烷磺酸),pH调节至5.8,并用于离体穗的喷洒;诱导培养基以改良的N6培养基为基本培养基,添加麦芽糖90 g/L,2,4-D 2.0 mg/L和KT 0.5 mg/L,pH调节至5.8。提取液与诱导培养基均过滤灭菌。
1.5 数据分析
愈伤组织产量:小孢子诱导培养30 d后,吸取液体培养基后用电子天平称量愈伤质量,用mg/皿表示,4个重复数据采用LSD法统计分析。
2 结果与分析
2.1 离体穗喷洒提取液对小孢子愈伤组织产量的影响
图1可见,在取材后离体穗冷藏期间不喷提取液与喷洒提取液处理,愈伤组织产量分别为25.8mg/皿和23.3 mg/皿,无显著差异。因此,在离体穗阶段喷洒提取液不能提高愈伤组织产量,说明离体穗在叶片包裹下喷洒的提取液未对小孢子的分裂和胚状体愈伤的发育产生促进作用。
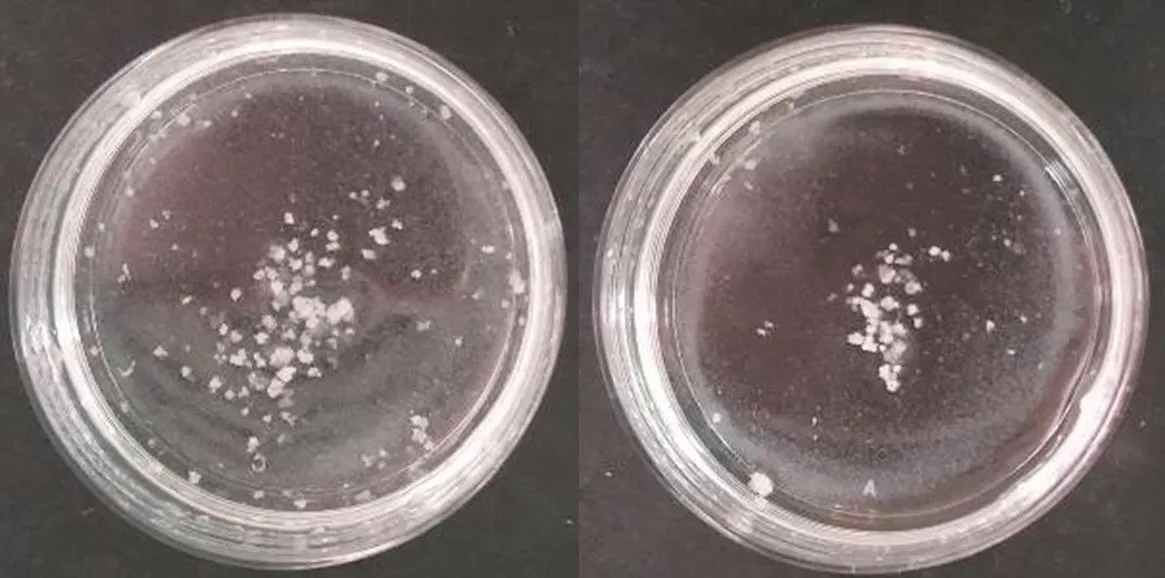
图1 不喷洒提取液的愈伤(左)和喷洒提取液的愈伤(右)Fig.1 Calli sprayed without extracting solution(left)and calli sprayed with extracting solution(right)
2.2 热激预处理对小孢子愈伤组织产量的影响
在游离小孢子预处理2 d时,33℃暗处理的小孢子膨胀速度大于26℃暗处理的小孢子,且经33℃热激的小孢子在培养过程中更易于观察到星状结构,该结构被认为与胚状体愈伤的出现存在相关性。由图2可见,33℃预处理的小孢子经30 d诱导培养基培养后,愈伤组织产量均值为48.2 mg/皿,显著高于26℃预处理条件下获得的愈伤组织产量30.6 mg/皿,说明33℃高温对小麦小孢子胚状体愈伤的获得有很好的促进作用。这与高增玉等[8]高温预处理不同小麦外植体的结果相似。
2.3 提取液中添加6-BA对小孢子愈伤组织产量的影响
由图3可见,在提取液中添加20 mg/L 6-BA并没有增加愈伤组织产量,相反使愈伤组织产量下降(图4B),与对照组(图4A)存在明显差异,与高增玉等[9]在幼穗阶段经BA预处理后大大增加了胚状体产量的结果不一致。本研究表明,6-BA对小孢子的有丝分裂没有促进作用,更适合作为分化阶段的主要激素。

图2 不同预处理温度的小麦小孢子愈伤Fig.2 M icrospore calli under different tem perature pretreatments

图3 含6-BA提取液游离小孢子的愈伤产量Fig.3 M icrospore callus yield of isolated m icrospores with 6-BA extracting solution

图4 不同预处理条件下小麦小孢子愈伤Fig.4 W heatm icrospore calli under different pretreatments
2.4 小花低温预处理对小孢子愈伤组织产量的影响
将小花接入离心管后经过3 d、5℃低温预处理再进行小孢子游离,并在33℃暗培箱中高温预处理2 d,30 d后获得的愈伤产量均值为129.4 mg/皿(图4C),与没有低温预处理小花直接游离小孢子的对照组48.2 mg/皿(图4A)存在显著差异。由此可见,小花低温预处理与游离小孢子高温预处理相结合获得最多胚状体愈伤组织,与王春霞等[10]对花药进行低温预处理后对胚状体的发育有促进作用结论一致。
2.5 更换诱导培养基对小孢子愈伤组织产量的影响
在诱导培养基中培养至20 d时,吸出原有液体培养基重新加入1 mL新鲜培养基,培养至30 d时与对照比较愈伤组织重量。愈伤组织产量为90.3 mg/皿(图4D)显著高于对照组(图4A),说明新鲜培养基对愈伤的生长产生了新的刺激作用,加速了胚状体生长速度,单个愈伤明显大于对照组单个愈伤。
2.6 小麦小孢子离体培养的愈伤组织诱导及绿苗分化
在自然条件下,单核靠边期的小麦小孢子先进行一次不均等有丝分裂,形成一个营养核和一个生殖核,接着生殖核再发生一次有丝分裂,形成了3-细胞的成熟花粉。在离体条件下,通过预处理方法阻断小孢子的两次有丝分裂,促使小孢子从配子体发育向孢子体发育转化,从而使细胞核快速移动至小孢子中心,由小液泡环绕形成星状结构;在星状体形成后,该结构是否可由细胞核的对称分裂转变为多细胞结构是小孢子离体发育过程的关键,但在光学显微镜中无法精确观察到这一过程的始发时刻。没有发生星状结构或星状体无法进一步形成多细胞结构的小孢子在发生质壁分离后萎缩或停止在前期的多核状态,只有完成从星状体到多细胞结构演化的小孢子才有潜力最终形成胚状体愈伤。图5为小麦小孢子愈伤诱导、绿苗分化及再生植株壮苗生根的过程。本试验通过一系列预处理方法筛选和协同作用,最终获得了稳定的愈伤产量,在分化培养基中愈伤开始分化形成小麦小孢子绿色再生植株。

图5 小麦小孢子培养诱导及分化和生根Fig.5 W heatm icrospore callus induction,green plantlet differentiation and radication
3 结论与讨论
麦类作物小孢子培养中小麦小孢子培养技术的发展尤为缓慢,本试验团队借助领先的大麦、青稞小孢子培养技术[11-13]和较纯熟的水稻小孢子培养技术[14-15],对小麦小孢子培养过程中胚性愈伤组织的诱导进行了多种预处理试验,确定了小麦小孢子培养的最佳预处理方法为接种小花5℃低温处理3 d,游离小孢子33℃热激处理2 d,经过纯化转入诱导培养基,26℃暗培养30 d。该方法在小麦品种‘Alondra’上获得了稳定的愈伤产量,为进一步在其他基因型上进行拓展打下了坚实基础。
此外,胚性愈伤组织是遗传转化的优良受体,小孢子胚性愈伤较成熟胚、幼胚、原生质体等诱导的愈伤具有胚状体群体数量巨大,性状稳定、一致,再生频率高等独特的优势[16-18]。农杆菌介导侵染植物外植体是获得转基因植株的常用方法,而用携带目标基因的农杆菌菌液直接侵染小孢子愈伤,在侵染成功后随着愈伤组织分化而形成再生植株,是不同于以往基于植株、成熟胚、幼胚等为外植体获得转基因植株的新方法。与大麦小孢子离体培养条件下大麦小孢子再生植株的自然加倍频率较高不同的是,小麦小孢子再生植株的自然加倍率偏低,这为获得单倍体转基因植株提供了有利条件,也为小麦基因编辑技术提供了一种新颖的方法。
[1]TUVESSON IK D,OHLUND R C V.Plant regeneration through culture of isolated microspores of Triticum aestivum L.[J].Plant Cell,Tissue Organ Culture,1993,34(2):163-167.
[2]李光威,兰素缺,孙宝启.小麦游离小孢子培养的研究[J].华北农学报,2001,16(1):83-87.
[3]王宏芝,杨成民,魏建华,等.低温预处理和高温饥饿胁迫对冬小麦小孢子胚胎发生和植株再生的影响[J].农业生物技术学报,2004,12(4):390-395.
[4]秦余香,夏光明.小麦的小孢子培养[J].植物学通报,2004,21(5):625-630.
[5]董静,邬飞波,张国平.麦类作物小孢子培养研究进展[J].麦类作物学报,2005,25(2):102-106.
[6]吕树作,李雪红,王洁琼,等.小麦小孢子胚胎发生机制及培养技术研究进展[J].河南农业科学,2016,45(9):8-14.
[7]李明浩,陈炜,邢莉萍,等.普通小麦品种 Alondra’s遗传转化体系的建立[J].植物学报,2010,45(4):466-471.
[8]高增玉,赵爱菊,陈希勇,等.预处理形式对小麦小孢子胚胎发生的影响[J].河北农业科学,2009,13(4):41-42.
[9]高增玉,赵爱菊,刘玉萍,等.利用6-BA促进小麦小孢子胚胎发生的研究[J].河北农业科学,2008,12(5):66-68.
[10]王春霞,廖玉才,张杰,等.低温和诱导时间对小麦小孢子培养的影响[J].华中农业大学学报,2007,26(2):167-170.
[11]陆瑞菊,徐红卫,陈志伟,等.源于小孢子培养的大麦耐盐变异体获取[J].植物生理学报,2012,48(11):1069-1078.
[12]陆瑞菊,陈志伟,何婷,等.化学诱变剂和60Co处理对大麦小孢子低氮胁迫培养的影响[J].植物生理学报,2013,49(12):1442-1446.
[13]陆瑞菊,高润红,郭桂梅,等.青稞的小孢子离体培养和植株再生[J].植物生理学报,2014,50(12):1764-1768.
[14]郭桂梅,高润红,卜姝明,等.预处理对水稻小孢子诱导愈伤组织产量和绿苗分化的影响[J].上海农业学报,2014,30(5):51-55.
[15]刘成洪,何婷,郭桂梅,等.粳稻 F1小孢子培养条件的优化[J].植物生理学报,2017,53(9):1813-1818.
[16]李明浩,陈炜,邢莉萍,等.农杆菌介导小麦遗传转化条件的优化[J].分子植物育种,2010,8(2):388-392.
[17]宋成丽,王翾,徐虹,等.农杆菌介导的小麦成熟胚转化的影响因素[J].麦类作物学报,2012,32(2):209-214.
[18]刘鑫,魏学宁,张学文,等.小麦原生质体高效转化体系的建立[J].植物遗传资源学报,2017,18(1):117-124.

