首发未治疗青少年特发性全面性癫痫脑白质磁共振成像研究
梅兰,龙然,唐光才,韩福刚,刁显明,陈洪亮,邱丽华,*
癫痫作为一种常见的慢性神经系统疾病,是致残和致死的重要原因之一,全世界大约有7000万人受到影响[1]。特发性全面性癫痫(idiopathic generalized epilepsy,IGE)多发生于青少年或成年人,临床表现为失神、肌阵挛和全身性强直性阵挛发作,可以单独或组合出现,严重程度不一,可导致严重伤残甚至死亡[2]。磁共振成像(magnetic resonance imaging,MRI)作为一种非侵入性检查手段,被广泛应用于研究包括癫痫在内的神经心理学疾病的结构和功能变化。前期关于癫痫的研究大多集中于慢性癫痫患者,考虑到癫痫发作类型、持续时间和抗癫痫药物可能影响脑白质的完整性,本研究的目的是探讨首发未治疗青少年IGE脑白质微结构[量化为各向异性分数(fractional anisotropy,FA)和平均弥散系数(mean diffusivity,MD)]是否发生了改变,以了解IGE青少年癫痫病程早期的组织学特性,并观察FA值和MD值的变化是否与临床变量相关。
1 材料与方法
1.1 研究对象
本研究经医院伦理委员会同意和机构审查委员会批准,所有患者或患者家属均签署知情同意书。病例收集严格遵循国际抗癫痫联盟的诊断标准[3],所有患者均符合以下标准:(1)出现特发性全面性癫痫的典型临床症状,包括意识丧失和非局灶性癫痫;(2)发作期和发作间期出现2~4 Hz全面的棘慢波或多棘波放电,或在脑电图视频监测记录中至少存在一个典型癫痫样发放,并建议做阴性激发试验;(3)常规MRI检查无局灶性结构异常;(4)没有其他发育障碍或神经系统疾病;(5)在过去6个月内被诊断为癫痫,并从未使用过抗癫痫药物治疗。通过广告方式招募与未用药组性别、年龄及受教育程度相匹配的健康志愿者。对照组纳入标准包括:(1)无严重的全身脏器疾病,无药物或其他有可能影响脑部结构和功能的相关疾病;(2)无精神、神经或者心理疾病;(3)被试者监护人均知情并同意接受检查,受试者能够配合磁共振全程扫描检查;(4)受试者体内无金属异物,无磁共振扫描禁忌证。所有纳入对象都在正规学校上学。最后,共纳入45例青少年特发性全面性癫痫(年龄:5~18岁,男:女=26:19)和32名健康对照者(年龄:5~18岁,男:女=21:11),对照组和病例组在年龄、性别比例以及简易精神状态检查量表得分差异均无统计学意义(表1)。
1.2 数据采集
所有被试者均采用飞利浦Intera Achieva 3.0 T MR扫描仪进行数据采集,采用8通道相控阵线圈且被试者均为头先进仰卧位,头两侧放置海绵垫以最大程度减少头部运动。应用平面回波成像(echo planar imaging,EPI)序列进行扫描,扫描参数如下:TR=8700 ms,TE=90~110 ms,NEX=1,FOV:240 mm×240 mm,矩阵128×128,平面内分辨率1.875 mm,层厚3.5 mm,弥散敏感梯度方向40个,反转角40º,平均扫描时间约7 min,采集全脑图像。采集的数据被重建为矩阵256×256 (分辨率0.9375 mm×0.9375 mm)、体素大小为2 mm×2 mm×2 mm的图像。
1.3 数据处理与分析
采用FSL 4.1软件对扩散张量成像(diffusion tensor imaging,DTI)数据进行预处理(磁共振脑功能成像软件库:http://www.fmrib.ox.au.uk/fsl)。首先对b0图像采用仿射变换进行配准,完成头动和涡流校正,然后去除整个头部图像中的非脑组织保留脑组织图像。校正之后的DTI数据使用dtifit拟合扩散张量计算出FA值和MD值的参数图,它适用于每个体素的扩散张量模型,并评估扩散的主要方向。选择SPM8 (http://fil.ion.ucl.ac.uk)自带的平面回波模板为标准化模板,对各个被试的FA和MD参数图进行空间标准化以及对每个b0图像进行非线性标准化,所有参数图的体素大小为2 mm×2 mm×2 mm,最后使用全宽半高值为6 mm的高斯核函数对图像进行空间平滑处理。

表1 IGE组和健康对照组人口统计学资料Tab.1 Demographic information of IGE patients and healthy controls
1.4 统计学分析
采用SPM8中两样本t检验方法分析病例组和对照组FA值和MD值的差异是否有统计学意义,数据分析的统计阈值概率设定为P<0.05 [FEW(family-wise error)校正],将年龄和性别作为协变量,分析病例组有差异的FA值和MD值与临床变量是否具有相关性(包括始发年龄、病程和简易精神状态检查量表得分)。考虑到在SPM软件中默认的FWE校正是一种非常保守的校正方法,运用于全脑性分析可能过于严苛,因而AlphaSim多重比较校正(http: //www.restfmri.net/forum/)被进一步用于FA值差异的比较,在SPM中AlphaSim校正相对于FWE校正相对宽松,并可避免I型错误的发生。
2 结果
FWE校正后病例组左侧中央旁小叶、右侧楔前叶及右侧顶上小叶的MD值明显减低(图1),而两组间的FA值差异无统计学意义。经相对宽松的AlphaSim校正后发现病例组双侧额中上回深部脑白质区FA值升高(图2)。病例组与对照组的FA值和MD值组间差异分布脑区详见表2。此外,相关分析发现MD值和FA值改变与临床变量间无相关性。
3 讨论
3.1 本研究的主要发现
不同于以往慢性局灶性癫痫和特发性全面性癫痫患者的研究结果(多数发现MD值升高和FA值减低),笔者观察到首发未治疗的青少年IGE左侧中央旁小叶、右侧楔前叶及右侧顶上小叶的MD值减低,双侧额中上回深部脑白质的FA值升高。以往研究结果与本研究结果的差异可能由于本研究的样本量、纳入标准、不同的分析方法及设备的差异造成的,其次儿童各个年龄阶段髓鞘发育不一致,不同研究中患儿年龄跨度不同,亦可能会造成结果的差异。

图1 病例组左侧中央旁小叶、右侧楔前叶及右侧顶上小叶MD值减低(FWE校正,P<0.05) 图2 病例组双侧额中上回深部脑白质FA值升高(AlphaSim校正,P<0.05)Fig.1 The IGE group showed reduced mean diffusivity (MD) in white matter of left paracentral lobule, right precuneus and right superior parietal lobule (SPL) when compared with the healthy controls after family wise error (FEW) correction. Fig.2 Increased fractional anisotropy (FA) was found in the deep white matter of bilateral prefrontal lobe in the IGE group after AlphaSim correction.
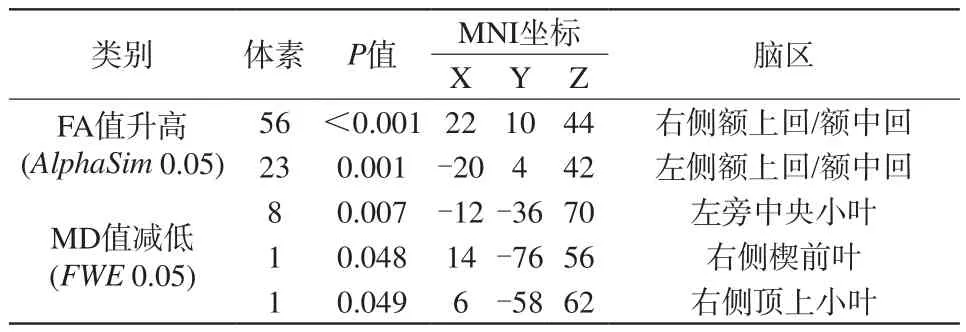
表2 病例组与对照组FA值和MD值组间差异分布脑区Tab.2 Location of brain regions with altered FA and MD in IGE patients
3.2 首发未治疗青少年IGE患者的MD差异
扩散系数的增加通常被解释为由癫痫发作引起的兴奋毒性机制使细胞溶解和死亡导致细胞外间隙扩大[4]。本研究发现癫痫早期阶段MD值减低可能与神经胶质激活有关,估计是抵抗认知功能障碍的神经保护机制。另外,轴突肿胀、轴突纤维之间的间隙减小致水分子扩散受限[5]可能是引起MD值降低的另一种原因。本研究中观察到的MD值减低主要是在中央旁小叶,中央旁小叶是连接中央前回和中央后回的重要结构,它涉及运动控制和肢体感觉功能[6]。IGE发作时通常表现为单次或重复发作的、双侧突然发生的、对称或不对称的不自主运动,主要涉及肩膀和手臂运动[7],因此中央旁小叶的MD值减低可能与肢体不自主运动症状相关。此外,青少年肌阵挛性癫痫患者(特发性全面性癫痫的常见表型)亦发现中央旁小叶的局部一致性(regional homogeneity,ReHo)值和皮层厚度下降[8-9]。楔前叶为本研究中第2个MD值减低的重要区域,它是默认模式网络的重要枢纽。默认模式网络功能连接异常已在全身强直性肌阵挛癫痫和失神癫痫患者中被报道[10-11]。儿童失神癫痫患者亦发现楔前叶ReHo值和FA值减低[12-13]。本研究结果中楔前叶MD值减低,印证了默认模式网络在首发未治疗青少年IGE中发挥着重要的作用。虽然关于顶上小叶与癫痫相关的报道较少,但青少年肌阵挛性癫痫患者脑电图显示双侧楔前叶、扣带回后部及顶上小叶同步异常放电[14]。Bittar等[15]利用正电子发射断层扫描研究显示癫痫发作期间顶上小叶区域同位素示踪剂浓聚,提示局部血流量增加。本研究结果中顶上小叶MD值减低提示顶上小叶在青少年IGE早期起到一定作用。
3.3 首发未治疗青少年IGE患者的FA差异
不同于前期研究发现额叶FA值减低,本研究发现首发未治疗青少年IGE的双侧额中上回FA值升高。尽管关于癫痫患者FA值升高的报道相对较少,但在威廉综合征、双相情感障碍、多发性硬化和早期阿尔茨海默病等神经精神疾病中已有报道。Alexander等[16]认为大脑的某些区域(如半卵圆中心、钩束及脑桥束)大量的纤维束交叉对应着较低的FA值。额叶内侧区域对IGE患者神经元异常放电的传播和泛化起着至关重要的作用[17],局部脑白质FA值减低被解释为轴索密度下降、轴索髓鞘化程度减低和白质纤维束走行一致性下降[18],通常被认为是大多数神经退行性和神经障碍性疾病的标志性特征。所以,本研究发现与健康对照组相比,病例组双侧额叶深部脑白质(如半卵圆中心区)的高FA值可能是白质中纤维束交叉少(即深部脑白质纤维束走行一致性高)的缘故。考虑到本研究纳入的IGE患者均为首发未治疗青少年儿童,目前发现的FA值升高,亦可能是IGE患者认知功能减退前的一种代偿机制。
3.4 MD和FA改变的临床意义
采用严格的FWE校正后只有MD值显示有改变,提示在癫痫发病早期MD值较FA值能更敏感地探测疾病的脑白质微结构改变。Nazem-Zadeh等[19]研究发现根据海马MD值改变对内侧颞叶癫痫致痫灶进行定侧分析可达到90%的准确率。因此,笔者认为在首发未治疗青少年IGE中MD值改变可能比FA值的意义更大,根据MD值的改变能更好地定位致痫灶,但MD值改变的病理生理学机制还尚不清楚,需要进一步研究。癫痫患者的脑白质完整性受损可能是认知障碍的结构基础[20-21]。Kim等[22]利用DTI研究发现伴中央-颞叶棘波的良性儿童癫痫(benign childhood epilepsy with centrotemporal spikes,BECTS)儿童的智商分数较正常儿童低,且相对于正常儿童,BECTS儿童左上纵束、内囊后肢、丘脑后辐射和胼胝体体部的FA值和MD值增高,语言智商低和注意力不集中与左上额枕束FA值升高有关,其中语言智商低还与胼胝体压部FA值减低有关,并认为脑白质微观结构的改变与认知功能障碍有关。Ekmekci等[23]对首发青少年肌阵挛癫痫患者采用神经心理学评估结合DTI研究认为从疾病开始就存在脑内微结构异常,是由疾病的遗传基础引起的。考虑到IGE患者慢性期表现出FA值减低、MD值升高以及认知功能障碍,笔者推测大脑白质微结构的变化是一个动态过程,在早期阶段某些脑功能区FA值升高和MD值减低,随着疾病的发展,在慢性期FA值逐渐降低和MD值逐渐升高。在疾病发展早期FA值增加和MD值降低可能与维持正常的认知功能有关,而随着疾病发展到慢性期癫痫患者FA值减低和MD值升高可能与慢性期癫痫患者认知功能障碍有关。
3.5 本研究的优点与局限性
本研究纳入的患者为首发未治疗的IGE患者,排除了多次反复发作及抗癫痫药物对大脑白质结构的影响,有利于观察青少年IGE患者早期脑白质微结构的变化。本研究的局限性在于很难解释DTI的发现,因为这项研究的性质不允许采用组织病理学来帮助证实和解释神经影像的发现。其次由于本研究是横断面调查设计,研究结果不能解释FA值升高和MD值降低是否随着病程发展而呈动态变化。
总之,本研究结果提示青少年IGE患者早期阶段即存在脑白质微观结构的改变,在IGE早期,MD检测脑白质微结构异常可能比FA敏感性更高。不同于以往的研究发现慢性期IGE患者MD值升高和FA值减低,本研究发现首发未治疗青少年IGE患者MD值减低和FA值升高,可能是IGE患者认知功能减退前的一种代偿机制。
参考文献 [References]
[1]Ngugi AK, Bottomley C, Kleinschmidt I, et al. Estimation of the burden of active and life-time epilepsy: a meta-analytic approach.Epilepsia, 2010, 51(5): 883-890.
[2]Marini C, King MA, Archer JS, et al. Idiopathic generalised epilepsy of adult onset: clinical syndromes and genetics. J Neurol Neurosurg Psychiatry, 2003, 74(2): 192-796.
[3]Commission on Classification and Terminology of the International League Against Epilepsy. Proposal for revised classification of epilepsies and epileptic syndromes. Epilepsia, 1989, 30(4): 389-399.
[4]Yogarajah M, Duncan JS. Diffusion-based magnetic resonance imaging and tractography in epilepsy. Epilepsia, 2008, 49(2):189-200.
[5]Povlishock JT, Katz DI. Update of neuropathology and neurological recovery after traumatic brain injury. J Head Trauma Rehabil, 2005,20(1): 76-94.
[6]Zhang Y, Liu H, Wang L, et al. Relationship between functional connectivity and motor function assessment in stroke patients with hemiplegia: a resting-state functional MRI study. Neuroradiology,2016, 58(5): 503-511.
[7]Alfradique I, Vasconcelos MM. Juvenile myoclonic epilepsy. Arq Neuropsiquiatr, 2007, 65(4B): 1266-1271.
[8]Jiang S, Luo C, Liu Z, et al. Altered local spontaneous brain activity in juvenile myoclonic epilepsy: A preliminary resting-state fMRI study. Neural Plast, 2016, 2016: 1-7.
[9]Kim SH, Lim SC, Kim W, et al. Extrafrontal structural changes in juvenile myoclonic epilepsy: a topographic analysis of combined structural and microstructural brain imaging. Seizure, 2015, 30(8):124-131.
[10]Li Q, Cao W, Liao X, et al. Altered resting state functional network connectivity in children absence epilepsy. J Neurol Sci, 2015, 354(1-2): 79-85.
[11]Liu F, Wang Y, Li M, et al. Dynamic functional network connectivity in idiopathic generalized epilepsy with generalized tonic-clonic seizure. Hum Brain Mapp, 2017, 38(2): 957-973.
[12]Yang T, Fang Z, Ren J, et al. Altered spontaneous activity in treatment-naive childhood absence epilepsy revealed by Regional Homogeneity. J Neurol Sci, 2014, 340(1-2): 58-62.
[13]Qiu W, Gao Y, Yu C, et al. Structural abnormalities in childhood absence epilepsy: voxel-based analysis using diffusion tensor imaging. Front Hum Neurosci, 2016, 10(9): 483.
[14]Clemens B, Puskás S, Besenyei M, et al. EEG-LORETA endophenotypes of the common idiopathic generalized epilepsy syndromes. Epilepsy Res, 2012, 99(3): 281-292.
[15]Bittar RG, Andermann F, Olivier A, et al. Interictal spikes increase cerebral glucose metabolism and blood fl ow: a PET study. Epilepsia,1999, 40(2): 170-178.
[16]Alexander AL, Hurley SA, Samsonov AA, et al. Characterization of cerebral white matter properties using quantitative magnetic resonance imaging stains. Brain Connect, 2011, 1(6): 423-446.
[17]Gotman J, Grova C, Bagshaw A, et al. Generalized epileptic discharges show thalamocortical activation and suspension of the default state of the brain. Proc Natl Acad Sci U S A, 2005, 102(42):15236-15240.
[18]Papadakis NG, Xing D, Houston GC, et al. A study of rotationally invariant and symmetric indices of diffusion anisotropy. Magn Reson Imaging, 1999, 17(6): 881-892.
[19]Nazem-Zadeh MR, Schwalb JM, Elisevich KV, et al. Lateralization of temporal lobe epilepsy using a novel uncertainty analysis of MR diffusion in hippocampus, cingulum, and fornix, and hippocampal volume and FLAIR intensity. J Neurol Sci, 2014, 342(1-2): 152-161.
[20]Widjaja E, Kis A, Go C, et al. Abnormal white matter on diffusion tensor imaging in children with new-onset seizures. Epilepsy Res,2013, 104(1-2): 105-111.
[20]Kori P, Garg RK, Malhotra HS, et al. Evaluation of cerebral whitematter micro-structural alterations in patients with medically refractory epilepsy using diffusion tensor tractography. Epilepsy Res,2013, 107(1-2): 82-90.
[21]Xiao F, Chen Q, Yu X, et al. Hemispheric lateralization of microstructural white matter abnormalities in children with active benign childhood epilepsy with centrotemporal spikes (BECTS): a preliminary DTI study. J Neurol Sci, 2014, 336(1-2): 171-179.
[22]Kim SE, Lee JH, Chung HK, et al. Alterations in white matter microstructures and cognitive dysfunctions in benign childhood epilepsy with centrotemporal spikes. Eur J Neurol, 2014, 21(5):708-717.
[23]Ekmekci B, Bulut HT, Gümüştaş F, et al. The relationship between white matter abnormalities and cognitive functions in new-onset juvenile myoclonic epilepsy. Epilepsy Behav, 2016, 62(7): 166-170.

