草甘膦和扑草净对蚯蚓体内SOD和AChE酶活性的影响
宋欣媛,吴培福,吴 博,孙仕仙
(1.西南林业大学 生命科学学院,云南 昆明 650224;2.西南林业大学 湿地学院,云南 昆明 650224)
近年来农药滥用的现象十分严重,引发了各界的广泛关注,土壤是人类赖以生存的主要资源,也是生态环境重要的组成部分。由于人们的环保意识差,在使用上单纯的追求杀虫或除草的效果,擅自提高其使用浓度,对生态系统形成危害。蚯蚓能使土壤变松,并使空气和水更容易到达植物的根部,同时还可以降解和疏散土壤中的污染物。由于蚯蚓所具有的独特生物学特性[1],学者们已将其作为土壤环境污染的指标,因此极大地促进了蚯蚓生态毒理学的发展[2-3]。本实验以蚯蚓为主要实验材料,所研究的内容主要通过OECD规定的滤纸接触法[4],研究除草剂草甘膦和扑草净单一作用对蚯蚓的毒性和致死效应,并绘制出剂量-效应曲线;进一步研究蚯蚓体内蛋白含量,超氧化物歧化酶(SOD)活力和乙酰胆碱酯酶(AChE)活力在草甘膦和扑草净单一作用时的变化,为科学的评价农药安全性提供基础数据支持。
1 材料及方法
1.1 实验动物
赤子爱胜蚓(Eiseniafoetida),购置于湖南蚯蚓养殖场,该品种常用于进行蚯蚓毒性试验,对污染物有中等的敏感性。实验前需预培养,实验时选择体质量均衡,环带明显的蚯蚓个体进行实验。
1.2 实验试剂
95%草甘膦粉剂(昆明农药有限公司);97%扑草净粉剂(昆明农药有限公司);考马斯亮兰蛋白测定试剂盒(南京建成生物工程研究所);超氧化物歧化酶(SOD)测试盒(南京建成生物工程研究所);乙酰胆碱酯酶(AChE)测试盒(南京建成生物工程研究所)。
1.3 实验方法
1.3.1 添加农药的方法 草甘膦:称取0.210 5 g 95%草甘膦放入100 mL容量瓶中,定容至100 mL配置成2 000 mg/L的草甘膦母液。分别吸取母液并用蒸馏水稀释配置成(1 000,1 200,1 400,1 600,1 800 mg/L)5个梯度质量浓度。吸取5 mL相应浓度的农药均匀地淋洒于垫有双层滤纸的玻璃培养皿上。
扑草净:吸取0.010 3 g 97%扑草净放入100 mL容量瓶中,加入2 mL丙酮助溶,定容至100 mL,配成100 mg/L的扑草净母液。分别吸取母液并用蒸馏水稀释配置成(20,40,60,80,100 mg/L)5个梯度质量浓度。吸取5 mL相应浓度的农药均匀淋洒于垫有双层滤纸的玻璃培养皿上。
空白组:草甘膦实验中,空白组试验吸取5 mL蒸馏水均匀地淋洒于垫有双层滤纸的玻璃培养皿上。扑草净实验中,空白组试验将2 mL丙酮溶于100 mL蒸馏水中混合均匀,然后吸取5 mL溶液均匀地淋洒于垫有双层滤纸的玻璃培养皿上。
1.3.2 试验前的预处理和染毒试验 将挑选好的体质量均衡的蚯蚓洗净后,放入装有己润湿滤纸的1 L大烧杯中,用塑料薄膜封口,并在薄膜上扎孔透气,置于阴凉的暗处清肠一昼夜,以除去肠道内的杂物。实验时,将清肠后的蚯蚓表面冲选干净,用滤纸吸干其表面水分,每10条蚯蚓放入一个玻璃培养皿中,每个浓度设置3个平行实验。为防止蚯蚓逃跑用已扎孔的塑料薄膜将培养皿密封,放置于20 ℃左右、阴凉无光照的条件下培养,观察蚯蚓的中毒症状及行为(刺激蚯蚓头部无明显反应时认为蚯蚓已死亡),并定时记录蚯蚓的死亡率,在染毒期间注意清理死亡蚯蚓以防污染其他蚯蚓。
1.3.3 蛋白含量的测定 分别在24,48,72 h采集蚯蚓存活样品,用清水清洗并用滤纸将水吸干,称量,按质量体积比加生理盐水制备成10%的组织匀浆,放入离心机2 500 r/min,离心10 min,取上清液,再用生理盐水按1∶9的比例稀释成1%的组织匀浆,待测。按试剂盒说明方法测定,加入显色剂混匀,静置10 min,于波长595 nm处,光径1 cm,蒸馏水调零,测各管吸光光度(OD)值。
(1)
1.3.4SOD酶活力测定 分别在24,48,72 h采集蚯蚓存活样品,称量,按质量体积比加生理盐水冰水浴条件下制备成10%的组织匀浆。在离心机3 000 r/min,4 ℃离心10 min,取上清液待测。按试剂盒说明方法测定,加入试剂盒试剂,混匀,室温静置10 min,于波长550 nm处,1 cm光径比色杯,蒸馏水调零,比色,测各管吸光度值。
(2)
1.3.5AChE活力测定 分别于24,48 h采集蚯蚓存活样品,称量,按质量体积比加生理盐水冰水浴条件下制备成10%的组织匀浆,2 500 r/min,4 ℃离心10 min,取上清液待测。按照试剂盒说明书操作步骤加入各试剂,静止15 min,波长412 nm,0.5 cm光径,双蒸水调零,测各管吸光光度(OD)值。
(3)
1.3.6 数据处理 试验数据结果用统计学方法,采用Excel和SPSS软件处理与分析,半致死质量浓度(LC50)采用SPSS软件获得。所得结果均为平均数±标准差,并用回归法分析污染的剂量——效应关系,以相关系数表明相关程度。
2 结果与分析
2.1 草甘膦和扑草净两种农药单一污染对蚯蚓的毒性效应
图1和图2中,死亡率随浓度和时间的递增而递增,72 h时,两种农药的高浓度组的死亡率均已接近50%。
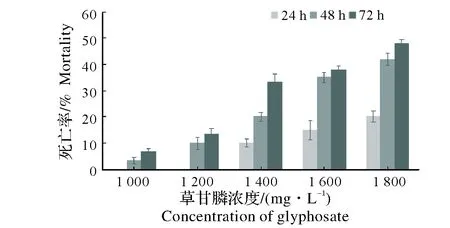
图1 草甘膦对蚯蚓的剂量-效应关系图Fig.1 Doseage-response relationship of glyphosate on earthworms
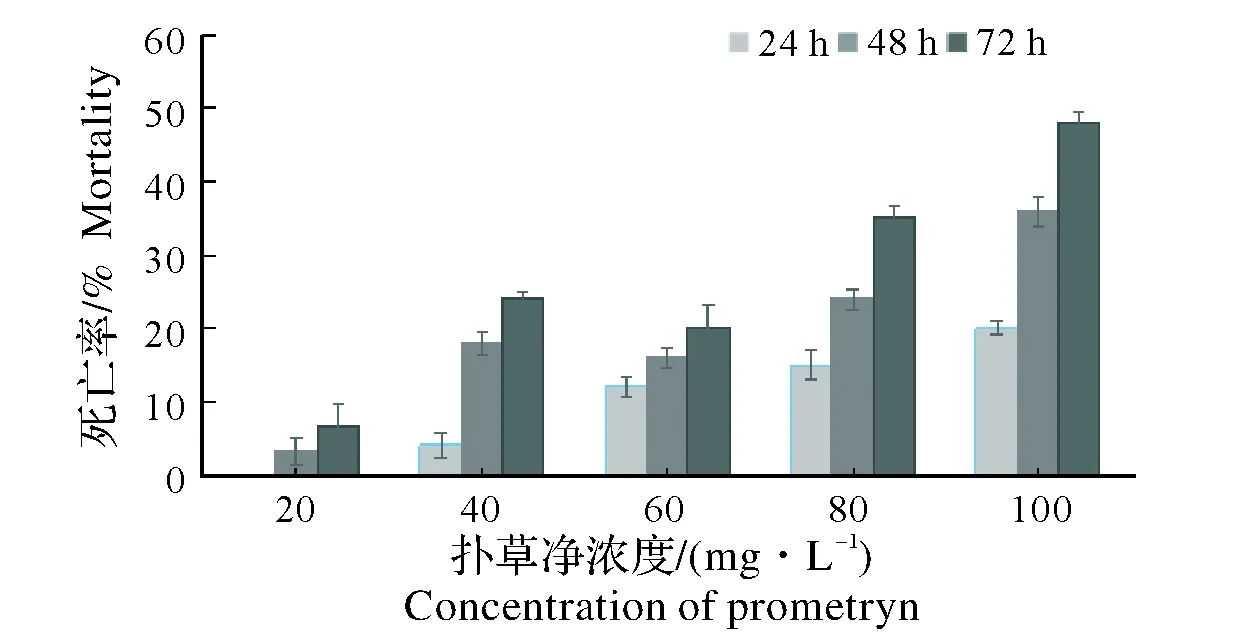
图2 扑草净对蚯蚓的剂量-效应关系Fig.2 Doseage-response relationship of prometryn on earthworms
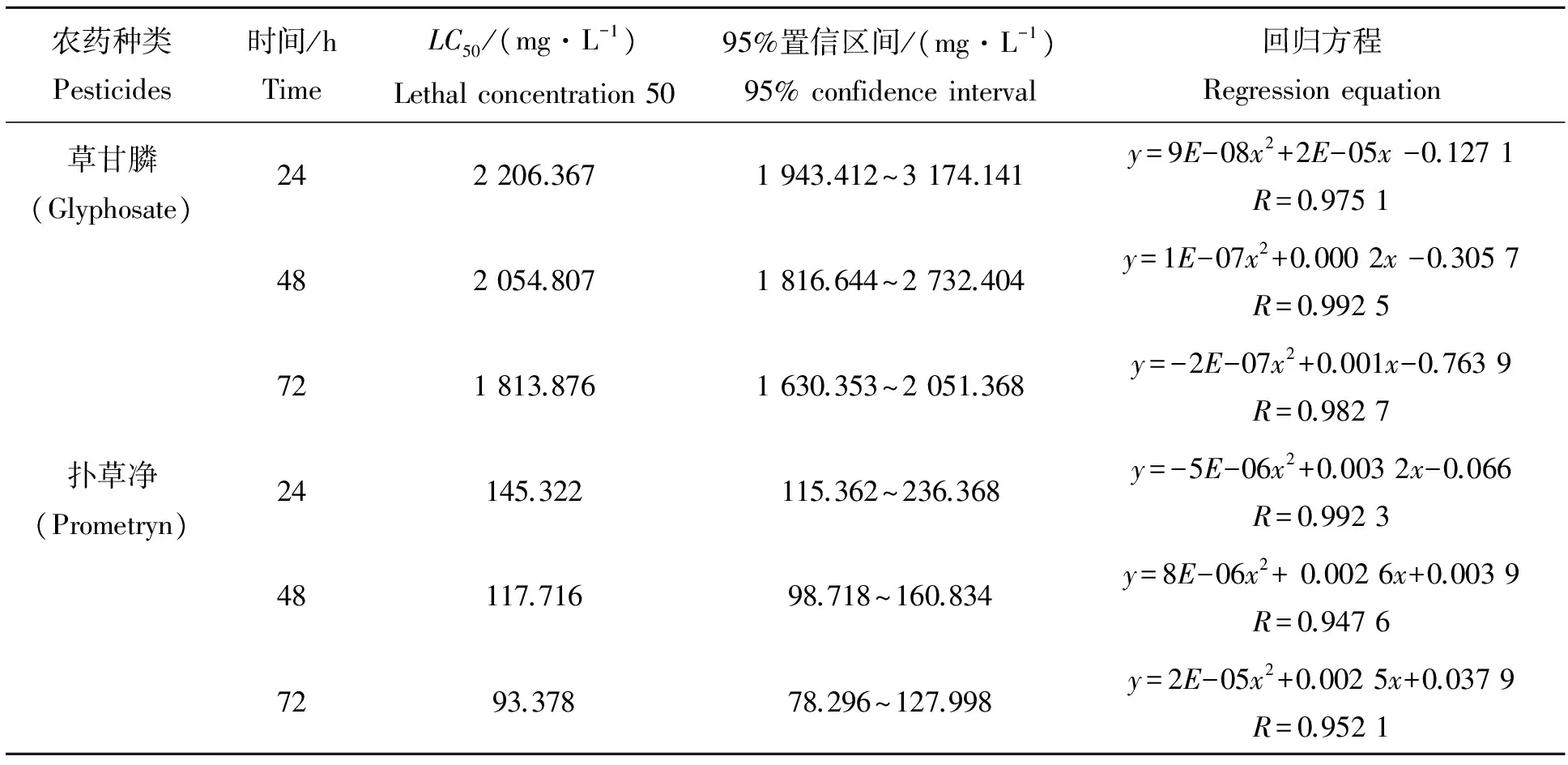
农药种类Pesticides时间/hTimeLC50/(mg·L-1)Lethalconcentration5095%置信区间/(mg·L-1)95%confidenceinterval回归方程Regressionequation草甘膦(Glyphosate)242206.3671943.412~3174.141y=9E-08x2+2E-05x-0.1271R=0.9751482054.8071816.644~2732.404y=1E-07x2+0.0002x-0.3057R=0.9925721813.8761630.353~2051.368y=-2E-07x2+0.001x-0.7639R=0.9827扑草净(Prometryn)24145.322115.362~236.368y=-5E-06x2+0.0032x-0.066R=0.992348117.71698.718~160.834y=8E-06x2+0.0026x+0.0039R=0.94767293.37878.296~127.998y=2E-05x2+0.0025x+0.0379R=0.9521
用SPSS软件将数据进行分析可以得到不同农药对蚯蚓的LC50[5]。数据见表1。表1中,不同种农药以及同种农药在不同时间内对蚯蚓具有不同的半致死剂量。根据上表草甘膦和扑草净对蚯蚓的LC50值,可知在相同时间内扑草净对蚯蚓致死毒性大于草甘膦。采用《化学农药环境安全评价试验准则》中建议的标准:LC50<1 mg/L为高毒农药,1~10 mg/L为中等毒农药,>10 mg/L为低毒农药[6],草甘膦和扑草净对蚯蚓的毒性值均>10 mg/L,所以两种农药对蚯蚓的毒性均为低毒。因此可以认为这两种农药在农田中使用对蚯蚓是相对安全的。
2.2 农药污染对蛋白含量的影响
图3中,在相同时间内,随草甘膦浓度的上升蚯蚓体内的蛋白含量呈明显的先上升后下降的趋势,且24 h时草甘膦浓度对蚯蚓体内蛋白含量的影响显著(P<0.05)。同时观察相同质量浓度不同时间,蚯蚓体内的蛋白含量也是随染毒时间的延长,出现先增加后减少的趋势。
图4中,扑草净的污染对蚯蚓体内蛋白含量的影响比较复杂,大致呈现出随浓度的升高,蚯蚓体内蛋白浓度先升高后降低的趋势,72 h时扑草净的污染对蚯蚓体内蛋白含量的影响显著(P<0.05)。而随着染毒时间的延长,蚯蚓体内蛋白含量呈现出小幅度的先上升后下降的趋势,规律性不是很明显。

图3 草甘膦单一作用对蚯蚓体内蛋白含量的影响Fig.3 Effects of glyphosate on protein contents of earthworm
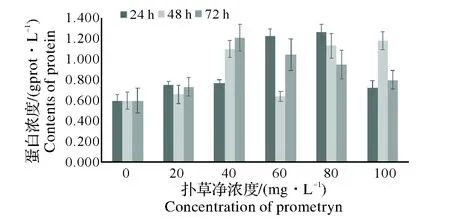
图4 扑草净单一作用对蚯蚓体内蛋白含量的影响Fig.4 Effects of prometryn on protein contents of earthworm
2.2.1 相关性分析 根据各图表可知,各实验组对蚯蚓体内蛋白含量的关系呈现出不同的变化趋势,回归法分析农药对蚯蚓体内蛋白含量的剂量-效应关系,如表2所示。表2中,由草甘膦和扑草净两种农药对蚯蚓体内蛋白含量的回归方程中的相关系数可以看出,扑草净的污染对蚯蚓蛋白质含量的影响高于草甘膦的污染。

表2 农药对蚯蚓体内蛋白含量影响关系曲线
2.3 对SOD酶活力的影响
图5中,草甘膦对蚯蚓体内SOD酶活性的影响较为复杂。24 h内,随浓度升高SOD酶活性先下降后在1 400 mg/L时上升到96 U/mgprot再下降;48 h时,酶活性随质量浓度的增加表现出先升高后降低再升高的趋势;72 h时,酶活性随质量浓度的上升表现出先升高后持续下降的趋势。图6中,在扑草净的作用下,相同时间内SOD酶活力随扑草净的浓度的增加逐渐降低。
2.3.3 相关性分析 根据各图表可知,各实验组对蚯蚓体内蛋白含量的关系呈现出不同的变化趋势,回归法分析农药对蚯蚓体内SOD酶活性的剂量-效应关系如表3所示,表3中展示了草甘膦对蚯蚓体内SOD酶活性影响的回归方程中的相关系数,在草甘膦的污染下,72 h时对蚯蚓体内SOD酶活性的影响大于24 h和48 h;草甘膦和扑草净两种农药比较之下,扑草净对蚯蚓SOD酶的影响大于草甘膦。
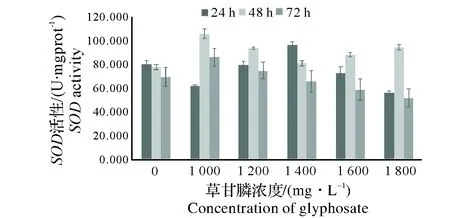
图5 草甘膦单一作用对蚯蚓体内SOD酶活力的影响Fig.5 Effect of glyphosate on SOD activity of earthworms
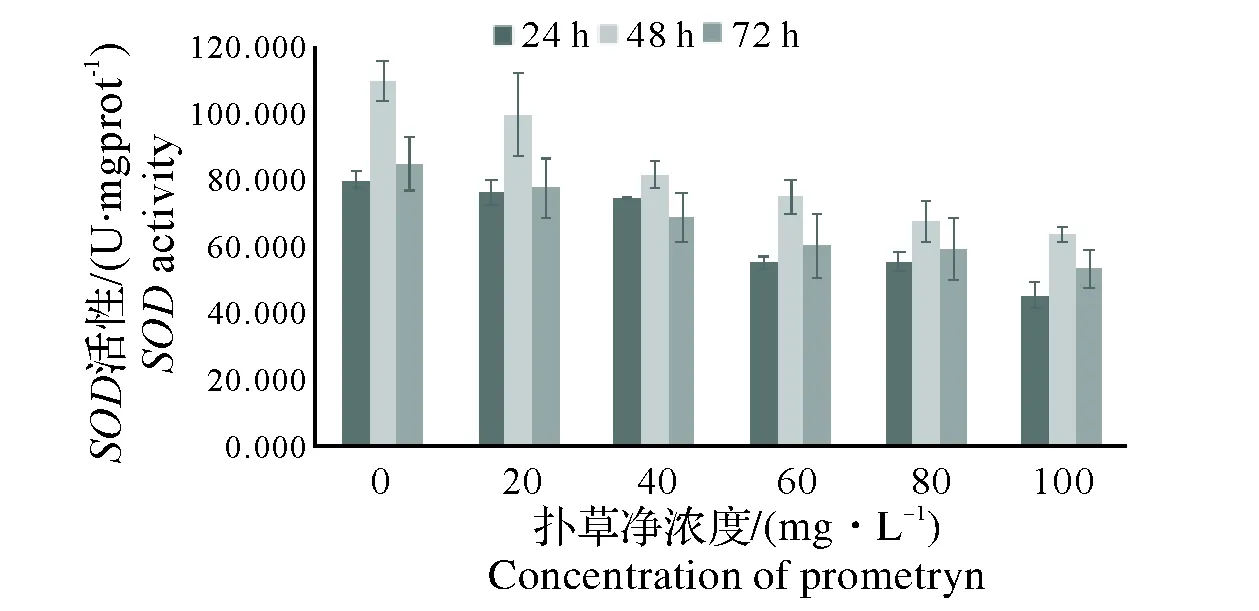
图6 扑草净单一作用对蚯蚓体内SOD酶活力的影响Fig.6 Effect of prometryn on SOD activity of earthworms

时间/hTime草甘膦Glyphosate扑草净Prometryn24y=-1E-05x2+0.0121x+78.24R=0.365y=-0.0011x2-0.2531x+81.346R=0.96148y=-1E-05x2+0.0305x+79.029R=0.612y=0.0032x2-0.7986x+111.21R=0.99472y=-3E-05x2+0.0395x+69.983R=0.962y=0.0017x2-0.4824x+85.548R=0.994
2.4 蚯蚓体内的AChE酶活力
2.4.1 草甘膦对蚯蚓体内AChE酶活力的影响 图7可见,草甘膦污染下,各质量浓度时蚯蚓体内的AChE酶活力均明显小于空白对照组,说明草甘膦对蚯蚓体内的AChE酶活力为抑制作用。
图8中可见,各质量浓度的扑草净中蚯蚓体内的AChE酶活力均小于空白对照组,说明扑草净对蚯蚓体内的AChE酶活力也为抑制作用。而随扑草净浓度的增加,蚯蚓体内AChE酶活力有持续升高的趋势。
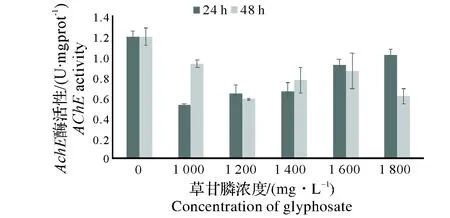
图7 草甘膦对蚯蚓体内AChE酶活力的影响Fig.7 Effect of Glyphosate on AChE activity of earthworms
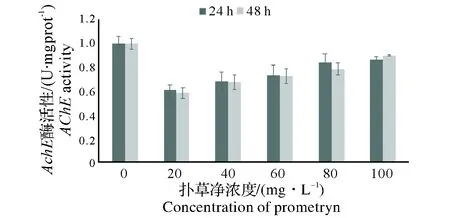
图8 扑草净对蚯蚓体内AChE酶活力的影响Fig.8 Effect of Prometryne on AChE activity of earthworms
2.4.3 相关性分析 表4可见,扑草净和草甘膦的污染对蚯蚓体内AChE酶活力影响的相关性高,且草甘膦的相关系数大于扑草净的相关系数,所以草甘膦污染的相关性大于扑草净。

表4 两种农药对蚯蚓体内AChE酶活力的回归方程
3 讨 论
3.1 草甘膦和扑草净两种农药单一作用对蚯蚓的毒性效应
由于不同种类型的农药具有不同的化学结构和作用机理,所以不同农药所引起的蚯蚓中毒症状不同,有机磷除草剂对蚯蚓具有较显著的生长毒性影响。研究表明:莎稗磷原药和草铵磷原药等13种除草剂可以使蚯蚓出现扭曲、伸长、变软、环带肿大充血、身体糜烂断裂等症状[7]。毒死蜱暴露8周后对蚯蚓生长有不利影响[8],而氯氰菊酯,百草枯中毒的典型症状之一就是蚯蚓体质量下降[9-10]。许多农药在低浓度下还能对蚯蚓的繁殖产生抑制作用[9]。本实验研究发现草甘膦单一污染后蚯蚓身体极度扭曲,身体表面渗出黄色液体,环节肿大甚至出现糜烂的现象,而扑草净污染后蚯蚓身体极度拉伸,甚至因为极度拉长出现身体断节的现象,身体表面渗出红色液体,头部和尾部出现膨大,并伴有恶臭。
3.2 草甘膦和扑草净对蚯蚓体内蛋白含量的影响
草甘膦和扑草净对蚯蚓体内蛋白含量大致表现为先升高后降低的趋势,相比之下草甘膦的趋势比较简单明显而扑草净的相对复杂。在草甘膦的污染下,蚯蚓体内的蛋白含量随染毒时间的延长表现出比较明显的先上升后下降的趋势。在扑草净的污染下,蚯蚓体内的蛋白含量随染毒时间的延长呈现出小幅度的先上升后下降的趋势,规律性不是很明显。出现该情况可能是由于蚯蚓染毒后,机体功能受到损伤,内环境紊乱,代谢活动出现异常,同时在污染的情况下,蚯蚓处于应激状态,机体产生应激蛋白,使得总蛋白含量有所增加。随浓度的增加和染毒时间的推移,经皮毒性加强,蚯蚓体内蛋白的生成来源遭到破坏,从而影响蛋白的合成,使总蛋白含量降低[11-12],而扑草净污染下的蛋白含量与草甘膦污染下的蛋白含量变化幅度比较,幅度较小的原因可能是由于农药的作用机理有所不同[13],而且生物体内的蛋白含量受多种因素变化的影响。
3.3 草甘膦和扑草净对蚯蚓体内SOD酶活性的影响
草甘膦对蚯蚓体内SOD酶活性影响较复杂,且规律性不明显,24 h低浓度时酶活性小幅度下降可能是因为草甘膦为有机磷除草剂,主要靠胃毒作用对蚯蚓产生毒害,使得对蚯蚓的SOD酶活力影响不大,另外由于农药自身的挥发、分解等作用,使低浓度组的SOD酶活力降低。随着时间推移,经皮毒性加强,胃毒作用开始发挥,机体为了维持自身氧化平衡,SOD酶被激发,使蚯蚓体内SOD酶活力开始出现上升趋势;48 h时,酶活性随草甘膦浓度的增加表现出先升高后降低再升高的趋势,先升高的原因可能是因为机体为了维持自身的氧化平衡激发了体内的SOD酶,而后出现下降的原因可能是因为蚯蚓接触草甘膦污染后,蚯蚓机体内环境稳态遭到破坏,随着农药浓度的升高,机体受损程度增强,体内的自稳机制被打乱,而导致SOD酶活力下降;72 h时,蚯蚓体内的SOD酶活力随草甘膦浓度的上升表现出先升高后持续下降的趋势,可能是由于蚯蚓机体严重受损,导致SOD酶活力持续下降;而扑草净的污染对蚯蚓体内的SOD酶活性的影响比较明显,相同时间的情况下,蚯蚓体内的SOD酶活性随着扑草净浓度的升高呈明显的下降趋势,而相同浓度不同时间方面观察,SOD酶活性呈现出先升高后下降的趋势,出现这种情况所可能的原因是,蚯蚓接触扑草净后,对机体造成损害,而随着胁迫强度的增强,机体受损程度也随之增强,使体内自稳机制紊乱,而导致酶活力下降。从相同浓度不同时间方面观察,酶活性呈现出先升高后下降的趋势。可能的原因是,在同种浓度的污染下,蚯蚓机体为了维持自身的氧化平衡激发了体内的SOD酶[14],从而导致在48 h时酶活性同比高于24 h时的酶活性,而72 h时,蚯蚓体内的SOD酶活性相比于48 h时有所降低,可能是因为扑草净的污染造成了蚯蚓机体的损伤,致使SOD酶活性降低。
3.4 草甘膦和扑草净对蚯蚓体内AChE酶活性的影响
两种农药对蚯蚓体内AChE酶活力均为抑制作用,孙维等[15]研究表明呋喃丹对蚯蚓体内AChE活性也具有较强抑制作用。但因农药的作用机理不同,所以抑制作用也不同。草甘膦属于有机磷类除草,其作用机理是抑制胆碱酯酶活性,使胆碱酯酶失去分解乙酰胆碱的能力,因而乙酰胆碱在体内积蓄过多而中毒[16],从而导致生理失调。但如果草甘膦在蚯蚓体内水解后,酶的活性能够得到一定的恢复,这可能是AChE酶活力有上升趋势的原因[13]。扑草净属于三嗪类选择性内吸传导型除草剂,主要作用于乙酰胆碱受体,抑制神经传导而使蚯蚓处于麻痹瘫痪状态,从而导致死亡。所以该农药对AChE酶没有较强的抑制作用,而是作用于乙酰胆碱受体最终导致死亡。
参考文献:
[1〗 胡玲,林玉锁.呋喃丹对赤子爱胜蚓体内蛋白质含量SOD和AChE活性的影响[J].安徽农业科学,2006,34(13):3165-3167.
Hu L,Lin Y S.Effect of carbofuranon protein content and theSODandAChEactivity of the eisenia foetida earthworm[J].Journal of AnHui Agricultural Sciences,2006,34(13):3165-3167.
[2] 许智芳,吴容.蚯蚓及其养殖[M].北京:科学出版社,1986.
Xu Z F,Wu R.Earthworms and breeding[M].Beijing:Science Press,1986.
[3] 郭永灿,王振中,赖勤,等.农药污染对蚯蚓的群落结构与超微结构影响的研究[J].中国环境科学,1997,17(1):67-71.
Guo Y C,Wang Z Z,Lai Q,et al.Effects of pesticide pollution on community structure and cell ultrastructure of earthworm[J].China Environmental Science,1997,17(1):67-71.
[4] OECD.Earthworm acute toxicity tests[Z].OECD Guideline for testing of chemicals,NO 207.1984.
[5] 王璐,王沁.SPSS统计分析基础、应用与实战精粹[M].北京:化学工业出版社,2012.
Wang L,Wang Q.The essence of the SPSS statistical analysis,application and actual use[M].Beijing:Chemical Industry Press,2012.
[6] 凌善锋.农药敌敌畏对泥鳅肌肉中水溶性蛋白质的影响及分析[J].水产科学,2004,23(2):20-21.
Ling S F.Dichlorvos of the effect and analyze on soluble protein inMisgurnusanguillicadatus’s muscle[J].Fisheries Science,2004,23(2):20-21.
[7] 王彦华,俞卫华,杨立之,等.22种常用除草剂对蚯蚓(Eiseniafetida)的急性毒性[J].生态毒理学报,2012,7(3):317-325.
Wang Y H,Yu W H,Yang L Z,et al.Acute toxicity of twenty-two commonly used herbicides to earthworm(Eiseniafetida)[J].Asian Joumal of Ecotoxicology,2012,7(3):317-325.
[8] Zhou S P,Duan C Q,Fu H.Toxicity assessment for chlorpyrifos-contaminated soil with three different earthworm test methods[J].Journal of Environmental Sciences,2007,19(7):854-858.
[9] 姜锦林,程燕,卜元卿,等.农药对蚯蚓的生长和繁殖毒性及其在生态风险评价中的应用[J].农药科学与管理,2014,35(9):23-32.
Jiang J L,Cheng Y,Bu Y Q,et al.Effects of pesticides on the growth and reproduction of earthworm and its application in ecological risk assessment[J].Pesticide Science and Administration,2014,35(9):23-32.
[10] Shahla Y,D’souza S.Effects of pesticides on the growth and reproduction of earthworm:a review[J].Applied and Environmental Soil Science,2010(3):1-9.
[11] 雷波,刘定安,黄树明.集成疗伤片对创伤患者血清急性期反应蛋白含量变化的影响[J].中医正骨,2005,17(1):10-11.
Lei B,Liu D A,Huang S M.The effect of integrated therapy tablets in trauma patients with acute phase serum reactive protein content changes[J].Palasy,2015,17(1):10-11.
[12] 凌善锋.农药敌敌畏对泥鳅肌肉中水溶性蛋白质的影响及分析[J].水产科学,2004,23(2):20-21.
Ling S F.Dichlorvos of the effect and analyze on soluble protein inMisgurnusanguillicadatus’s muscle[J].Fisheries Science,2004,23(2):20-21.
[13] 王希英,张国林,刘彦思.急性有机磷农药中毒患者血清前白蛋白的变化及临床意义[J].中国厂矿医学,2001,14(1):72-73.
Wang X Y,Zhang G L,Liu Y S.The change of serum prealbumin in patients with acute organophosphorus pesticide poisoning and the clinical significance[J].Chinese Factories and Medicine,2001,14(1):72-73.
[14] 黎瑞珍,杨庆建,陈贻锐.超氧化物歧化酶(SOD)活性的测定及其应用研究[J].琼州大学学报,2004,11(5):34-36.
Li R Z,Yang Q J,Chen Y R.Study of determination of superoxide dismutase activation and application[J].Journal of Qiongzhou University,2004,11(5):34-36.
[15] 孙维,林玉锁,胡玲.不同温度条件下呋喃丹对赤子爱胜蚓体内蛋白含量以及SOD和AChE活性的影响[J].生态与农村环境学报,2007,23(1):57-62.
Sun W,Lin Y S,Hu L.Effect of carbofuran on protein content,SODandAChEactivity of eisenia foetida under different temperatures[J].Journal of Ecology and Rural Environment,2007,23(1):57-62.
[16] 狄美凤,刘培凤.乐果中毒致心房颤动一例[J].内蒙古医学杂志,2005,37(6):502.
Di M F,Liu P F.Rogor poisoning lead atrial fibrillation[J].Inner Mongolis Medical Journal,2005,37(6):502.

