离子色谱法测定FAPAS比对肉粉样品中亚硝酸盐、硝酸盐含量
莫紫梅,杨 黎,郑娟梅*,陈宁周,王 警
(广西-东盟食品药品安全检验检测中心,广西 南宁 530021)
亚硝酸盐和硝酸盐常用于肉类腌制,其能保持肉类色泽、抑制微生物的生长以及产生特殊风味[1]。亚硝酸盐分解形成的一氧化氮与血红素反应生成亚硝基肌红蛋白,使腌制的肉类呈粉红色,是肉制品加工的发色剂,过量摄入可导致高铁血红蛋白血症[2]。亚硝酸盐与其他盐类结合则具有一定的抑菌作用,能够抑制碎肉罐头和腌肉中的梭状芽胞杆菌和金黄色葡萄球菌等[2-4]。亚硝酸盐能与食品中的有机胺类物质形成致癌性N-亚硝基化合物[1,3-5]。硝酸盐在口腔和肠道微生物作用下可转化为亚硝酸盐,亦可形成亚硝胺类物质,危害人体健康[1,5]。
GB 2760—2014《食品安全国家标准 食品添加剂使用标准》中规定,熟肉制品中硝酸钠(或硝酸钾)的最大使用量为0.5 g/kg,亚硝酸根的残留量(以亚硝酸钠计)≤30 mg/kg,成人摄入亚硝酸盐0.2~0.5 g就能造成中毒,摄入3 g就可造成死亡[5]。因此对腌肉制品中亚硝酸盐和硝酸盐含量的检测和控制非常必要。
目前,测定亚硝酸盐和硝酸盐的方法有气相色谱法[6]、紫外分光光度法[7-9]、荧光光度法[10]和离子色谱法[11-19]等。离子色谱法操作简便、快速、分辨率与准确度高,可同时测定多种离子,目前广泛应用于食品质量与安全分析中[17-21],如测定食品中的添加剂[22-27]、甜味剂[28-29]及其他组分[30-31]。
本研究采用抑制型电导法检测由FAPAS(Food Analysis Performance Assessment Scheme)提供的肉粉样品中的硝酸盐和亚硝酸盐,以氢氧化钾缓冲溶液作为淋洗液进行梯度洗脱,对经前处理的样品进样分析,将样品中的硝酸根和亚硝酸根与有机酸及其他常见阴离子进行分离。
1 材料与方法
1.1 材料与试剂
肉粉样品由FAPAS提供。
亚硝酸根离子标准溶液(质量浓度1 000 μg/mL,以) 国家有色金属及电子材料分析测试中心;硝酸根离子标准溶液(质量浓度1 000 μg/mL,以NO3-计)美国O2si公司;KOH淋洗液 美国Dionex公司;超纯水(电阻率18.2 MΩ·cm)。
1.2 仪器与设备
Dionex ICS-5000+离子色谱仪(配备Dionex AS自动进样器、四元梯度分析泵、淋洗液发生器、电导检测器、AERS 500(4 mm)阴离子抑制器、Chromeleon 7色谱工作站)、X3R高速冷冻离心机、Dionex OnGuardTMⅡRP柱(1 cc,使用前依次用10 mL甲醇、15 mL水静置活化30 min)、Dionex OnGuardTMⅡ Ag柱和Dionex OnGuardTMⅡNa柱(均为1 cc,使用前用10 mL水静置活化30 min) 美国Thermo Fisher公司;Milli-Q超纯水机 美国密理博公司;Mettler Toledo XS205DU电子天平(十万分之一) 瑞士梅特勒-托利多公司;S300H超声波清洗器 德国Elmasonic公司。
1.3 方法
1.3.1 离子色谱条件
色谱柱为D i o n e x I o n P a cTMA S 1 9阴离子柱(4 mm×250 mm);保护柱为Dionex IonPacTMAG19(4 mm×50 mm);淋洗液为KOH溶液,流速1.0 mL/min,梯度淋洗程序:0~21.0 min,12 mmol/L KOH;21.0~21.5 min,12~40 mmol/L KOH;21.5~27.5 min,40 mmol/L KOH;27.5~28.0 min,40~12 mmol/L KOH;28.0~35.0 min,12 mmol/L KOH;抑制器为AERS 500(4 mm),抑制电流100 mA;电导检测器;柱温30 ℃;进样量100 μL。
1.3.2 样品前处理
参照GB 5009.33—2016《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》[18],称取1.00 g试样于150 mL具塞锥形瓶中,加80 mL水,超声提取30 min,每隔5 min振摇1 次,保持固相完全分散;于75 ℃水浴中加热5 min,取出放置至室温,定量转移至100 mL容量瓶,定容,混匀,静置;将部分溶液转移至100 mL离心管中,于4 ℃、10 000 r/min条件下离心15 min,取上清液备用。
取上述上清液约15 mL,依次通过0.22 μm水性滤膜针头滤器、RP柱、Ag柱、Na柱,流速2 mL/min,弃去7 mL初始洗脱液后,收集洗脱液,注入样品管中直接进行色谱分析。
1.3.3 标准溶液的配制
分别取亚硝酸根离子标准溶液1.00 mL、硝酸根离子标准溶液5.00 mL于同一10 mL容量瓶中,用超纯水定容,得混合标准使用液,其中和的质量浓度分别为100、500 mg/L。
移取上述混合标准使用液0.10、0.50、1.00、2.00、4.00 mL,分别置于100 mL容量瓶中,超纯水稀释,配制成系列标准溶液,其中的质量浓度分别为0.10、0.50、1.00、2.00、4.00 mg/L,的质量浓度分别为0.50、2.50、5.00、10.00、20.00 mg/L。
1.3.4 标准曲线及回收率
将系列标准溶液按照优化所得色谱条件依次进样分析,以离子的质量浓度为横坐标,峰响应值为纵坐标绘制标准曲线。
精密称取样品1.0 g,加入一定量的混合标准使用液,按照优化所得条件测定亚硝酸盐和硝酸盐的平均回收率和相对标准偏差(relative standard deviation,RSD)。
2 结果与分析
2.1 色谱条件的优化
2.1.1 色谱柱的选择
考察Dionex IonPacTMAS19、AS15、AS11及AS11-HC 4 种不同柱容量分析柱对目标峰的分离效果。因样品基质复杂,在亚硝酸盐色谱峰前后存在未知峰干扰,后经实验证明为Cl-干扰,Dionex IonPacTMAS19、AS15、AS11色谱柱均能够达到分离度要求,综合考虑峰型对称、峰宽拖尾、分离度及分析时间等因素,选用Dionex IonPacTMAS19柱作为分析柱。Dionex IonPacTMAS19柱能大体积进样,可以将样品中的亚硝酸根离子和硝酸根离子与其他常见阴离子及有机酸良好分离,进行高浓度样品分析时不会出现过载和峰拖尾现象,可以使用较高浓度的氢氧根淋洗液,从而扩大梯度淋洗范围,满足本研究的要求。使用Dionex IonPacTMAS19柱对样品进行分离的色谱图如图1所示。
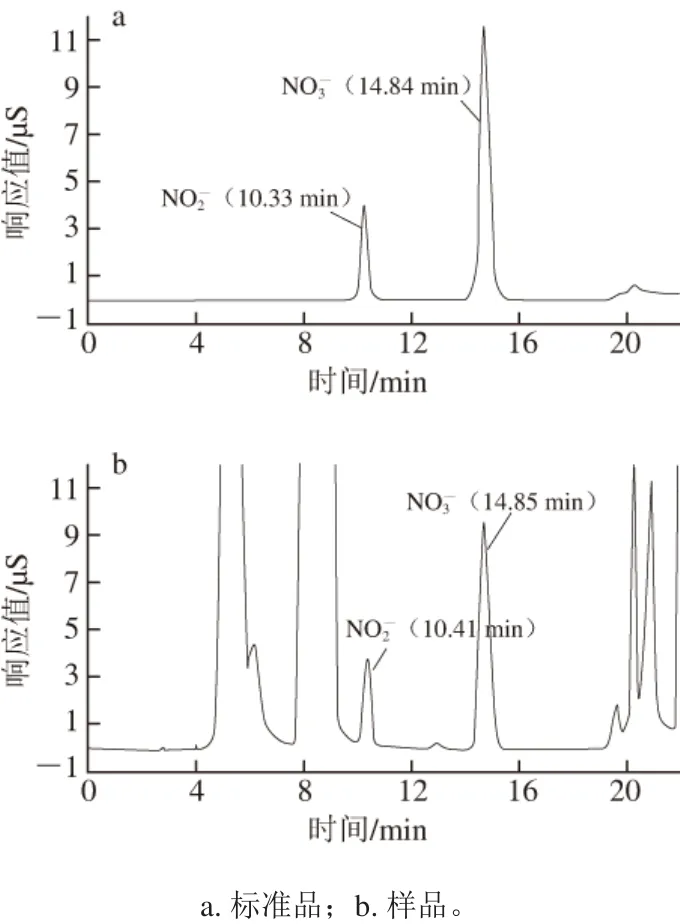
图1 标准品和样品的色谱图Fig. 1 Chromatograms of standard and sample
2.1.2 淋洗液浓度的选择
由于肉粉成分复杂,含有多种阴离子,采用等梯度洗脱难以使各种阴离子达到良好分离。分别考察12、10、8、6 mmol/L KOH淋洗液对干扰峰与目标峰的影响,最终选择淋洗液的浓度为:0~21.0 min,12 mmol/L KOH;21.0~21.5 min,12~40 mmol/L K O H;2 1.5~2 7.5 m i n,4 0 m m o l/L K O H;27.5~28.0 min,40~12 mmol/L KOH;28.0~35.0 min,12 mmol/L KOH。在此条件下,目标峰与干扰峰能较好分离。
2.1.3 抑制器电流的选择
抑制器电流会影响背景电导值,当背景电导值在1 μS以下时,可获得较好的色谱分析结果。因此,在上述淋洗液梯度条件下,考察电流强度为60、80、100、120 mA时背景电导值的大小。结果表明,抑制器电流为100 mA时,背景电导值在1 μS以下。
2.1.4 进样量的选择
考察25、50、100、250 μL的定量环,考虑到样品中亚硝酸盐、硝酸盐的含量差异以及标准检出限0.2、0.4 mg/kg的分析要求,最终选择进样量为100 μL。
综上所述,确定最佳色谱条件为:色谱柱Dionex Ion PacTMAS19阴离子柱(4 mm×250 mm);保护柱Dionex IonPacTMAG19(4 mm×50 mm);抑制电流100 mA;柱温30 ℃;进样量100 μL;流速1.0 mL/min,淋洗液梯度:0~21.0 min,12 mmol/L KOH;21.0~21.5 min,12~40 mmol/L KOH;21.5~27.5 min,40 mmol/L KOH;27.5~28.0 min,40~12 mmol/L KOH;28.0~35.0 min,12 mmol/L KOH。在此条件下,目标峰与干扰峰能得到较好分离。
2.2 样品前处理方法的优化
肉粉中含有蛋白质,能够水解出对色谱柱造成污染和伤害的水溶性蛋白质,严重影响仪器的使用寿命。因此,样品在经过RP柱后能有效去除水溶性的大分子物质。另外,肉粉、熟肉制品在加工过程中加入的食盐等调料会干扰被测离子,特别是亚硝酸根的测定。因此,本研究采用Ag柱、Na柱,可以有效去除样品中的金属离子及氯离子[21]。
比较超声时间分别为20、25、30、35 min的效果,结果表明,超声时间为30 min时,亚硝酸盐和硝酸盐的含量达到稳定,因此选择超声时间为30 min。另外,考察样品未水浴、75 ℃水浴3 min、75 ℃水浴5 min及75 ℃水浴10 min几种前处理方式的效果,结果表明,75 ℃水浴5 min时,亚硝酸盐和硝酸盐的含量达到稳定,如表1所示。
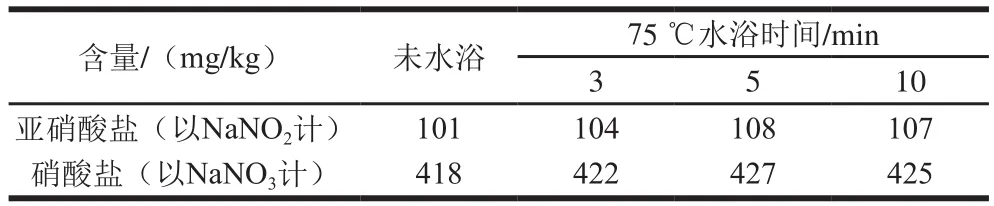
表1 不同前处理条件下亚硝酸盐和硝酸盐的含量Table 1 Contents of nitrite and nitrate under different pretreatment conditions
2.3 标准曲线及回收率
将系列标准溶液按照优化所得色谱条件依次进样分析,以离子的质量浓度为横坐标,峰响应值为纵坐标绘制标准曲线,亚硝酸根和硝酸根的线性方程依次为y=0.865x-0.010、y=0.697x-0.057,相关系数均为0.999 9。
由表2~3可知,亚硝酸盐(以NaNO2计)的平均回收率为99.53%,RSD=0.60%,硝酸盐(以NaNO3计)的平均回收率为99.29%,RSD=0.25%,这表明该测定方法的准确度和精密度较好。
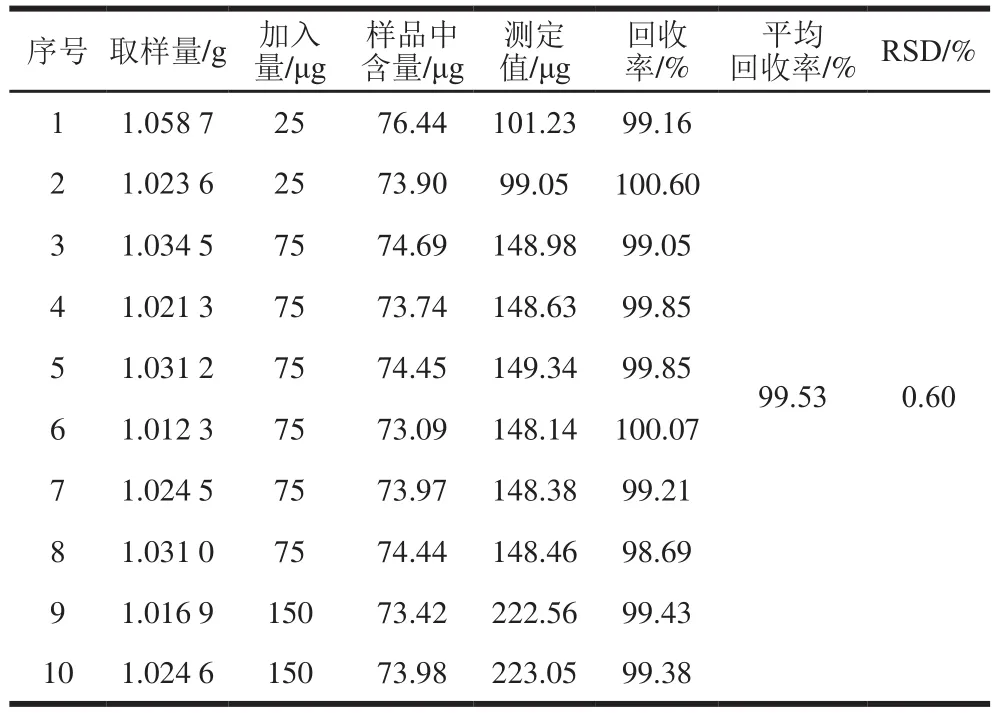
表2 亚硝酸盐(以NaNO2计)的回收率测定结果(n=9)Table 2 Recoveries of nitrite (NaNO2) in spiked samples (n= 9 )
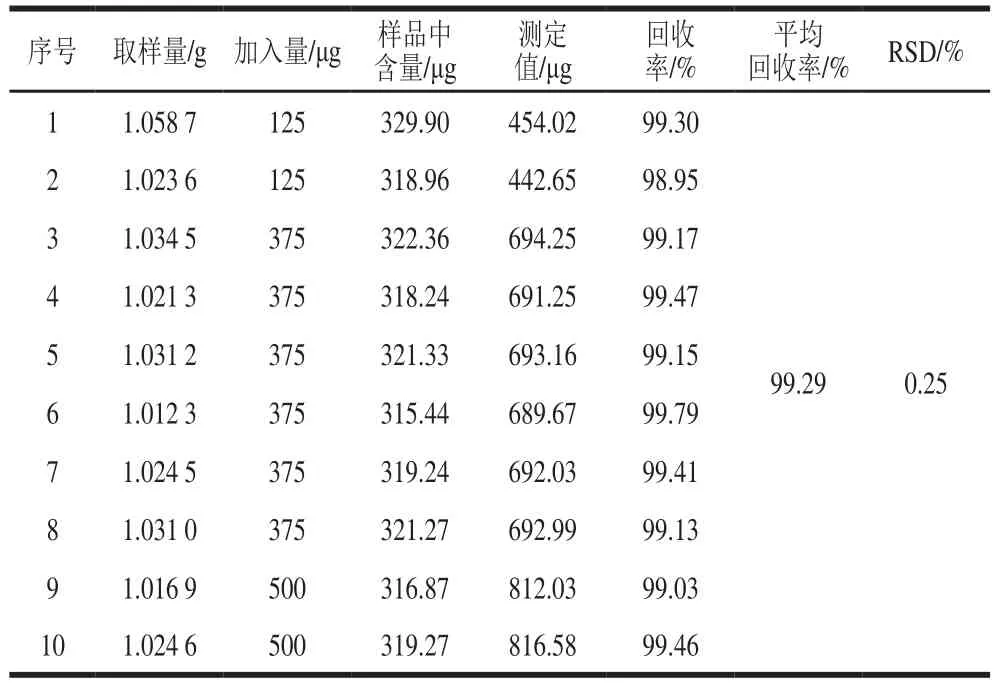
表3 硝酸盐(以NaNO3计)的回收率测定结果(n= 9)Table 3 Recoveries of nitrate (NaNO3) in spiked samples (n= 9)
2.4 样品测定结果

表4 FAPAS比对样品中亚硝酸盐和硝酸盐的测定结果Table 4 Contents of nitrite (NaNO2) and nitrate (NaNO3) of FAPAS sample determined by ion chromatography
由表4可知,FAPAS比对样品中亚硝酸盐(以NaNO2计)的含量为108.3 mg/kg,硝酸盐(以NaNO3计)含量为426.9 mg/kg,而参加此次FAPAS比对的83 家实验室的样品测定平均值为:亚硝酸盐(以NaNO2计)111.0 mg/kg,硝酸盐(以NaNO3计)428.0 mg/kg。本次比对结果为“满意”,亚硝酸盐(以NaNO2计)测定结果偏离Z值为-0.2,硝酸盐(以NaNO3计)测定结果偏离Z值为0.0(“满意”要求∣Z∣≤2),表明本研究确定的方法科学、可靠、精准。
3 结 论
本研究采用离子色谱法同时测定熟肉制品的亚硝酸盐和硝酸盐含量,所确定的前处理方法能够有效去除样品中的无机阴离子、阳离子及有机成分的干扰,测定结果可靠,具有一定的应用价值。
参考文献:
[1] 谢笔钧. 食品化学[M]. 3版. 北京: 科学出版社, 2011: 378; 524.
[2] 高蕾蕾, 李迎秋. 亚硝酸盐在肉制品加工中的应用研究[J]. 江苏调味副食品, 2017(3): 34-37. DOI:10.16782/j.cnki.32-1235/ts.2017.03.010.
[3] 孙迪, 张志国. 低硝肉制品研究进展[J]. 中国调味品, 2016, 41(6):156-160. DOI:10.3969/J.ISSN.1000-9973.2016.06.036.
[4] 刘姝韵, 谷大海, 王桂瑛, 等. 肉制品中亚硝酸盐替代物的研究进展[J].食品安全质量检测学报, 2017, 8(12): 4582-4587.
[5] 徐淼, 张倩男, 杨辉, 等. 亚硝胺及前体化合物的致癌效应及其食用安全性研究进展[J]. 癌变·畸变·突变, 2018, 30(1): 76-79.DOI:10.3969/j.issn.1004-616x.2018.01.015.
[6] 何浩, 陈幸莺, 孙映球, 等. 顶空-气相色谱法测定食品中亚硝酸盐[J]. 安全与检测, 2017, 33(1): 55-58. DOI:10.13652/j.issn.1003-5788.2017.01.012.
[7] 刘辉, 巫永华, 秦杰, 等. 超声微波协同萃取-双波长分光光度法测定食品中亚硝酸盐含量[J]. 中国调味品, 2016, 41(9): 126-130.DOI:10.3969/j.issn.1000-9973.2016.09.028.
[8] 陈霞, 李存英, 范雯婷, 等. 分光光度法测定火腿肠中亚硝酸盐含量的研究[J]. 现代食品, 2017(17): 100-102. DOI:10.16736/j.cnki.cn41-1434/ts.2017.17.033.
[9] 卞玲娟, 何浩. 改进分光光度法测定食品中的亚硝酸盐含量[J]. 食品安全质量检测学报, 2017, 8(4): 1490-1493.
[10] 肖江雨, 王焱, 刘婉, 等. 牛奶与乳饮料中痕量亚硝酸盐的快速荧光检测法[J]. 现代预防医学, 2016, 43(23): 4362-4364.
[11] 刘玉秀, 崔晓青, 陈朝晖, 等. 离子色谱法测定果酱中的硝酸根和亚硝酸根[C]//第七届全国仪器分析及样品预处理学术研讨会论文集.烟台: 中国化学会, 2013: 110-113.
[12] 于海英, 李启艳, 王小兵, 等. 离子色谱法测定熟肉制品中溴酸根、亚硝酸根、硝酸根含量[J]. 药学研究, 2015, 34(4): 206-208.DOI:10.13506/j.cnki.jpr.2015.04.007.
[13] 史乃捷, 巢静波. 离子色谱法测量硝酸根和亚硝酸根国际比对研究[J]. 分析试验室, 2014, 33(8): 967-971. DOI:10.13595/j.cnki.issn.1000-0720.2014.0227.
[14] 崔晓青, 姚超, 姜芳, 等. 离子色谱法检测牛奶亚硝酸与盐硝酸盐[J].轻工科技, 2013(9): 13-14.
[15] 冀春苗. 免试剂离子色谱法测定污水处理厂出水中氟、氯、亚硝酸根、硫酸根、硝酸根离子的含量[J]. 化学分析计量, 2012, 21(3):65-68. DOI:10.3969/j.issn.1008-6145.2012.03.017.
[16] 郑雯, 李世杰, 彭玉. 奶粉中亚硝酸根和硝酸根的离子色谱测定方法[J]. 河南预防医学杂志, 2017, 28(6): 428-431. DOI:10.13515/j.cnki.hnjpm.1006-8414.2017.06.008.
[17] 沈银梅, 白婕. 离子色谱法测定卤肉制品中亚硝酸盐和硝酸盐[J].肉类工业, 2016(12): 41-43.
[18] 中华人民共和国卫生部. 食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定: GB 5009.33—2016[S]. 北京: 中国标准出版社, 2016.
[19] 程慰先. 离子色谱法改进后检测肉制品中亚硝酸盐含量[J]. 河南预防医学杂志, 2016, 27(8): 592-593; 636. DOI:10.13515/j.cnki.hnjpm.1006-8414.2016.08.012.
[20] 彭蔚, 杨敏, 王林. 离子色谱法分析食用油中亚硝酸盐与硝酸盐[J].河南预防医学杂志, 2017, 28(4): 275-276. DOI:10.13515/j.cnki.hnjpm.1006-8414.2017.04.011.
[21] 王娜妮, 寿旦, 张嘉捷, 等. 样品前处理-离子色谱法应用于食品分析的研究进展[J]. 食品安全质量检测学报, 2014, 5(5): 1287-1297.
[22] 陈玲, 结莉, 王晓鹏. 离子色谱法在食品添加剂检测中的应用分析[J]. 现代食品, 2017(4): 58-59. DOI:10.16736/j.cnki.cn41-1434/ts.2017.04.023.
[23] 许晶冰, 蔡灵利, 毛庆. 离子色谱法测定肉制品中5 种食品添加剂[J].理化检验-化学分册, 2017, 53(12): 1419-1422. DOI:10.11973/lhjyhx201712012.
[24] 李海东, 单美娜, 杨剑业, 等. 固相萃取-离子色谱法检测面及面制品中溴酸盐方法的建立[J]. 中国卫生检验杂志, 2015, 25(23):4038-4040.
[25] 陈志涛, 张睿, 郑香平, 等. 离子色谱法测定葡萄酒中的山梨酸和苯甲酸的含量[J]. 理化检验-化学分册, 2015, 51(12): 1658-1660.DOI:10.11973/lhjy-hx201512006.
[26] 刘素娟, 邵艳秋, 韩小青, 等. 离子色谱法快速分离八种阴离子和添加剂的研究[J]. 黑龙江畜牧兽医, 2017(12): 252-255. DOI:10.13881/j.cnki.hljxmsy.2017.2210.
[27] 徐咏薇, 李静, 刘红英. 液态食品中三种甜味剂和两种防腐剂的离子色谱测定法[J]. 环境与健康杂志, 2010, 27(6): 530-532.DOI:10.16241/j.cnki.1001-5914.2010.06.009.
[28] 卜宇宏, 李明, 李静. 离子色谱测定白酒中甜蜜素、糖精钠和安赛蜜[J]. 酿酒, 2011, 38(5): 71-73.
[29] 赵士权, 查河霞. 离子色谱法测定食品中的安赛蜜含量[J]. 食品安全质量检测学报, 2016, 7(5): 1840-1843.
[30] 肖宇, 唐莉, 庄莉, 等. 离子色谱法在食品检测中的应用进展[J]. 检验检疫学刊, 2017, 27(6): 64-66.
[31] 杜利君, 刘晓琳, 李晓雨, 等. 分散固相萃取-离子色谱质谱法测定乳制品中硫氰酸盐含量[J]. 中国食品添加剂, 2017(6): 190-194.

