基于肝微粒体和指纹图谱研究六味地黄丸与硝苯地平的药物相互作用
郑 梅,刘富垒,薛敬伟,柳文媛*
(1药物质量与安全预警教育部重点实验室(中国药科大学),南京210009;2山东省泰安市中心医院,泰安271000)
六味地黄丸是中国传统名方,最早记录于宋代太医钱乙的《小儿药证直诀》。据《中华人民共和国药典》(2015版)记载,六味地黄丸由熟地黄、酒萸肉、山药、牡丹皮、茯苓和泽泻按 8∶4∶4∶3∶3∶3的比例组成[1]。其中,熟地黄为君药,具有滋阴补血、益肾添精的功效;酒萸肉抗炎抗菌,养肝涩精;山药能健脾胃,养肺肾;此三味药材形成“三补”。牡丹皮具有清热止血、活血化瘀等作用;茯苓具有降血糖、镇静等功效;泽泻能利尿降脂、调节免疫;此三味药材形成“三泻”。六味药材共同使用,三补三泻,可以滋阴补肾、清肝利胆[2]。
高血压肾虚的主要病理生理学基础是肾素-血管紧张素-醛固酮系统(RAAS)亢进,补肾方药可以通过抑制RAAS系统达到降压的目的[3]。六味地黄丸通过抑制RAAS系统以及改善血管内皮功能等机制达到平稳降压的作用[4]。因此,六味地黄丸作为常用方剂联合西药治疗高血压的情况日益增多。郭意欣等[5]就“六味地黄丸联合西药治疗高血压”的大量临床报道进行了Meta分析和系统评价,表明六味地黄丸联合西药治疗高血压患者总体疗效优于单纯西药组。然而,六味地黄丸与降压药物联用是否会发生药物的相互作用,影响六味地黄丸活性成分的代谢,甚至产生不良反应,仍需要进一步的研究。
目前,关于药物相互作用研究主要是采用多种分析技术,如气相色谱串联质谱(GC-MS/MS)[6],高效液相色谱串联质谱(HPLC-MS/MS)[7]和超高效液相色谱串联质谱(UPLC-MS/MS)[8]测定联用前后化学药物或者其靶标底物的变化进行相互作用评价。在中药与化学药物联用中,化学药物对中药的相互作用尚无很好研究策略。采用体内评价方法不仅价格昂贵,而且耗时长。因此,非常需要建立体外的快速筛查方法,评价临床联用的化学药物对中药的影响作用。文献报道六味地黄丸中的多种成分的体内处置与药物代谢酶有关,包括六味地黄丸中5-羟甲基糠醛(5-HMF)能被细胞色素P450(CYP450)酶包括 CYP1A1,CYP1A2,CYP2B6和 CYP3A4代谢[9];20%马钱苷(LG)在大鼠肝微粒体中的可被代谢[10];芍药苷(PF)可由多个 CYP同工酶包括 CYP2C9、CYP3A4和 CYP2C8代谢[11]。根据当前高血压临床用药特点,本研究以六味地黄丸与硝苯地平为对象,建立体外快速评价相互作用的方法,并通过在体动物试验进行验证,以期为临床安全合理用药警示提供方法依据。
1 材 料
1.1 药品与试剂
六味地黄浓缩丸(批号150702,河南省宛西制药股份有限公司);对照品 5-羟甲基糠醛(5-HMF)、马钱苷(LG)和芍药苷(PF)和硝苯地平购自上海源叶生物科技有限公司,纯度均在98%以上;还原型辅酶Ⅱ(NADPH,含量≥98%,规格500 mg/瓶,编号10621706001,上海罗氏制药有限公司);甲醇、乙腈(色谱纯,美国Merck公司),水为纯化水;其余试剂均为市售分析纯。
1.2 仪 器
LC-20AT高效液相色谱仪(日本岛津公司);Agilent Triple Quad LC/MS 6420质谱仪(美国安捷伦科技公司);AB135-S型电子分析天平(瑞士Mettler Toledo公司)。
1.3 动 物
清洁级SD大鼠18只,雄性,体重180~220 g,由浙江省实验动物中心提供,合格证号:SCXK(浙)2014-0001。大鼠饲养于恒温(23~26℃)、相对湿度为(40%~60%)环境中;12 h光照和黑暗循环;自由饮水;喂食标准饲料。在试验前适应性喂养1周。
2 方 法
2.1 溶液的制备
供试品溶液的制备 取六味地黄丸粉末约1.2 g,加 60%甲醇25 mL,超声提取 30 min,放至室温,补足减失的重量,摇匀,经微孔滤膜滤过,取续滤液,作为供试品溶液。
对照品溶液的制备 分别取5-HMF、LG和PF对照品各适量,精密称定,用甲醇溶解并稀释,制成质量浓度为1 mg/mL的混合对照品溶液。另取硝苯地平对照品适量,精密称定,用甲醇溶解并稀释,制成质量浓度为1 mg/mL的硝苯地平对照品溶液。
2.2 大鼠肝微粒体的制备
取SD雄性大鼠6只,体重(200±20)g,禁食24 h后,股动脉放血处死,取肝脏,吸干水分,用4℃磷酸盐缓冲溶液中清洗至无血色;在冰板上剪碎,按每克肝组织3 mL的比例加磷酸盐缓冲溶液,在冰浴中匀浆;4℃下1 200 r/min离心20 min;弃去沉淀,上清液除去表层脂质后,在4℃下13 300 r/min离心 60 min,沉淀即为肝微粒体,将肝微粒体沉淀物悬浮于30%甘油磷酸缓冲液中,轻轻吹打悬匀。保存于-80℃。试剂盒测定微粒体的蛋白含量。
2.3 肝微粒体代谢条件
温孵实验分别设置3组:六味地黄丸单独孵育组、硝苯地平单独孵育组和六味地黄丸与硝苯地平共同孵育组。肝微粒体体外孵育系统包含肝微粒体混悬液 1 mg/mL、MgCl2溶液 4 mmol/L、磷酸盐缓冲溶液100 mmol/L(pH 7.4),及供试品溶液(六味地黄丸质量浓度50μg/mL,硝苯地平质量浓度10μg/mL)。反应体系先放置于37℃恒温水浴5 min,预热孵育液,然后再加入10 mmol/LNADPH溶液启动反应。总体积为1 000μL。孵育时间为60min时,向孵育系统中加入冰乙腈3mL沉淀,涡旋约3min,再4℃、16 000 r/min离心10min,取上清液于空气流下挥干,用60%甲醇溶液100μL复溶,离心取上清液进行HPLC分析。
2.4 高效液相色谱条件
色谱柱:ODS-2 C18(4.6 mm×250 mm,5μm),流动相:乙腈为A,0.1%甲酸水溶液为流动相B,梯度洗脱程序:0~3min 95%B,3~28 min 95%~78%B,28~42 min 78% ~40%B,42~53 min 40%~25%B,53~60 min 25%~10%B。检测波长为240 nm,柱温30℃,流速1 mL/min,进样体积20μL。
2.5 肝微粒体活性
CYP3A是CYP450酶中参与口服药物首过效应的主要酶系,在临床上约有60%的药物经由CYP3A代谢。本实验选取CYP3A的底物硝苯地平来考察CYP450酶的活性。实验分为肝微粒体灭活组及样品组。灭活组为肝微粒体先在沸水浴中保持10 min以使肝微粒体失活后再加入10μg/mL硝苯地平对照品溶液孵育。样品组按照本实验“2.3”项体外肝微粒体孵育条件加入同样浓度的硝苯地平孵育,检测原药硝苯地平的减少量来判断肝微粒体酶活性的大小。
2.6 指纹图谱测定的方法学考察
2.6.1 专属性 制备空白肝微粒体孵育液(不加底物)、只加六味地黄丸的孵育液和加入六味地黄丸和硝苯地平的孵育液,按照指纹图谱的测定方法测定,比较三者指纹图谱来考察方法的专属性。
2.6.2 线性关系 取混合对照品溶液,加甲醇稀释制成质量浓度依次为 5,8,10,12,20μg/mL的系列标准溶液,按照“2.3”项下方法温孵,按照指纹图谱的测定方法测定。以待测物的峰面积(y)对孵育液中待测物的质量浓度(x)进行回归拟合,得到3种活性成分的回归方程和相关系数。
2.6.3 精密度和准确度 取低、中、高质量浓度(8、10、12μg/mL)混合对照品溶液,每个质量浓度配制5份样品,按照“2.3”项下方法温孵,测定指纹图谱,连续测定3 d,计算日内和日间精密度及准确度。
2.6.4 提取回收率 取低、中、高质量浓度(8、10、12μg/mL)混合对照品溶液各5份,按照“2.3”项下方法温孵,测定指纹图谱,记录待测物峰面积A1,另取低、中、高质量浓度(8、10、12μg/mL)混合对照品溶液各5份,不加肝微粒体,同上法操作,记录待测物峰面积A2。提取回收率 =(A1/A2)×100%,分别计算待测物的提取回收率。
2.7 体内药代动力学实验
参照文献[12],采用 LC-MS/MS测定六味地黄丸和硝苯地平联用前后,5-HMF、LG和PF在大鼠体内的药代动力学特征。方案如下:将18只大鼠随机分成3组,第1组单独给5 g/kg六味地黄丸,第2组单独给10 mg/kg硝苯地平,第3组同时给5 g/kg六味地黄丸和10 mg/kg硝苯地平,分别于0.083,0.25,0.5,0.75,1,1.5,2,4,6,8,12和 24 h从眼眶静脉丛取大鼠静脉血测定。
2.8 数据分析
采用国家药典委员会发布的《中药色谱指纹图谱相似度评价系统(2012版)》软件计算指纹图谱的相似度。同时采用Statistics(DAS)软件(Version 2.1),用非房室模型对药代动力学程序进行数据处理,计算药代动力学参数,主要参数包括血药浓度-时间曲线下面积(AUC)、血浆消除半衰期(t1/2)、达峰时间(tmax)和达峰浓度(cmax)等。
3 结 果
3.1 肝微粒体活性
硝苯地平在肝微粒体灭活组及样品组孵育后的色谱图见图1。实验结果表明,硝苯地平经体外肝微粒体代谢量近42%,证明该微粒体有活性。受内源性物质的干扰,专属性良好。结果表明本方法具有较高的特异性,能准确测定肝微粒孵育液中待测物的浓度。
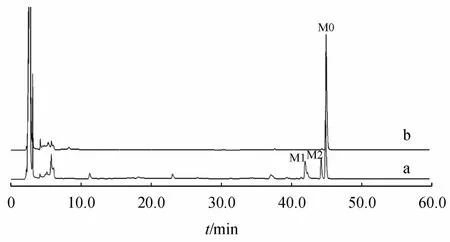
Figure 1 HPLC fingerprinting chromatograms of nifedipine(NIF)in active rat livermicrosomes(a)and inactivated rat livermicrosomes(b)M0:NIF;M1,M2:Metabolites
3.2 肝微粒体代谢指纹图谱对比
六味地黄丸单独孵育、硝苯地平单独孵育和六味地黄丸与硝苯地平共同孵育的指纹图谱见图2。扣除硝苯地平峰,计算六味地黄丸单独孵育和六味地黄丸与硝苯地平共同孵育的指纹图谱的相似度为0.983。同时对温孵前后各主要成分进行半定量测定,计算了它们的代谢百分率,结果见表1。表明六味地黄丸与硝苯地平共同孵育时,六味地黄丸中活性成分与单独孵育时相比代谢量无明显的变化;而硝苯地平的代谢量比单独孵育时明显减少。
3.3 方法学验证
空白肝微粒体孵育液、六味地黄丸的孵育液和加入六味地黄丸和硝苯地平的孵育液的典型色谱图见图3。在本实验条件下,待测物色谱峰形良好,不
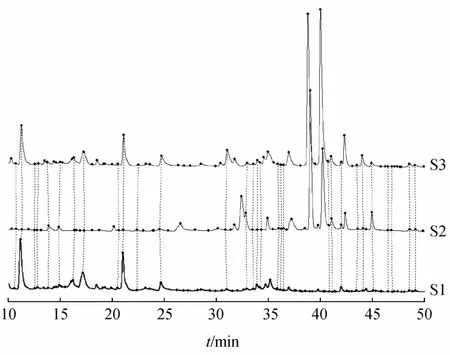
Figure 2 HPLC fingerprinting chromatograms of Liuwei Dihuang Pills(LDP)and NIF incubated alone or co-incubated in rat livermicrosomes S1:LDP;S2:NIF;S3:LDP and NIF
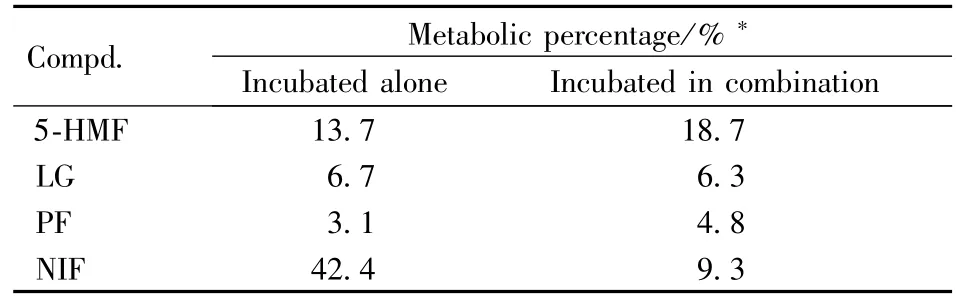
Table 1 Metabolic percentage(%)of components of LDP and NIF in livermicrosomes(n=3)
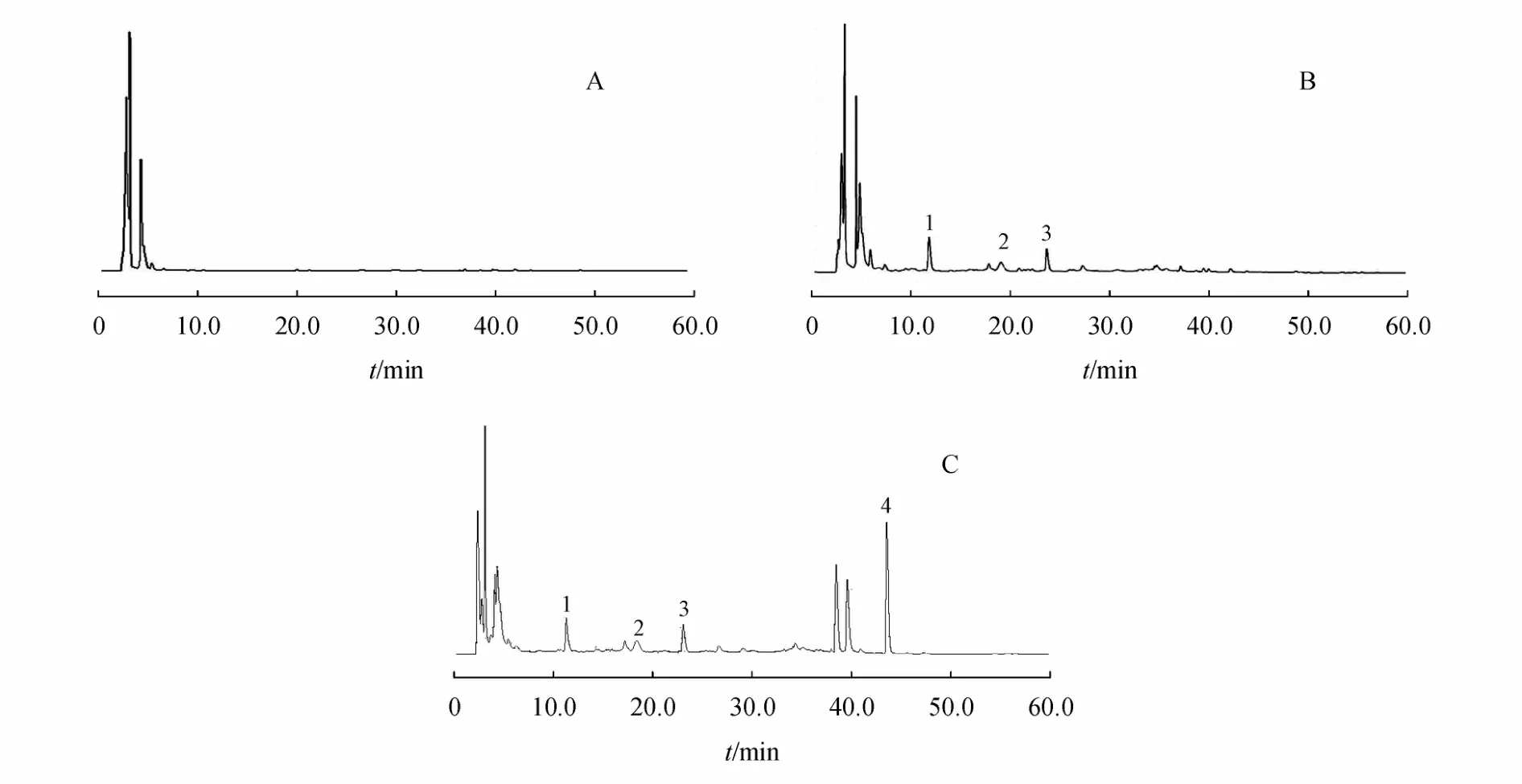
Figure 3 HPLC chromatograms of blank liver blank samples(A),single samples(B),combination samples(C)1:5-HMF;2:LG;3:PF;4:NIF
结果显示,在建立的试验条件下六味地黄丸中5-HMF、LG和 PF分别在 3.18~12.72μg/mL、0.91~3.64μg/mL和 0.45~1.82μg/mL的浓度范围内线性关系良好,回归方程分别为:5-HMF:y=67 055x+22 367,r2=0.996 7;LG:y=46 795x-39 574,r2=0.994 9;PF:y=12 978x+55 726,r2=0.997 9。精密度和准确度试验结果见表2,5-HMF、LG和PF的低、中、高3个水平的日内、日间精密度RSD均小于11.30%,准确度(RE%)在-11.56%~9.94%之间,符合生物样品的分析检测要求。
提取回收率试验结果表明,在低、中、高3个质量浓度水平六味地黄丸中5-HMF、LG和PF分别的提取回收率分别为:5-HMF:102.21%、92.45%、107.79%;LG:93.94%、100.58%、105.98%;PF:88.83%、87.23%、89.73%;均在 85% ~115%之间,符合生物样品定量测定的要求。
3.4 大鼠药代动力学LC-MS/MS方法验证与结果
本研究参照文献[11]采用LC-MS/MS测定六味地黄丸和硝苯地平联用前后5-HMF、LG和PF在大鼠体内的药代动力学特征,并对方法学进行验证,结果如表3和表4。结果可见,该方法符合生物样本分析的要求。
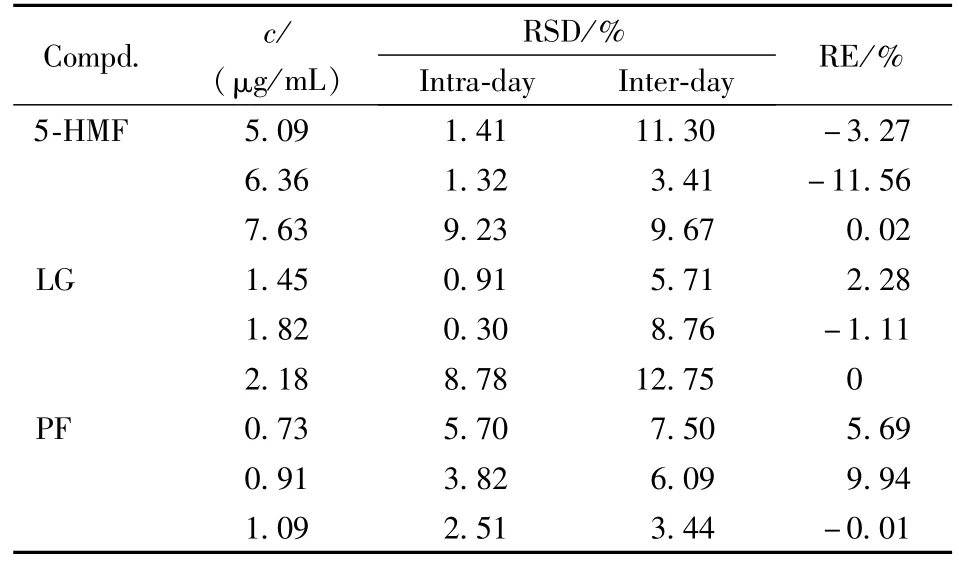
Table2 Precision and accuracy for5-HMF,LG and PF in rat livermicrosomes(n=5)

Table 3 Precision and accuracy for the analytes in rat plasma analyzed by LC-MS/MS(n=6)
Table 4 Recovery and matrix effect for the analytes in rat plasma analyzed by LC-MS/MS
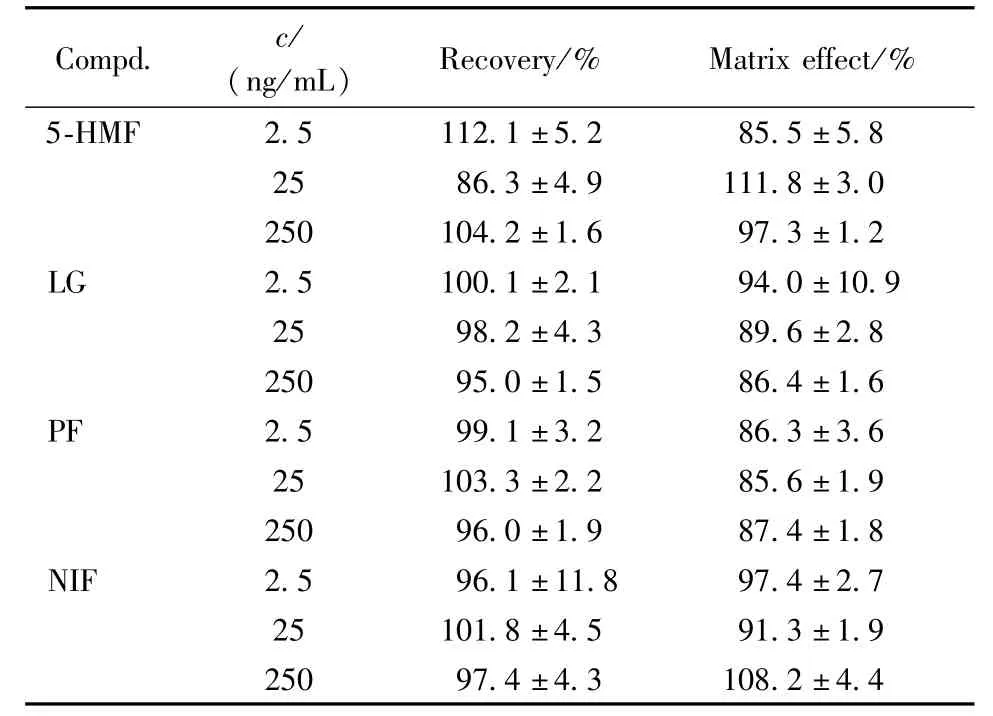
Table 4 Recovery and matrix effect for the analytes in rat plasma analyzed by LC-MS/MS
Compd. c/(ng/mL)Recovery/% Matrix effect/%5-HMF 2.5 112.1±5.2 85.5±5.8 25 86.3±4.9 111.8±3.0 250 104.2±1.6 97.3±1.2 LG 2.5 100.1±2.1 94.0±10.9 25 98.2±4.3 89.6±2.8 250 95.0±1.5 86.4±1.6 PF 2.5 99.1±3.2 86.3±3.6 25 103.3±2.2 85.6±1.9 250 96.0±1.9 87.4±1.8 NIF 2.5 96.1±11.8 97.4±2.7 25 101.8±4.5 91.3±1.9 250 97.4±4.3 108.2±4.4
六味地黄丸单独给药和联合硝苯地平给药后,六味地黄丸3种主要成分的药代动力学参数见表5,血药浓度曲线见图4。结果显示,单独给药时,硝苯地平的峰浓度为(1 075.33±328.98)μg/L,达峰时间为(1.50±1.30)h;联合给药时,硝苯地平的峰浓度为(242.08±29.03)μg/L,达峰时间为(4.67±3.65)h,可见与六味地黄丸共同孵育,硝苯地平的AUC显著降低、tmax延长。而六味地黄丸的主要成分单独给药与联合给药的药代动力学参数未发生明显的变化(P>0.05)。
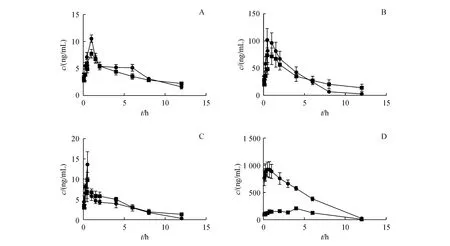
Figure 4 Mean plasma concentration-time profiles of the analytes in ratsafter oral administration of LDP(5.0 g/kg)and NIF(10 mg/kg)alone or in combinationA:5-HMF;B:LG;C:PF;D:NIF
Table 5 Non-compartmental pharmacokinetic parameters for the analytes in rat plasma
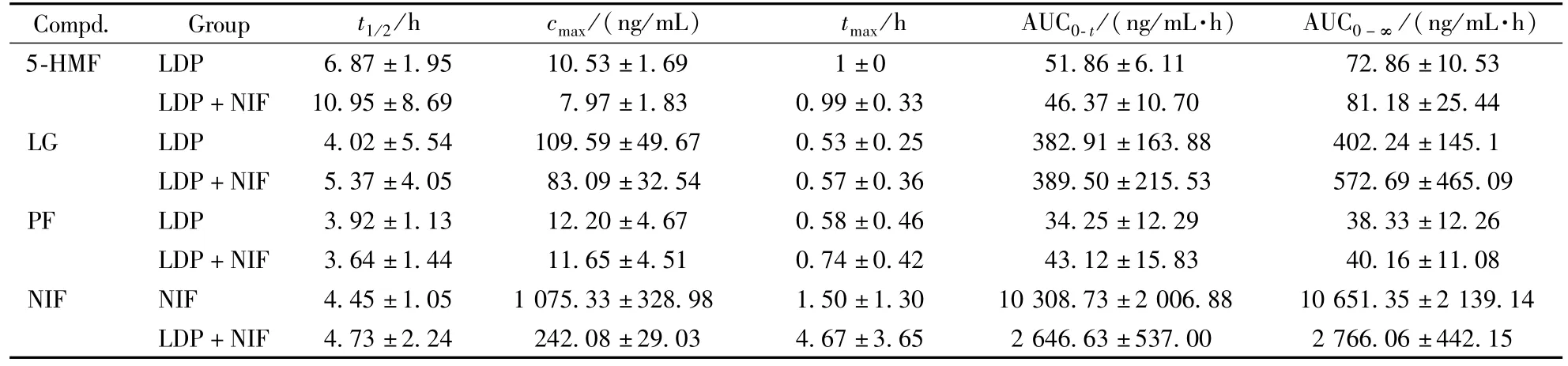
Table 5 Non-compartmental pharmacokinetic parameters for the analytes in rat plasma
Compd. Group t1/2/h c max/(ng/mL) t max/h AUC0-t/(ng/mL·h) AUC0-∞ /(ng/mL·h)5-HMF LDP 6.87±1.95 10.53±1.69 1±0 51.86±6.172.86±10.53 LDP+NIF 10.95±8.69 7.97±1.83 0.99±0.33 46.37±10.70 81.18±25.44 LG LDP 4.02±5.54 109.59±49.67 0.53±0.25 382.91±163.88 402.24±145.1 LDP+NIF 5.37±4.05 83.09±32.54 0.57±0.36 389.50±215.53 572.69±465.09 PF LDP 3.92±1.13 12.20±4.67 0.58±0.46 34.25±12.29 38.33±12.26 LDP+NIF 3.64±1.44 11.65±4.51 0.74±0.42 43.12±15.83 40.16±11.08 NIF NIF 4.45±1.05 1 075.33±328.98 1.50±1.30 10 308.73±2 006.88 10 651.35±2 139.14 LDP+NIF 4.73±2.24 242.08±29.03 4.67±3.65 2 6 1 46.63±537.00 2 766.06±442.15
4 讨 论
本研究建立了基于肝微粒体和中药指纹图谱研究六味地黄丸与硝苯地平的药物相互作用的体外快速评价方法。将药物置于肝微粒体共孵育,通过测定孵育前后系统的HPLC指纹图谱,以指纹图谱的相似度评价药物可能的相互作用,以期为临床安全合理用药警示提供方法依据。
本研究以六味地黄丸与硝苯地平为对象,首先采用HPLC法建立了微粒体中相互作用药物的指纹图谱的测定条件,并对方法学进行了评价。采用该方法优化了微粒体中药物相互作用的温孵条件,在此基础上测定联合用药前后体系的指纹图谱,通过指纹图谱的相似性预测可能的药物相互作用。
为了验证本方法的可行性,本研究同时进行了在体动物实验,通过测定联合用药前后中药主要成分及化学药物的药代动力学参数,考察代谢性药物相互作用,并与体外的评价结果进行比较。
研究结果显示,六味地黄丸与硝苯地在肝微粒体温孵,单独孵育六味地黄丸与加入硝苯地平后孵育相比较,体系的指纹图谱相似度为0.983,六味地黄丸主要活性成分的代谢量无明显变化,而硝苯地平的代谢量明显减少。六味地黄丸与硝苯地在大鼠体内单独给药与联合给药后,六味地黄丸典型成分的主要药代动力学参数无显著差异,而硝苯地平与六味地黄丸共同给药组的AUC(2 766.06vs10 651.35,P<0.05)、cmax(242.08vs1 075.33,P<0.05)、tmax(4.67vs1.50,P<0.05)与单独给药组相比均有显著性差异。从平均血药浓度曲线(图4)可以看出,硝苯地平在达到体内最大浓度后,消除相血浆浓度增加,出现双峰现象,可能与六味地黄丸对CYP酶的竞争性抑制有关,这与体外分析结果基本一致。本研究提示,患者在同时服用六味地黄丸与硝苯地平时,可能因为药物相互作用影响硝苯地平的血药浓度,建议配合临床药物浓度监测调整服药剂量。本研究建立的体外快速评价相互作用的方法,可为临床安全合理用药警示提供方法依据。
[1] Chinese Pharmacopoeia Commission.Chinese Pharmacopoeia:Part1[S].Beijing:China Medical Science Press,2015:401-402.
[2] Li L.Compatibility and application features of Liuwei Dihuang Pills[J].Clin JChin Med(中医临床研究),2015,27(7):146-148.
[3] Cao HY,Wu QH,Huang P,et al.Effects ofSuoquan Wanon endocrine and immune function of polyuria rats with kidney-yangdeficiency[J].Tradit Chin Drug Res Clin Pharmacol(中药新药与临床药理),2009,20(4):323-326.
[4] Zhang TD,LiCX.Protective effects of LiuweiDihuang Pill on the kidney of patientswith senile hypertention[J].World Sci Technol(世界科学技术),2006,8(2):102-104.
[5] Guo YX,Chen XL,Qiu ZW,et al.Meta-analysis and systematic reviews of Liuweidihuang Pills combined with Western medicine on hypertension[J].J Emerg Tradit Chin Med(中国中医急症),2013,22(2):189-191.
[6] Meng Q,Liu HY.Pharmacokinetic interactions between herbal medicines and prescribed drugs:focus on drugmetabolic enzymes and transporters[J].Curr Drug Metab,2014,15(8):791-807.
[7] Yin XJ,Yang Y,Tian Y,etal.Effectof simvastatin on themetabolism and pharmacokinetics of felodipine in rats[J].J China Pharm Univ(中国药科大学学报),2014,45(4):450-455.
[8] Ahmed S,Zhou Z,Zhou J,et al.Pharmacogenomics of drug metabolizing enzymes and transporters:relevance to precision medicine[J].Genomics Proteomics Bioinformatics(基因组蛋白质组与生物信息学报),2016,14(5):298-313.
[9] Isabelle S,Coralie D,Adeline JC,etal.Genotoxic activities of the food contaminant5-hydroxymethylfurfural using differentin vitrobioassays[J].Toxicol Lett,2010,192:189-194.
[10]Zhang YL,Yang GM,Pan Y,et al.Study of the transformative ability of cunninghamella drugmetabolism models to the Chinese herb cornus officinalis[J].Pharm Biotechnol(药物生物技术),2015,22:100-104.
[11]Tan Y,Shen GL,Zhuang XM,et al.Metabolic characteristic of paeoniflorinin vitro[J].J Int Pharm Res(国际药学研究杂志),2013,40:625-629.
[12]Zhu DL.Identification study on active ingredients in LiuWeiDi-HuangWan by information acquisition and evaluation techniques[D].Shanghai:The Second Military Medical University,2012.

