新型矿化胶原膜对人成骨肉瘤细胞株Saos-2生物学行为的影响*
韩 雪 王 辰 姜 浩 许亦权
引导骨再生术(Guided Bone Regeneration,GBR)在医学多学科领域的应用日趋成熟,其完善有赖于膜材料的改进和更新。GBR膜按照是否可被吸收而分为两大类:不可吸收膜和可吸收膜,前者包括聚四氟乙烯膜、钛膜等,后者包括天然生物膜和合成高分子膜材料。不可吸收膜虽然有较好的生物相容性、细胞阻隔作用、空间保持作用及临床可操作性,但需要二次手术取出,增加了患者的痛苦和疗程,中断了正常的组织愈合过程[1],同时因细胞亲和性差导致的创口裂开也增加了感染机会。而可吸收膜可避免这些问题的出现[1]。
可吸收性膜最大的优点是不用二次手术取出。可吸收性膜是GBR膜材料研究和应用的方向。目前临床应用和研究较多的可吸收性GBR膜材料是胶原膜。胶原纤维具有特有的网状结构,且无抗原性,可参与愈合过程,促进细胞生长[2],生物相容性好,可降解吸收、且其产物对机体无害。胶原膜的另外一个优点是暴露后有一定的抗感染能力,所以即使暴露,感染的机会也较不可吸收膜少,临床无需早期取出,对成骨效率的影响较小,因此在临床应用的范围越来越广[3-5]。Patino等[6]动物实验表明,猪的胶原膜不会引起局部炎症反应和全身免疫反应,在生物医学和药学领域有着极广泛的应用前景。但是胶原膜也有一定的局限性,例如大多数胶原膜较柔软,难以对抗外界压力;而且胶原膜缺乏骨传导及骨诱导能力。为了进一步完善胶原膜的各方面性能,本实验采用了一种新型矿化胶原膜,将羟基磷灰石和I型胶原相结合,评价该膜作为骨组织再生膜的可行性,本实验以人骨肉瘤细胞(Saos-2)为研究对象,从细胞水平研究了矿化胶原膜对其增殖分化的影响,为其临床应用提供一定的理论依据。
1.材料与方法
1.1 实验细胞 实验细胞Saos-2成骨肉瘤细胞购自协和细胞中心。
1.2 主要试剂和设备 矿化胶原膜(奥精医药科技有限公司,北京),Bio-gide膜(Geistlich Pharma AG,瑞士),McCoy培养基、胎牛血清、胰酶、双抗(中国医学科学院基础医学研究所,北京),MTT(购自美国Sigma公司),平底6孔、24孔板、96孔板(Corning公司,美国),酶标仪(Tecan公司,瑞士),倒置相差显微镜(Leica公司,美国),荧光倒置相差显微镜(Leica公司,美国),全自动生化分析仪(BeckmanAU5821,美国)。
1.3 浸提液的制备 参照ISO0993-5-2009 GB/T医疗器械生物学评价第5部分细胞毒性试验体外法,将Bio-gide生物膜和矿化胶原膜按6cm2/mL的比例加入含100mL/L的FBS的McCoy培养液,在37℃、50mL/L的CO2饱和湿度培养箱中,用该培养液浸提24h,浸提后0.22μm微孔滤膜过滤除菌,作为实验组,4℃保存备用。阴性对照组:10%胎牛血清的McCoy培养液。
1.4 细胞培养 Saos-2细胞复苏后,加入含有10%胎牛血清的McCoy培养液,置于37℃、5%CO2培养箱培养。隔天换液,待细胞长满瓶底,80%-85%时,进行细胞计数,按1∶3比例传代。
1.5 矿化胶原膜和Saos-2共培养的形态学观察 将无菌矿化胶原膜放置6孔板内,以2.0×105个/mL密度接种Saos-2于其表面,置于培养箱培养,隔天换液,3天后观察细胞生长情况并拍照。用PBS将样品清洗三遍,再使用2.5%的戊二醛将样品上细胞固定,置于冰箱保存。染色前,再次用PBS清洗样品三遍,在各样品表面滴加50μL罗丹明染料,对细胞质进行荧光染色,避光条件下作用15分钟,之后使用PBS再次清洗三次,利用荧光显微镜获取细胞形态图片。
1.6 MTT检测细胞增殖情况 消化细胞制成单细胞悬液,调整细胞密度为1×105个/ml,以每孔100μL接种于96孔培养板,使细胞数为1×104个/孔,置于37℃、5%CO2、相对湿度90%的培养箱培养24 h,细胞完全贴壁。弃去培养液,对照组加入10%胎牛血清的McCoy培养液,实验组(Bio-gide和矿化胶原膜组)加入材料浸提液,每组6个复孔。培养1d、4d、7d、10d时加入20μL的5mg/mL MTT溶液,继续37℃条件下培养4h,然后小心吸去上清液,每孔加入150μL的二甲基亚砜(DMSO),振摇10min,用酶标仪在490nm下检测各孔吸光度值(OD)。
1.7 碱性磷酸酶检测 以2×104/mL接种于24孔板内,每孔1mL,24h待细胞完全贴壁后,加入上述3组培养基,每组设6个复孔,培养7天后,收集细胞上清液。全自动生化仪检测碱性磷酸酶含量。
1.8 统计学分析 采用SPSS17.0统计软件分析实验结果,各组间均数比较采用单因素方差分析,p<0.05为差异具有显著性。
2.结果
2.1 矿化胶原膜与细胞共培养的形态学观察结果 Saos-2接种于矿化胶原膜后3d,倒置显微镜下可见材料周围细胞生长状态良好(图1),罗丹明染色后荧光显微镜观察Saos-2细胞在材料表面粘附伸展,呈短梭形,表明细胞状态良好(图2)。

图1 倒置显微镜下矿化胶原膜周围细胞形态(×40)

图2 荧光显微镜下矿化胶原膜表面细胞形态(×100)
2.2 MTT法检测细胞增殖 各个时间点对照组、Bio-gide组和矿化胶原膜组的吸光度(OD)值见图3。从图3可知,将Saos-2在含不同培养基的条件下培养1、4、7、10d,随着培养时间的延长,三组细胞数量不断增加,1、4、7d时三组间无显著性差异(P>0.05);10d时对照组OD值明显高于Bio-gide组和矿化胶原膜组,但Bio-gide组和矿化胶原膜组之间无显著性差异。图3表明,三种不同培养基均能够促进Saos-2的增殖。同市售Bio-gide组相比,矿化胶原具有同样良好的细胞相容性。
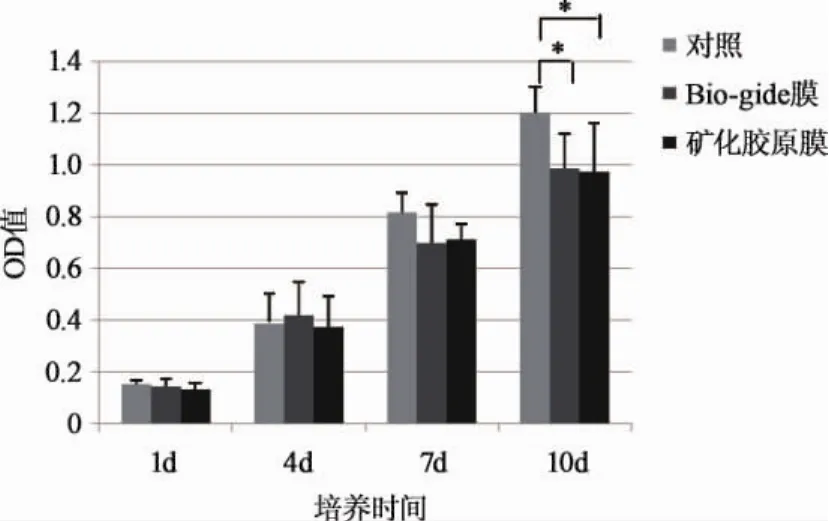
图3 MTT法检测三组细胞吸光度值(*p<0.05)
2.3 ALP检测 如图4所示,培养7d后,各组培养基中的Saos-2均有ALP的表达,其中对照组最低,Bio-gide膜组较高,矿化胶原膜组表达最高。各组之间的差异具有统计学意义(p<0.05);说明Bio-gide膜、矿化胶原膜的浸提液相对于常规培养条件,均具有促进成骨细胞分化的能力,而矿化胶原膜的作用最强。
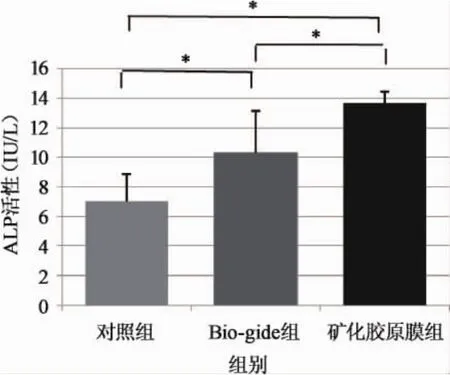
图4 Saos-2在各组培养液的ALP活性(*p<0.05)
3.讨论
胶原是细胞外基质的最重要成分,胶原膜作为GBR膜广泛应用于临床[7-10]。但胶原膜强度低、无骨诱导活性,为了提高胶原膜的组织修复再生能力,有必要开发具有骨传导和/或骨诱导功能的GBR膜材料,所开发的新型GBR膜材料应该保持胶原膜原有的特点,并且具有一定的机械强度、骨传导和/或骨诱导等生物学功能。羟基磷灰石的成分和结构与骨组织相似,将它与I型胶原结合制备一种新型可吸收矿化胶原膜[11],该膜约0.5mm厚,由2层构成,光滑层由I型胶原组成,与软组织相接触,防止结缔组织长入;粗糙面由矿化胶原组成,与骨组织相接触以诱导骨组织再生。本研究观察人成骨肉瘤样细胞Saos-2与该矿化膜共培养的状态,以市售胶原膜Bio-gide为对照,检测各组浸提液中细胞的增殖和成骨分化能力如何,评价矿化胶原膜的细胞相容性,探讨其临床应用的可行性。
3d时矿化胶原膜和Saos-2细胞体外复合培养,光镜下观察材料周围细胞生长情况良好;利用罗丹明染色,在荧光显微镜下观察发现矿化胶原膜表面的细胞能够附着和伸展,细胞生长形态良好,呈梭形或多角形,边界清,胞体饱满,大小均匀,这说明矿化胶原膜对Saos-2细胞无毒性,材料的细胞相容性良好。
通过MTT法测OD值,各组细胞都在增殖,经统计学分析,1、4、7d时,各组细胞无显著性差异(P>0.05),而10d时作为对照组完全培养基中细胞的OD值显著高于其他两组实验组,但两个实验组之间无显著性差异。说明矿化胶原膜与Bio-gide膜对细胞的增殖影响一致;其中的确切机制尚不清楚,但可以说明两种材料的浸提液微环境对细胞增殖的影响是相似的。
碱性磷酸酶(ALP)是成骨细胞的特异性标志物,在骨形成过程中从成骨细胞内释放于细胞外液,促进骨基质形成和矿化。本研究中矿化胶原膜浸提液中细胞外ALP含量明显高于其他2组,和Bio-gide浸提液相比,差异也具有显著性,说明实验组浸提液中特有的羟基磷灰石成分促进ALP的分泌。这些结果与以往研究相一致。Liu等学者研究发现羟基磷灰石与胶原的复合物可明显提高细胞的粘附、增殖和分化[12]。与传统的胶原膜相比,矿化胶原膜最大的优势在于疏松层中羟基磷灰石所起的骨再生能力[13]。Imanieh等将犬骨髓基质细胞与矿化胶原膜体外共培养7天时,SEM观察发现细胞生长良好,伸出很多伪足并分泌大量基质。这说明矿化胶原膜具有良好的诱导犬骨髓基质细胞成骨分化的能力[14]。据文献报导钙、磷、镁离子在骨髓基质细胞的增殖和分化中起重要作用[15],钙离子可能促进成骨细胞的成骨分化[15]。在本实验中,ALP表达量较高,Saos-2细胞镜下观察生长状态良好,增殖正常,与上述结果一致。这些结果均证明矿化胶原膜表面适于成骨细胞附着并能维持其分化功能,具有成骨细胞的传导性,可应用为引导骨组织再生膜。
矿化胶原膜可以为细胞提供一个有利于增殖分化的三维空间结构,为联合植骨材料促进骨组织再生奠定了良好基础,但仍需进行后续的蛋白基因检测及信号通路机制的研究来进一步验证这一结论。
[1] Stoecklin-Wasmer C,Rutjes AW,da Costa BR,et al.Absorbable collagen membranes for periodontal regeneration:a systematic review[J].Journal of dental research,2013,92(9):773-781
[2]Naujoks C,Von Beck FP,Langenbach F,et al.Biocompatibility of membranesw ith unrestricted somatic stem cells[J].In Vivo,2013,27(1):41-47
[3] Gassling V,Purcz N,Braesen JH,et al.Comparison of tw o different absorbable membranes for the coverage of lateral osteotomy sites in maxillary sinus augmentation:a preliminary study[J].Journal of cranio-maxillo-facial surgery:official publication of the European Association for Cranio-Maxillo-Facial Surgery,2013,41(1):76-82
[4] Lai CH,Zhou L,Wang ZL,et al.Use of a collagen membrane loaded with recombinant human bone morphogenetic protein-2 w ith collagen-binding domain for vertical guided boneregeneration[J].Journal of periodontology,2013,84(7):950-957
[5]Lee DW,Kim KT,Joo YS,et al.The Role of Tw o Different Collagen Membranes for Dehiscence Defect Around Implants in Humans[J].The Journal of oral implantology,2015,41(4):445-448
[6]Patino MG,Neiders ME,Andreana S,et al.Cellular inflammatory responseto porcinecollagen membranes[J].Journal of periodontal research,2003,38(5):458-464
[7] Stavropoulos A,Chiantella G,Costa D,et al.Clinical and histologic evaluation of a granular bovine bone biomaterial used as an adjunct to GTR w ith a bioresorbable bovine pericardium collagen membrane in the treatment of intrabony defects[J].Journal of periodontology,2011,82(3):462-470
[8]Kesmas S,Swasdison S,Yodsanga S,et al.Esthetic alveolar ridge preservation w ith calcium phosphate and collagen membrane:preliminary report[J].Oral surgery,oral medicine,oral pathology,oral radiology,and endodontics,2010,110(5):e24-36
[9] Lee CK,Koo KT,Kim TI,et al.Biological effectsof a porcinederived collagen membrane on intrabony defects[J].Journal of periodontal&implant science,2010,40(5):232-238
[10]Cardaropoli D,Gaveglio L,Cardaropoli G.Vertical ridge augmentation w ith a collagen membrane,bovine bone mineral and fibrin sealer:clinical and histologic findings[J].The International journal of periodontics&restorative dentistry,2013,33(5):583-589
[11]王 飘,姚 瑶,赵 皓,等.应用齿贝骨粉及矿化胶原膜修复小型猪拔牙创骨缺损的效果观察[J].中国口腔颌面外科杂志,2017,15(5):408-412
[12]Liu KB,Huang K,Teng Y,et al.Useof mineralized collagen bonegraft substitutes and dorsal locking plate in treatment of elder metaphyseal comminuted distal radiusfracture[J].Front Mater Sci,2014,8(1):87-94
[13]Sun Y,Wang CY,Wang ZY,et al.Test in canineextraction site preservations by using mineralized collagen plug with or w ithout membrane[J].Journal of biomaterials applications,2016,30(9):1285-1299
[14]Malathi KG,Dev JN,Kumar KS,et al.A clinical evaluation of a bioresorbable membrane and porous hydroxyapatite in thetreatment of human molar class IIfurcations[J].Journal of Indian Society of Periodontology,2013,17(5):617-623
[15]Zeng D,Xia L,Zhang W,et al.Maxillary sinusfloor elevation using a tissue-engineered bonew ith calcium-magnesium phosphate cement and bone marrow stromal cells in rabbits[J].Tissueengineering Part A,2012,18(7-8):870-881

