苯甲酸阿格列汀片处方工艺的研究及其溶出度评价
周 博 ,冯菊红*,胡学雷 ,吴志飞
1.武汉工程大学化工与制药学院,湖北 武汉 430205;2.绿色化工过程教育部重点实验室(武汉工程大学),湖北 武汉 430205
苯甲酸阿格列汀(alogliptin benzoate,APB)化学名 2-{[(6-[(3R)-3-氨基哌啶-1-基]-3-甲基-2,4-二氧代-3,4-二氢嘧啶-1(2H)-基]甲基}苯甲腈苯甲酸盐,商品名为尼欣那。该药由日本武田制药有限公司开发,并于2013年1月获美国FDA批准上市。苯甲酸阿格列汀是一种高选择性的二肽基肽酶抑制剂,其能有效地增加II型糖尿病患者体内的胰岛素水平,从而达到降低体内葡萄糖水平的目的。在大量的临床试验以及实际应用中,苯甲酸阿格列汀已被证实对治疗Ⅱ型糖尿病具有良好的耐受性、安全性和有效性[1-4]。在糖尿病患者日益增多的今天,该药市场前景广阔。因苯甲酸阿格列汀水溶性良好,崩解时间为影响溶出的主要因素,所以本研究按该药FDA进口药品要求,通过正交试验,以其崩解时间为主要评价指标,筛选出苯甲酸阿格列汀片剂的处方工艺,通过该工艺研制了苯甲酸阿格列汀片,测试了自制片剂及其粉体的脆碎度、硬度、休止角、密度及含量,并比较了自制片与日本进口原研片剂的体外溶出行为,其体外溶出行为相似,说明处方合理。
1 实验部分
1.1 仪器
UV2450型紫外分析仪(日本岛津公司);LB-2D型崩解时限测定仪(上海黄海药检仪器有限公司);YD-I型片剂硬度测试仪(天津市富兰斯电子科贸有限公司);CJY-300D型片剂脆碎度测定仪(上海黄海药检仪器有限公司);RCZ-6C2型智能溶出试验仪(上海黄海药检仪器有限公司);AB204-N型电子天平(Metter-Toledo Group)。
1.2 药品与试剂
尼欣那 Nesina(alogliptin)tablets,日本 Takeda Pharmaceutical Company Limited,Osaka Plant,批号:AM300B,规格:34 mg每片,每片含阿格列汀25 mg);APB原料药(自制,纯度>99%);微晶纤维素(microcrystalline cellulose,MCC)、甘露醇、羟丙基甲基纤维素(hydroxypropyl methylcellulose,HPMC)、硬脂酸镁、交联羧甲基纤维素钠均由安徽山河药用辅料有限公司提供,实验室用水为蒸馏水。
1.3 方法
1.3.1 分析方法 1)标准曲线的建立。精密称取APB约10 mg用0.01 mol·L-1盐酸溶液定溶至50 mL,摇 匀 。 配 制 质 量 浓 度 4 μg·mL-1、8 μg·mL-1、16 μg·mL-1、24 μg·mL-1、32 μg·mL-1、40 μg·mL-1的溶液。按紫外-可见光光度法(中国药典2015年版四部通则0401),在波长278 nm处分别测定其吸光度,得标准曲线回归方程为:A=0.031 9C+0.010 9,R2=0.9997。结果表明:APB在4 μg·mL-1~40 μg·mL-1浓度范围内,其吸光度与浓度呈良好的线性关系。标准曲线见图1。

图1 APB的标准曲线图Fig.1 Standard curve of APB
2)溶出度测定方法。参照尼欣那进口标准要求,依照中国药典(2015)版操作,建立溶出度测定方法。按照第二法桨法,0.01 mol·L-1盐酸溶液900 mL为溶出介质,转速50 r·min-1,分别在5 min、10 min、15 min、20 min、30 min,取溶液 5 mL,30 s内滤过,并及时在溶出杯内补充等量溶剂。续取滤液,按照紫外-可见光光度法(中国药典2015年版四部通则0401),在278 nm的波长处分别测定吸光度,依据标准曲线计算出各时间节点累积溶出百分数,并绘制其溶出曲线[5-7]。
3)精密度实验。检测紫外可见光光度法的精密度。精密配制质量浓度为38 μg·mL-1的APB溶液,以溶出介质为空白对照,在278 nm处测试其A值,重复测6次,并计算其RSD值。实验结果显示其RSD值为0.05%,表明采用紫外可见光光度法测定本品溶出度的精密度好。
4)回收率实验。检测APB与辅料混合后的回收率。取处方量的辅料,并分别取处方量质量分数10%、50%和90%的APB,制备成待测样品,按“1.3.1”项下方法测定其回收率,结果见表1。结果表明所选辅料对试验结果无明显影响。
1.3.2 APB片剂的制备 APB、MCC、甘露醇、交联羧甲基纤维素钠分别过孔径0.15 mm筛,根据处方量规定的用量,采用等量递增法将过好筛的APB、MCC、甘露醇和部分的交联羧甲基纤维素钠混合均匀,备用。称取适量HPMC,加入蒸馏水搅拌,搅拌1h,制成3%HPMC水溶液,取处方质量分数的3%HPMC水溶液均匀加入配好的原料中,制软材。过孔径0.850 mm筛制粒,于70℃干燥2 h,取出后用过孔径0.850 mm筛整粒,加入处方量的硬脂酸镁以及余下交联羧甲基纤维素钠,混合均匀,压片,即得。

表1 APB回收率试验结果Tab.1 The recovery of APB
1.3.3 颗粒流动性测定 取培养皿固定放置在一水平面并测量其半径r,用2个错位串联起来的漏斗固定在培养皿正上方,固定其高度为3 cm,在上方漏斗中缓慢注入粉体,以粉末自动流出培养皿边缘,并形成较稳定的圆锥形状粉末堆为止,测定锥体高度h,重复上述实验5次,并分别计算其反正切函数来得到其休止角θ,取5次θ的平均值。
1.3.4 松密度与实密度的测定 取一定量“2.2”项下所得粉体m,取一大小适量的量筒,将上述粉体倒入量筒中,小心夷平粉体且勿压实,读取体积v1,计算其松密度。将上述装有粉体的量筒置于一平面,轻叩量筒直至量筒内粉体体积不再变化为止,读取体积 v2,计算其实密度( ρ松=m/v1,ρ实=m/v2,重复上述实验5次,取其平均值[8-10]。
1.3.5 正交试验设计 选用MCC和甘露醇为填充剂、硬脂酸镁为润滑剂、质量分数3%HPMC水溶液为粘合剂、交联羧甲基纤维素钠为崩解剂。采用正交试验,按照正交表L9(34)(见表2)设计试验,以崩解时间为评价指标,参照原研片剂崩解时间230 s到250 s,筛选出APB片处方工艺[11]。
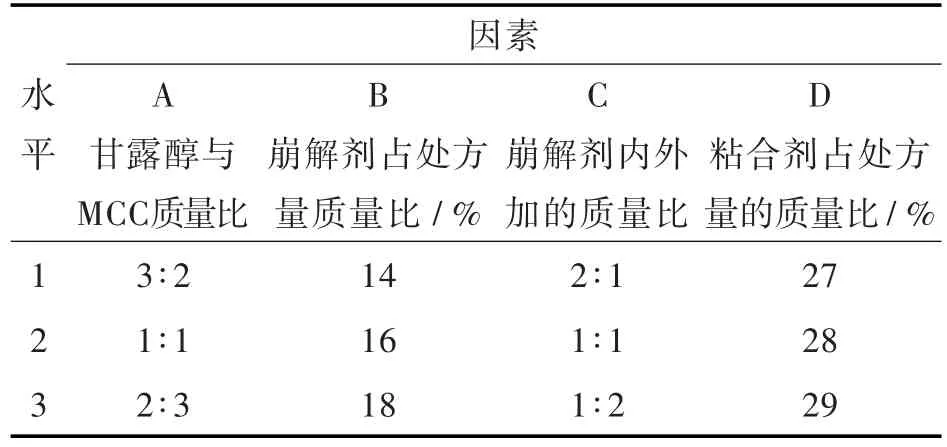
表2 正交实验因素水平表Tab.2 Factors and levels for orthogonal design
1.3.6 溶出度对比研究 按2.2节优化得到的处方制备苯甲酸阿格列汀片,参照该药进口标准并按溶出测定法(中国药典2015年版四部通则0931),采用相似因子法(f2)与原研片剂进行溶出度的对比研究,来评价自制片剂与原研片剂溶出度的相似程度[12-13]。 f2的计算公式如下:

1.3.7 处方的初步确定 以上市的苯甲酸阿格列汀片作为参考,通过查阅说明书以及前期处方筛选,初步确定处方组成及用量范围。苯甲酸阿格列汀 34 mg,MCC 40 mg到 60 mg,甘露醇40 mg到60 mg,交联羧甲基纤维素钠20 mg到30 mg,3%HPMC水溶液60 mg到70 mg,硬脂酸镁1.6 mg。理论片重166 mg。
2 结果与讨论
2.1 正交试验结果
以甘露醇与MCC的比例、用量、交联羧甲基纤维素钠内外加比例、质量分数3%HMPC溶液用量为因素,以崩解时间为主要评价指标进行正交试验,正交结果见表3。

表3 正交试验结果Tab.3 Results of orthogonal experiment
数据采用spss20.0统计软件进行正交设计方法分析。由于正交表被占满,缺乏自由度,为估算误差。根据极差的分析结果,将MCC与甘露醇的比例这组数据不作处理,视为误差列,进行方差分析[14-15]。方差分析结果见表4。

表4 方差分析Tab.4 Analysis of variance
由表可知,崩解剂量、粘合剂量、崩解剂内外加比例的P(显著性)值均小于0.05,对处方优化具有显著影响,由正交表可知,苯甲酸阿格列汀片的较优工艺条件是A2B3C1D1。依据原研片剂以及处方前研究结果初步确定的理论片重,确定本品的最优处方组成为APB 34 g、甘露醇50 g、MCC 50 g、质量分数3%HPMC水溶液62 g、交联羧甲基纤维素钠内加20 g、交联羧甲基纤维素钠外加10 g、硬脂酸镁1.6 g(1 000片)。
2.2 处方验证
2.2.1 APB片剂基本性能评价 根据正交实验筛选出的最优处方,制备3批样品,测定自制片剂及其粉体的脆碎度、硬度、崩解时间、休止角、松密度以及实密度。评价结果见表5。
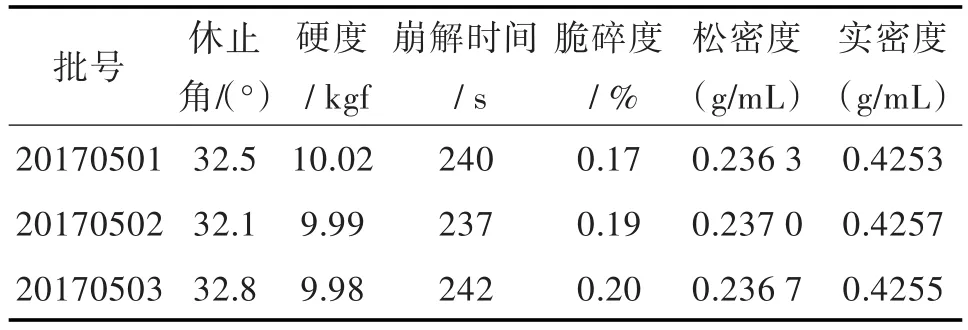
表5 APB自制片剂的基本性能评价Tab.5 Evaluation of basic performance of self-prepared tablets of APB
结果显示由该处方制得的片剂脆碎度满足中国药典(2015版)要求,崩解时间基本与原研片剂相同,制得的粉体流动性与可压性较好。
2.2.2 影响因素验证 根据正交实验筛选出的最优处方,制备1批样品进行影响因素实验,结果见表6。

表6 APB自制片剂的影响因素结果Tab.6 Effects of the influencing factors on self-prepared tablets of APB
结果显示在高温以及强光条件下自制片剂的外观、溶出度以及含量未见明显改变,具有较好的稳定性,但在高湿条件下,自制片剂硬度明显变小,表明产品需要密闭性好的包装。
2.3 体外溶出曲线对比研究
按该片剂进口标准,取0.01 mol·L-1的盐酸溶液(A)作为溶出介质,测定3批自制片剂与原研片剂在其中的溶出行为,绘制溶出曲线并计算f2值。另取pH4.5乙酸缓冲溶液(B)、pH6.8磷酸缓冲溶液(C)、水(D)3种溶出介质进行3批自制片剂与原研片剂的溶出曲线对比,并计算其f2值。溶出曲线对比见图2,f2值见表7。

表7 APB自制片剂与原研片剂的相似性评价Tab.7 Evalution of similarity between self-prepared tablets and original tablets of APB
由试验结果可见,3批自制片剂与原研片剂在4种不同pH的介质中溶出曲线的 f2值均大于80,且满足该药的进口标准,表明自制片剂与原研片剂有相似的体外溶出行为。
3 结 语
在本处方工艺中使用交联羧甲基纤维素钠作为崩解剂,并采用内加与外加相结合的方式增加片剂的崩解速率,MCC和甘露醇作为填充剂,3%HPMC水溶液作为黏合剂,硬脂酸镁作为润滑剂。用正交试验对处方中甘露醇与MCC的用量比例、质量分数3%HPMC水溶液的用量、交联羧甲基纤维素钠的用量以及内外加的比例进行优化。正交试验和方差分析的结果表明,影响苯甲酸阿格列汀片的溶出度最主要的因素为质量分数3%HPMC水溶液的用量、交联羧甲基纤维素钠的用量以及内外加的比例。填充剂甘露醇与MCC的用量比例对片剂的溶出度均有一定的影响,但影响较小。HPMC水溶液作为黏合剂,其用量越大,制备的颗粒越粗越硬,片剂的溶出度会越小;交联羧甲基纤维素钠作为崩解剂,用量减少,片剂崩解速度会变慢,溶出度会减少。通过正交试验,确定质量分数3%HPMC水溶液的用量和交联羧甲基纤维素钠的用量以及内外加的比例,使片剂的溶出度符合质量要求。

图2 原研片剂与自制片剂的在(a)0.01 mol·L-1盐酸,(b)pH 4.5乙酸缓冲溶液,(c)pH 6.8磷酸缓冲溶液,(d)水中的溶出曲线Fig 2 Dissolution curves of original and self-prepared tablets in four kinds of dissolution mediums:(a)0.01mol·L-1HCl;(b)pH 4.5 acetic acid buffer solution;(c)pH 6.8 phosphoric acid buffer solution;(d)water
研究结果表明,采用正交试验优化后的处方工艺所制得的片剂外观、硬度和含量均符合规定,所制片剂体外溶出良好,自制片剂与原研片剂在通过进口检测标准检测后所得溶出曲线的 f2值均大于80,表明自制片剂与原研片剂有相似的体外溶出行为,达到进口标准。因此,本试验结果表明,该苯甲酸阿格列汀片剂处方工艺合理、简单易行、质量可控、成本节约,适合工业化生产。
参考文献:
[1]KUTOH E,KANEOKA N,HIRATE M.Alogliptin:a new dipeptidylpeptidase-4 inhibitor with potential anti-atherogenic properties[J].Endocrine Research,2015,40(2):88-96.
[2]JARVIS C I,CABRERA A,CHARRON D.Alogliptin:a new dipeptidyl peptidase-4 inhibitor for type 2 diabetes mellitus[J].AnnPharmacother,2013,47(11) :1532-1539.
[3]KUSUNOKI M,SATO D,NAKAMURA T,et al.The benefical effects of the DPP-4 inhibitor alogliptin on hemoglobin a1cand serum lipids in japanese patients with type 2 diabetes[J].Drugs,2016,66(1):18-22.
[4]FENG J,ZHANG Z,WALLACE M B,et al.Discovery of aloglipt in:a potent,selective,bioavailabe,and efficacious inhibitor of dipeptidyl peptidase IV[J].Journal of Medicinal Chemistry,2007,50(10) :2297-2300.
[5]国家药典委员会.中华人民共和国药典:四部[S].2015版.北京:中国医药科技出版社,2015:121-124.
[6]魏农农,王霞,苏敏.药物溶出度试验方法研究进展[J].中国新药杂志,2013,22(10):1119-1124.
[7]陈贤春,吴清,王玉蓉.关于溶出曲线比较和评价方法[J].中国医院药学杂志,2007,27(5):662-664.
[8]刘瑞江,张业旺,闻嵩炜.正交实验设计和分析方法研究[J].实验技术及管理,2010,27(9):52-55.
[9]杜焰,冯怡,徐德生.药物粉体压缩与结合特性研究进展[J].中国现代应用药学,2012,29(1):24-30.
[10]张南,廖正根,乔军辉.微晶纤维素性质研究及其片剂成型性考察[J].中国现代药物应用,2015,9(3):254-257.
[11]滕再进,马荔,张文萍,等.盐酸普拉克索片剂的处方设计及质量评价[J].中国医院药学杂志,2015,33(11):1008-1011.
[12]孙银银,董堃华,王铁闯,等.马西替坦片剂的研制及质量评价[J].中国医药工业杂志,2017,48(3):400-405.
[13]余静.奈韦拉平片的制备及溶出度评价[J].中南药学,2016,14(12):1331-1335.
[14]张红丽,何寿林.水解法提取木糖醇工艺条件的正交试验[J].武汉工程大学学报,2010,32(9):23-25.
[15]陈林莉,方继德,黎莉.正交试验优选虎杖总黄酮的提取工艺[J].武汉工程大学学报,2015,37(12):6-9.

