BSP和整合素αvβ3在口腔鳞状细胞癌中的表达及临床意义
侯 捷 王海霞 张玲敏 毛立民
口腔鳞状细胞癌是最常见的口腔颌面部恶性肿瘤,是世界范围内第8大常见癌症[1],每年全世界新增病例超过30万例[2]。近20年来,尽管其发病机制与治疗方法得到广泛研究与发展,但口腔癌患者5年生存率仍维持在50%[1]。
口腔鳞癌具有快速增长,高度局部浸润和颈淋巴结转移的特性[3]。当前,口腔鳞癌的预后判断主要依靠肿瘤的原发部位、大小、是否发生颈淋巴结转移以及有无远处转移。然而,口腔鳞癌的生物学行为具有显著异质性,并且临床分期相同的肿瘤,其临床进程及治疗反应不尽相同。因此,确定肿瘤侵袭、转移的关键因素,建立新的诊断和预后判断方法以及采用新的治疗策略显得尤其重要。
相关研究显示,BSP与肿瘤的浸润、转移存在相关性[4],且BSP均不同程度上受到整合素αvβ3的诱导作用。近年研究表明BSP和整合素αvβ3存在于各种肿瘤,如肺癌[5],乳腺癌[6],甲状腺癌[7]等。两者在口腔鳞状细胞中的研究未见报道。基于这一背景,本研究通过免疫组织化学法检测BSP及整合素αvβ3在OSCC及正常口腔黏膜中的表达,分析二者表达与OSCC临床病理特征的关系以及两者相关性,以期为OSCC的诊断及预后评估提供应用价值。
一、材料和方法
1.一般材料
(1)标本选择:收集哈尔滨医科大学附属第一医院口腔颌面外科2013~2016年手术切除的,术前未采用任何针对肿瘤的治疗,如放疗、化疗等,经组织蜡块保存完好的口腔鳞癌标本。均经常规病理检查确诊为鳞状细胞癌。
(2)临床资料:口腔鳞癌患者例,男46例,女14例,年龄42~78岁,平均60岁。依据国际抗癌联盟(UICC)2010年关于恶性肿瘤TNM分期的规定将病例分为Ⅰ、Ⅱ、Ⅲ和Ⅳ期,其中Ⅰ期~Ⅱ期35例,Ⅲ期~Ⅳ期25例。依据世界卫生组织(WHO)组织学分化程度标准将病例分类,高分化34例,中低分化26例。术后病理结果颈淋巴结转移者25例,无淋巴结转移者35例所收集的石蜡标本均由病理学专业医师证实并且临床资料齐全。同时选取20例口腔正常黏膜组织标本作为免疫组化染色的实验对照,所有患者既往身体健康,无肿瘤病史。
(3)主要试剂:一抗兔抗人BSP多克隆抗体(abcam公司,英国),鼠抗人Integrinαvβ3鼠单克隆抗体(SANTA CRUZ公司美国),二抗羊抗兔,羊抗鼠,浓度为1∶50;封闭用正常羊血清,浓度为1∶10(北京索莱宝科技有限公司)通用型SP免疫组化检测试剂盒及DAB试剂盒(博士德生物有限公司)。
2.实验方法
(1)免疫组化方法:60例OSCC组织和20例正常口腔黏膜组织石蜡标本制成4μm切片后常规脱蜡至水,抗原修复后按照说明书步骤进行免疫组化染色,显微镜下观察切片。
(2)结果判定:BSP蛋白表达以细胞质或细胞核周围区域中出现黄色或棕黄色颗粒为阳性;Integrin αvβ3蛋白表达在癌细胞浆或细胞膜中出现黄色或棕黄色颗粒为阳性。结合肿瘤细胞染色的百分比及染色强度进行评分:阳性细胞数≤10%为0分,阳性细胞数11%~50%为1分,阳性细胞数51%~75%为2分,阳性细胞数>75%为3分。按染色强度评分:无黄色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。染色阳性细胞数与染色强度之和≥3分者为阳性表达,<3分者为阴性表达。
3.统计学方法
用Excel收集数据,采用SPSS 17.0统计学软件进行统计学分析。计数资料以频数和百分数(%)表示,组间比较采用χ2检验。采用Spearman秩相关系数分析相关性。以P<0.05为差异有统计学意义。
二、结果
1.BSP和Integrinαvβ3在OSCC及正常组织中的表达
BSP在OSCC细胞质或细胞核周围区域中呈高表达,而在正常上皮无表达或极少数弱表达;Integrinαvβ3定位于OSCC细胞细胞浆或细胞膜内,正常上皮细胞基底层表达极弱(图1)。在口腔鳞癌组织中,BSP、整合素αvβ3的表达强度显著高于口腔正常黏膜组织(P<0.01)(表1)。
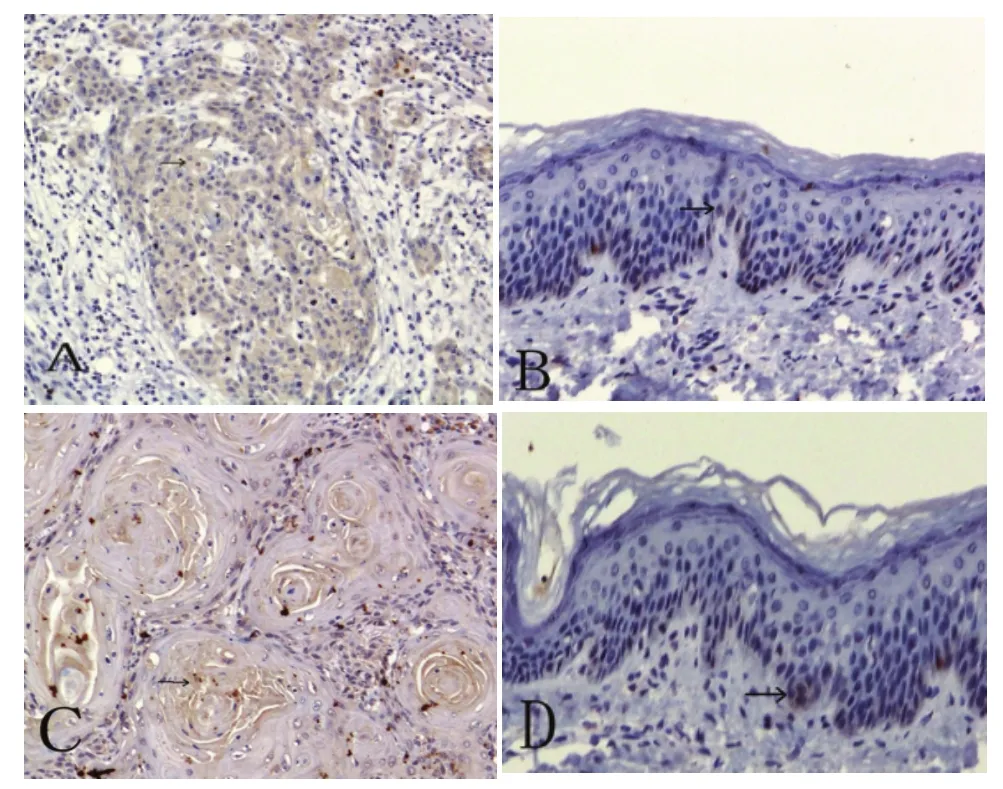
图1 免疫组化检测BSP和Integrinαvβ3在口腔鳞癌及口腔正常黏膜组织中的表达(SP ×200)
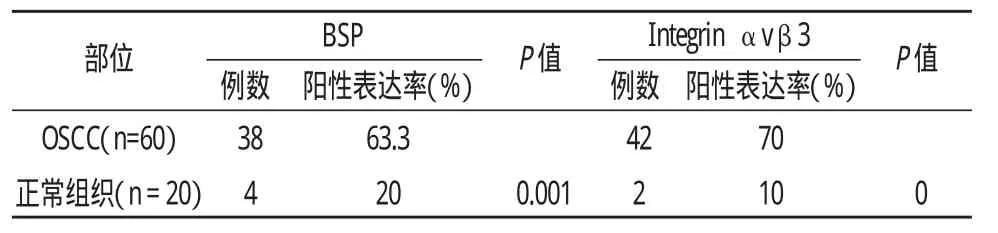
表1 BSP与Integrinαvβ3在OSCC及正常组织中的表达

表2 BSP与Integrin αvβ3表达与OSCC临床病理特征的关系
2.BSP、Integrinαvβ3的表达与OSCC临床病理因素分析
60例OSCC患者中,BSP、Integrinαvβ3的表达水平与性别,年龄无明显差异(P>0.05)。而均与分化程度、TNM分期,淋巴结转移相关。分化程度越低、TNM分期在Ⅲ~Ⅳ,发生淋巴结转移,BSP和Integrinαvβ3相对表达明显增高,具有统计学意义(P<0.05)(表2)。
3.BSP与Integrinαvβ3在口腔鳞状细胞癌中表达的相关性
采用Spearman秩相关系数检验,结果显示OSCC组BSP与Integrinαvβ3间相关系数为r=0.257(P<0.05),二者存在正相关性,表明BSP的表达随Integrinαvβ3的表达增强而增强(表3)。

表3 BSP和αvβ3在OSCC组织中表达的相关性
三、讨论
口腔鳞状细胞癌(OSCC) 是口腔科最常见的恶性肿瘤之一。细胞外基质(exnacellular matrix,ECM)不仅决定细胞的形态,还可控制细胞的生长、分化,调节细胞的运动。一般状态下,ECM通过不断生长和降解保持动态平衡,其蛋白聚糖、胶原蛋白、弹性蛋白的成分降解主要依靠蛋白水解酶的作用。肿瘤细胞的侵袭转移过程常常伴有细胞外基质的降解。侵袭和转移是恶性肿瘤最基本的生物学特征。
骨唾液酸蛋白(bone sialoprotein,BSP)是一种高度糖基化、磷酸化、硫酸化的多功能非胶原蛋白,属 于 SIBLING(small integrin binding ligand,N-linked Glycoprotein)蛋白家族[8],其主要分布于矿化相关组织,在多种恶性肿瘤中也有异常表达。Bellahecene等[9]人首先阐述了BSP基因在骨转移的人乳腺癌中表达,由此也成为研究乳腺癌易发生骨转移的开端,并奠定了基础,推动了更深一步来研究BSP在肿瘤发生发展中的作用。此外,Tang H[10]等人发现BSP的异常表达可能在ESCC的恶性进展及预后有显著的作用,并与其分化程度和淋巴结转移有关,可能是反映ESCC的生物学行为的一个标志。BSP是骨细胞外基质中的重要蛋白。有研究报道[11],MMP是锌依赖的内切酶超家族,它几乎能降解所有的ECM成分,BSP可促进肿瘤细胞分泌MMP,并提高MMP活性,增强肿瘤细胞突破ECM能力,促进肿瘤细胞成功转移到其他组织。
整合素是一种广泛分布于各种脊椎动物细胞膜表面受体,在多种肿瘤表面的异常表达,对癌细胞发展具有十分重要的作用,整合素αvβ3是由αv亚基和β3亚基组成的异源二聚体,是整合素家族的重要成员。研究发现整合素αvβ3与配体结合后激活了胞内的多条信号传导通路,影响细胞的形态变化、增殖、凋亡等生物学行为,进而促进肿瘤细胞侵袭转移的发生[12]。其不仅可以介导细胞和ECM间、以及细胞和细胞间的粘附作用,还能作为一种信号转导分子传递信号。
肿瘤细胞彼此间黏附能力减弱而肿瘤细胞与宿主细胞及ECM间的黏附能力增加,有利于肿瘤 细胞脱离母体肿瘤,是实现转移的第一步。此过程由细胞黏附分子所介导,细胞黏附分子主要有选择素、整合素、免疫球蛋白超家族、钙勃素等。Oldberg等人[13]首次证实了整合素是BSP的受体,BSP通过RGD细胞识别序列与骨肉瘤细胞表面整合结合,并介导癌细胞表面与ECM间的黏附作用。其次新生血管的形成对原发性肿瘤细胞的生长和增殖是不可缺少的,可使肿瘤从无血管的缓慢生长阶段进人快速增殖阶段。随着肿瘤微血管密度的增加,肿瘤侵袭转移等恶性潜能也增强。血管生成进程依赖于内皮细胞和ECM中特异分子的相互作用,整合素介导了这一过程。整合素在静止的血管细胞中低表达或不表达,而在处于生理或病理状态中的血管生成内皮细胞中高表达,而BSP的RGD基序恰是整合素αvβ3的识别位点。许多研究发现BSP是一种血管生成因子,具有调解血管内皮细胞赫附、迁移,诱导血管生成的作用[14]。
我们研究还发现,在口腔正常上皮BSP和整合素αvβ3基本不表达。在口腔鳞癌组织中,BSP和整合素αvβ3的表达强度显著高于口腔正常黏膜组织。这表明随着上皮细胞异型性的加重,BSP和整合素αvβ3的表达量增加。BSP和整合素αvβ3的表达与肿瘤的分化程度,TNM分期,淋巴结转移呈正相关,提示两者对肿瘤的发生发展有协同促进作用。因此我们认为,两者在口腔癌局部组织可能存在调控关系。
综上所述,BSP和整合素αvβ3在口腔鳞癌中表达增加,并与口腔鳞癌的浸润、转移密切相关,可作为口腔鳞癌患者预后判断指标及治疗的靶向目标。未来期间对于BSP和整合素αvβ3的相关性及调控关系需进一步研究证实。
1 Scully C,Bagan J.Oral squamous cell carcinoma overview.Oral Oncol,2009,45(4):301-308.
2 Lippman SM,SudbøJ,Hong WK.Oral cancer prevention and the evolution of molecular-targeted drug development.J Clin Oncol,2005,23(2):346-356.
3 De Vicente JC,Lequerica-Fernández P,Santamaria J,et al.Expression of MMP-7 and MT1-MMP in oral squamous cell carcinoma as predictive indicator for tumor invasion and prognosis.J Oral Pathol Med,2007,36(7):415-424.
4 Tu Q,Zhang J,Fix A,et al.Targeted overexpression of BSP in osteoclasts promotes bone metastasis of breast cancer cell.Connect Physiol,2009,218(1):135-145.
5 Papotti M,Kalebic T,Volante M,et al.Bone sialoprotein is predictive of bone metastases in resectable non-small-cell lung cancer:a retrospective case-control study.J Clin Oncol,2006,24(30):4818-4824.
6 Ibrahim T,Leong I,Sanchez-Sweatman O,et al.Expresion of bone siaoprotein and osteopotin in breast cancer bone metastases.Clin Exp Metastasis,2000,18(3):253-260.
7 Bellahcene A,Albert V,Pollina L,et al.Ectopic expression of bone sialoprotein in human thyroid cancer.Thyroid,1998,8(8):637-641.
8 Jain A,Karadag A,Fohr B,et al.Three SIBLINGs enhance factor H’s cofactor activity enabling MCP-like cellular evasion of complement-mediated attack.J Biol Chem,2002,277(16):13700-13708.
9 Bellahcene A,Merville MP,Castronovo V.Expression of bone sialoprotein,a bone matrix protein,in human breast cancer.Cancer Res,1994,54(11):2823-2826.
10 Tang H,Wang H,Wang L,et al.Expression and significance of bone sialoprotein (BSP) in esophageal squamous cell carcinoma, Zhonghua Zhong Liu Za Zhi, 2014, 36(8):602-605.
11 Watanabe A,Hoshino D,Hosino D,et al.Critical role of transient activity of MT1-MMP for ECM degradation in invadopodia.PLoS Comput Biol,2013,9(5):e1003086.
12 Park YS,Hwang S,Jiu YM,et al.CCN1 secreted by tonsilderived mesenchymal stem cells promotes endothelial cell angiogenesis via integrin alphav beta3 and AMPK.J Cell Physiol,2015,23(1):140-149.
13 Cascone I,Napione L,Maniero F,et al.Stable interaction between alpha5beta1 integrin and Tie2 tyrosine kinase receptor regulates endothelial cell response to Ang-1.J Cell Biol,2005,170(6):993-1004.
14 Chen J,Rodriguez JA,Barnett B,et al.Bone sialoprotein promotes tumor cell migration in both in vitro and in vivo models.Connect Tissue Res,2003,44 suppl 1:279-284.

