急慢性特发性血小板减少性紫癜患儿的差异表达基因特征及交互作用网络分析
任晓梅,刘启玲,辛 宝,张荣强
陕西中医药大学 公共卫生学院,陕西咸阳 712046
ActaAcadMedSin,2018,40(2):225-232
特发性血小板减少性紫癜(idiopathic thrombocytopenic purpura,ITP),又称原发性血小板减少性紫癜,是一种原因不明的、器官特异性自身免疫性出血性疾病,是由于人体产生抗血小板自身抗体导致单核巨噬系统破坏血小板过多造成血小板减少。患者表现为皮肤散在出血点及其他出血症状,如鼻衄、牙龈出血等。紫癜及淤斑可出现在任何部位的皮肤或黏膜,常见于下肢及上肢远端。ITP在儿童中年发病率5/10万~10/10万,成人年发病率2/10万[1]。发病率育龄期女性高于男性,其他年龄阶段男女比例无差别。根据持续时间可以将ITP分为新诊断、持续性(持续时间在3~12个月)及慢性(持续时间≥12个月),新诊断的ITP即急性ITP[2]。本病除极少数因血小板极低发生危及生命的出血外,一般预后良好。作为儿童期常见的出血性疾病,急性ITP通常发生在病毒感染后,大多患者可自行恢复,10%~20%患者病程持续时间较长,转变为慢性ITP[3]。慢性型患者反复发作,病程较长,目前尚无有效的治疗药物。ITP的发生机制目前尚不清楚,有学者提出持续及慢性ITP患者的发病机制不同于急性者[2,4],除了体液免疫外,细胞免疫在ITP尤其是慢性ITP的发病中发挥关键的作用[5- 6],目前T淋巴细胞异常及相关细胞因子被认为是ITP发病机制的核心[7]。研究表明在ITP患者中,T细胞活化信号通路相关分子Cbl-b基因水平显著降低,Fas相关死亡结构域蛋白凋亡通路中部分上、下游分子存在异常表达[8- 9]。然而单个基因的研究无法反映ITP患者T细胞基因表达谱改变的全貌,本研究以患者T细胞为研究对象,通过生物信息学方法分析急性和慢性ITP患者T细胞基因表达差异情况,旨在为慢性ITP的早期发现和治疗提供依据。
材料和方法
数据来源以“Idiopathic Thrombocytopenic Purpura”为关键词在美国国立生物技术信息中心(NCBI)的GEO公共数据库中进行检索,获得Margareta Jernas等学者于2013年5月提交并于2017年2月更新的GSE46922基因芯片数据(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE46922)。基因芯片数据来源于13例患者(急性ITP患者7例、慢性ITP患者6例)的T细胞RNA标本。GSE数据集总共包含54 675个基因的表达资料,本研究重点分析其生物信息学特征。
差异表达基因分析QOE3.0(http://www.qlucore.com)是由瑞典隆德大学研制的新型生物学分析软件,本研究用QOE对芯片数据进行统计学分析。将GSE46922导入到QOE和R语言软件中,对数据集中的基因芯片数据进行标准正态化处理(μ=0,σ=1),尽可能降低误差的影响;通过过滤后行两独立样本t检验,筛选出急性与慢性ITP两组的差异表达基因。差异基因的筛选标准为:P<0.05,q<0.05,差异倍数>2。q值是差异基因假阳性的概率,q值越低,代表该基因出现假阳性的概率越低,可验证性越高。同时对数据集GSE46922中的基因芯片数据行主成分分析、聚类分析等。
差异表达基因的蛋白互作用网络将两组患者差异表达的前250个基因相应的蛋白名称上传至Networkanalyst在线分析系统(http://www.networkanalyst.ca/faces/home.xhtml),绘制两组差异表达基因的蛋白-蛋白相互作用图谱。根据网络中每个节点的连通度值的大小判断每个节点在网络中的重要性,连通度值越大,表明该节点在网络中的作用越重要。
差异表达基因的基因本体功能富集分析GenCliP 2.0(http://www.genclip.com/)是一个能够对差异表达基因进行特定功能聚类的文献挖掘软件[10]。将差异最明显的20个基因列表上传至人类基因功能和网络分析软件GenCliP,根据需要调节各类分析的主要参数,分析两组患者差异表达基因的基因本体(gene ontology,GO)功能富集状况。
基因雷达调控网络分析在上述蛋白-蛋白相互作用网络和GO功能富集分析的基础上,采用GCBI基因雷达分析关键基因的调控网络。GCBI基因雷达可通过获得多个数据库的支撑以分析每个基因的具体信息。目前,GCBI基因雷达通过分析每个数据库被注释次数反映5万多个基因不同层面的信息。
差异基因的疾病预测能力评价受试者工作特征(receiver operating characteristic,ROC)曲线是一种全面、准确评价诊断试验的有效方法,ROC曲线下面积(area under curve,AUC)>0.5的情况下,AUC越接近于1,说明诊断效果越好。本研究ROC 曲线用于主要差异表达基因对慢性ITP的预测能力评价。
结 果
数据的预处理原始芯片数据集进行标准化(μ=0,σ=1)处理后的相对Log表达值分布情况显示,均数、中位数基本位于一条直线,提示数据稳定可以确保后续分析结果的稳定性(图1)。
急性与慢性ITP基因表达谱分析根据R软件分析结果,急性与慢性ITP患者的基因表达谱有明显差异。所检测的54 675个基因中,急性与慢性ITP之间共有457个(0.84%)差异表达基因。与急性ITP相比,慢性ITP表达下调的基因有159个基因(34.79%),表达上调的基因有298个(65.21%)(图2、表1)。
图 1 标准化后的相对Log表达值分布情况Fig 1 The distribution of relative Log expression after standardization
差异表达基因涉及的GO功能富集分析采用GenClip在线软件分析两组患者前20个差异表达基因的GO功能富集状况,提示差异表达基因与JUN激酶活性等功能相关(图3)。相似生物学功能聚类热图显示,ITCH基因和诱导T细胞的免疫耐受有关,同时能够起到促进T细胞活化和促进细胞间黏附的作用(图4)。
蛋白-蛋白互作用网络根据各个节点的连通度判断,差异表达基因的蛋白-蛋白互作用网络的核心蛋白分别是下调的JUN蛋白和上调的ITCH蛋白,提示JUN和ITCH在慢性ITP的发生发展中发挥关键作用(图5)。
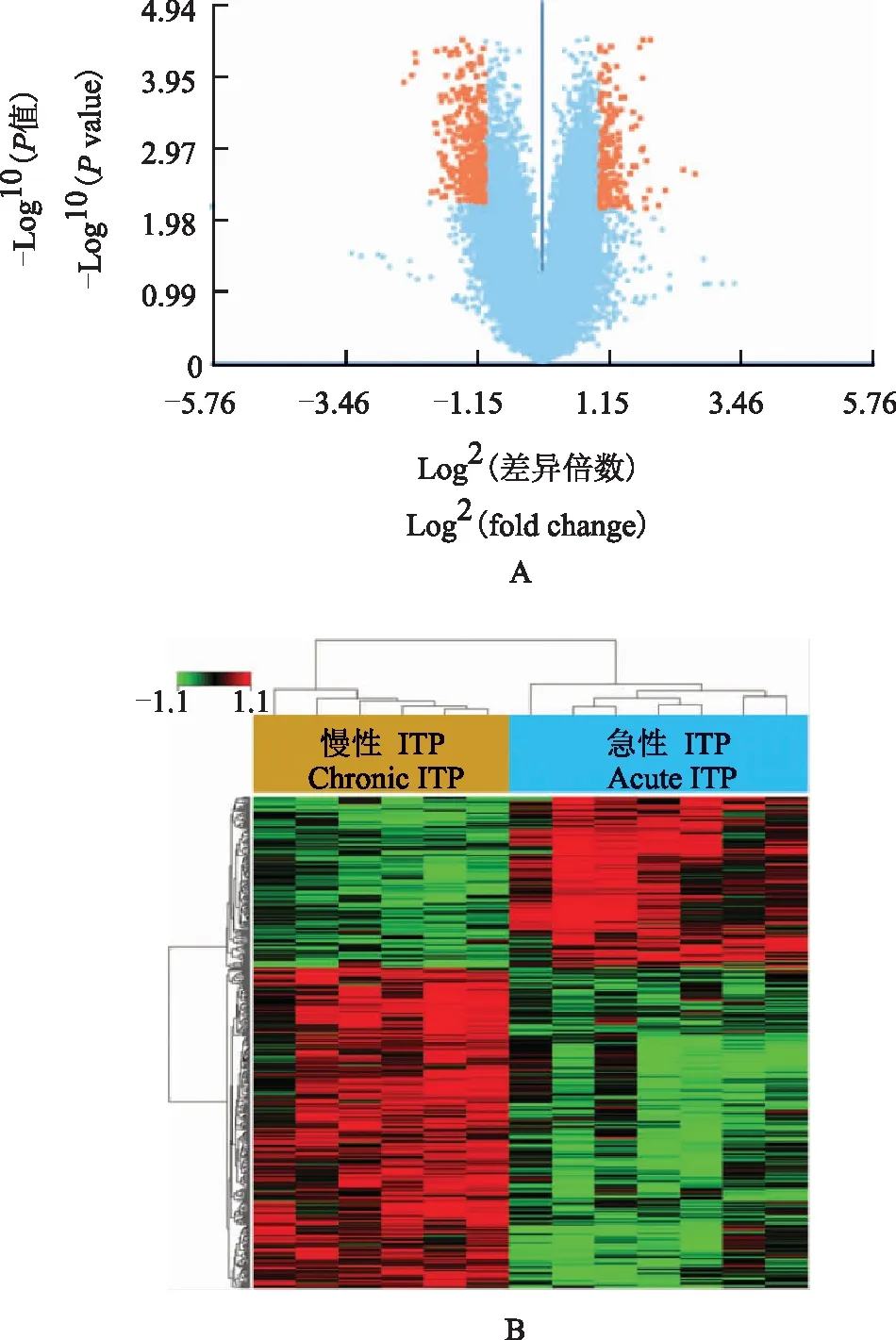
ITP:特发性血小板减少性紫癜ITP:idiopathic thrombocytopenic purpuraA. 火山图;B. 聚类热图A. volcano plot;B. clustering heat maps图 2 急性和慢性ITP患者基因表达谱的比较Fig 2 Gene expression profiles between acute and chronic ITP patients
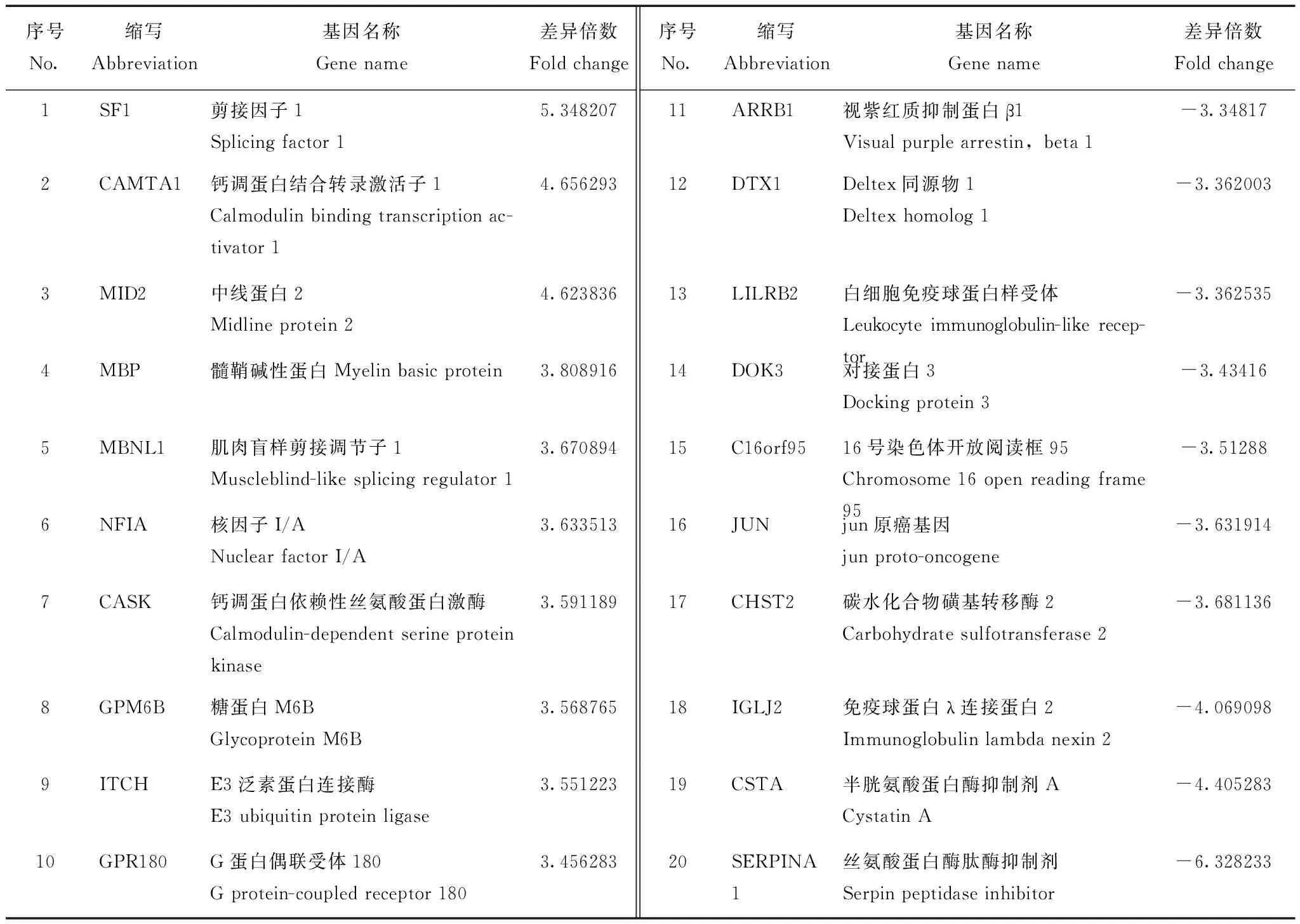
序号No.缩写Abbreviation基因名称Genename差异倍数Foldchange序号No.缩写Abbreviation基因名称Genename差异倍数Foldchange1SF1剪接因子1Splicingfactor15.34820711ARRB1视紫红质抑制蛋白β1Visualpurplearrestin,beta1-3.348172CAMTA1钙调蛋白结合转录激活子1Calmodulinbindingtranscriptionac-tivator14.65629312DTX1Deltex同源物1Deltexhomolog1-3.3620033MID2中线蛋白2Midlineprotein24.62383613LILRB2白细胞免疫球蛋白样受体Leukocyteimmunoglobulin-likerecep-tor-3.3625354MBP髓鞘碱性蛋白Myelinbasicprotein3.80891614DOK3对接蛋白3Dockingprotein3-3.434165MBNL1肌肉盲样剪接调节子1Muscleblind-likesplicingregulator13.67089415C16orf9516号染色体开放阅读框95Chromosome16openreadingframe95-3.512886NFIA核因子I/ANuclearfactorI/A3.63351316JUNjun原癌基因junproto-oncogene-3.6319147CASK钙调蛋白依赖性丝氨酸蛋白激酶Calmodulin-dependentserineproteinkinase3.59118917CHST2碳水化合物磺基转移酶2Carbohydratesulfotransferase2-3.6811368GPM6B糖蛋白M6BGlycoproteinM6B3.56876518IGLJ2免疫球蛋白λ连接蛋白2Immunoglobulinlambdanexin2-4.0690989ITCHE3泛素蛋白连接酶E3ubiquitinproteinligase3.55122319CSTA半胱氨酸蛋白酶抑制剂ACystatinA-4.40528310GPR180G蛋白偶联受体180Gprotein-coupledreceptor1803.45628320SERPINA1丝氨酸蛋白酶肽酶抑制剂Serpinpeptidaseinhibitor-6.328233
图3差异表达基因的基因本体功能富集分析
Fig3Gene oncology function enrichment analysis of the biological functions of differentially expressed genes
基因-通路交互作用网络基因-通路交互作用分析显示,在ITP发生过程中可能被激活的通路包括TNF信号通路、直肠癌信号通路、可卡因成瘾通路,其中TNF信号通路的激活受到JNU、ITCH等基因的作用(图6)。
JUN和ITCH基因在T细胞中的表达水平对急性与慢性ITP患者T细胞关键基因表达水平行两独立样本t检验,与急性患者相比,慢性患者JUN基因表达明显下降(t=2.394,P=0.0356),ITCH表达明显上升(t=2.519,P=0.0328)(图7)。
JUN和ITCH基因对慢性ITP的预测能力采用ROC曲线评价JUN和ITCH诊断和预测慢性ITP的效果,结果显示JUN基因对慢性ITP具有一定预测能力,(AUC=0.8333,P=0.0455;灵敏度=83.33%,特异度=100%)。ITCH基因预测慢性ITP的效果略佳(AUC=0.8667,P=0.0446;灵敏度=100%,特异度=83.33%)(图8)。

图4差异表达基因功能聚类分析
Fig4Clustering analysis of the biological functions of differentially expressed genes

图5差异表达基因的蛋白互作网络
Fig5Network of protein-protein interactions of differentially expressed genes

图6差异表达基因的基因-通路互作用网络
Fig6Network of gene-signaling pathway interactions of differentially expressed genes

图7JUN(A)和ITCH(B)基因在急性与慢性ITP患者T细胞中的表达水平
Fig7Expression of JUN (A) and ITCH (B) in T cell of acute/chronic ITP
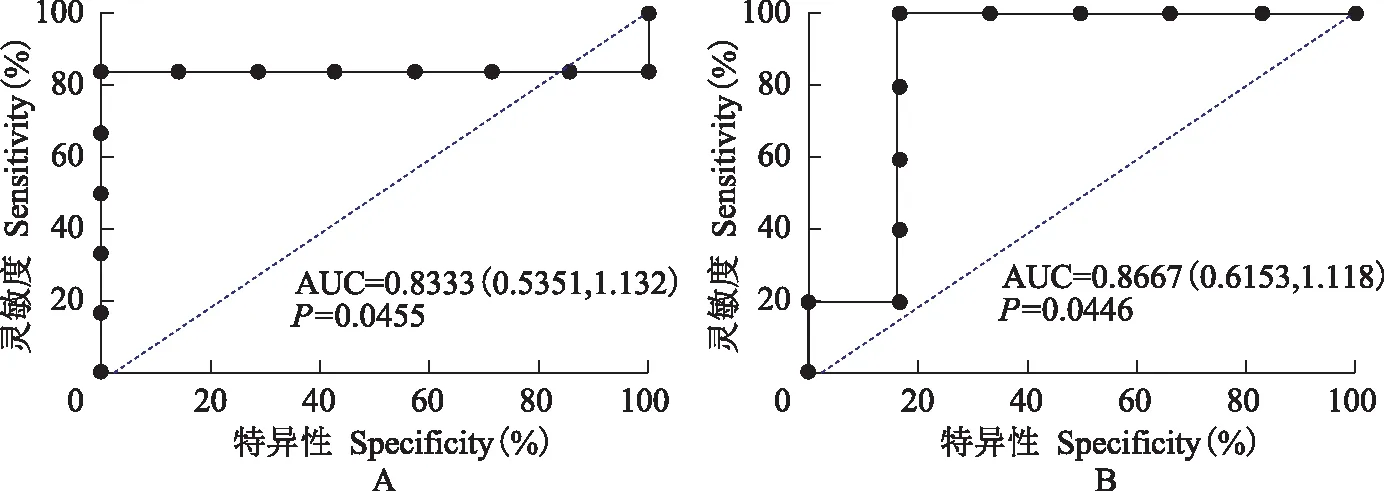
AUC:曲线下面积
AUC:area under curve
图8JUN(A)和ITCH(B)基因诊断慢性ITP的受试者工作特征曲线
Fig8Receiver operating characteristic curves of JUN (A) and ITCH (B) for prediction of chronic ITP
讨 论
近年来,儿童ITP的发病率居高不下,由于发病机制不明,迄今尚无有效治疗方法。与急性ITP儿童相比,慢性ITP患儿出血症状不重,血小板减少程度较轻,但是其预后往往不如急性ITP[11]。李晓红和盛光耀[12]通过研究发现,无论是急性ITP还是慢性ITP患者,随着疾病治疗好转,血清中白细胞介素- 6、白细胞介素8、肿瘤坏死因子α等的水平明显降低,且慢性患者的降低幅度大于急性患者,提示这些血清细胞因子水平可以反映ITP患者的严重程度与疾病转归。慢性ITP病程长,严重影响患儿生活质量并造成严重的家庭负担,本研究旨在从分子水平探索急慢性ITP之间的差异基因通路,为本病的诊断和治疗提供依据。
本研究采用生物信息学分析技术对13例患者T细胞RNA样本的基因芯片检测数据进行进一步细致挖掘和分析,以期找到可以预测慢性ITP的分子标志物。首先,本研究对比了急性ITP和慢性ITP患者T细胞基因表达谱,结果显示两组患者的基因表达谱明显不同,在被检测的54 675个基因中,有457个差异表达基因,表明患者机体T细胞基因表达谱的差别可能影响ITP的病情。究其原因,可能是T细胞基因表达谱发生改变后,进而影响T细胞的正常免疫功能。目前国内外学者对此已有初步探索。冯越[13]研究结果显示,ITP患儿调节性T细胞的数量显著低于健康儿童,且慢性组显著低于急性组,同时,由调节性T细胞分泌的白细胞介素- 10、转化生长因子β1等抑制性细胞因子的浓度也表现为此趋势。该研究提供两点重要信息:(1)ITP的发生、发展与患者机体的免疫功能具有密切关系;(2)调节性T细胞的减少在儿童ITP的发生发展过程中发挥重要作用。另一方面,本研究在上述研究的基础上进行了拓展和延伸,提示T细胞正常免疫功能的发挥受到其基因表达谱的调节;对于ITP患者而言,上述调节发生改变后T细胞的免疫功能受到一定限制,进而影响其预后。
本研究进而对T细胞基因表达谱对ITP的调节作用机制进行初步探索。差异基因互作用网络分析提示,慢性ITP患者ITCH基因的表达水平升高,JUN基因表达水平降低。ITCH蛋白是一种E3泛素连接酶,能够通过泛素化降解转录因子、蛋白酶、受体等多种类型的蛋白质,从而参与体内许多生物学过程,如调控细胞凋亡与分化、调节免疫反应等。ITCH在免疫调节方面的作用主要表现在控制T细胞分化和自身免疫反应方面。研究表明ITCH缺失的小鼠表现出炎症的自身免疫疾病,如肝脏、肾脏、肺等组织细胞及淋巴细胞的浸润[14],人类ITCH基因缺陷的表现亦是如此[15]。这与本研究显示的TICH基因表达水平上调的研究结果不一致,日后课题组将通过独立的实验研究进一步进行验证。JUN是机体内重要的功能蛋白,是丝裂原活化蛋白激酶信号通路、c-JUN氨基末端激酶信号通路等重要的分子,参与机体氧化应激、凋亡、炎性反应等多重功能。另外,有研究显示JUN基因还可影响自身免疫性疾病的发生发展。如:肿瘤坏死因子(tumor necrosis factor,TNF)能够在细胞表面吸引丝裂原活化蛋白激酶通路传递信号给JUN蛋白;同时另有研究显示在ITP、系统性红斑狼疮等自身免疫性疾病中肿瘤坏死因子升高[16- 17]。差异表达基因的基因-通路互作用网络也可说明差异基因互作用网络筛选出的两个关键基因JUN和ITCH均可与肿瘤坏死因子信号通路发生交互作用。由此推断JUN和ITCH基因可能通过激活肿瘤坏死因子信号通路促进急性ITP向慢性ITP的转变。基于上述研究结果,笔者推测在TNF信号通路的调节作用下,二者表达改变,进而影响T细胞的免疫系统,导致如ITP等自身免疫性疾病的发生;结合后续的分析结果,笔者认为若JUN基因表达下降或ITCH表达上升,则提示急性ITP患者转为慢性ITP的可能性较大,需密切观察,并坚持规范治疗。
综上,急慢性ITP患儿机体T细胞的基因表达谱有明显不同,表明T细胞的基因转录谱可能影响ITP的发生和发展;JUN和ITCH基因对ITP患儿病情进展均有一定预测能力,并可能受到TNF信号通路的调节而发挥生物学作用;二者均对ITP病情具有一定预测能力;在今后研究中,课题组拟开展独立的分子生物学实验对上述研究结果进行进一步证实。
[1] 秦平,侯明. 2012版成人原发免疫性血小板减少症诊治的中国专家共识解读[J]. 临床血液学杂志,2013,26(3):151- 155. DOI:10.13201/j.issn.1004-2806. 2013. 02. 006.
[2] 张红,刘庆华,田芳. 急慢性特发性血小板减少性紫癜患者外周血淋巴细胞亚群的表达[J]. 中国实用医药,2014,9(27):25-26. DOI:10.14163/j.cnki.11- 5547/r. 2014.27.238.
[3] 周伟,申昆玲. 儿科学最新诊断与治疗[M].20版.北京:人民军医出版社,2014:803- 805.
[4] 黄淑蓉. 儿童慢性特发性血小板减少性紫癜研究进展[J]. 实用医院临床杂志,2009,6(4):148- 150. DOI:10.3969/j.issn.1672- 6170.
[5] Stasi R,Evangelista ML,Stipa E,et al. Idiopathic thrombocytopenic purpura:current concepts in pathophysiology and management[J]. Thromb Haemost,2008,99(1):4- 13. DOI:10.1160/TH07- 08-0513.
[6] McMillan R. The pathogenesis of chronic immune thrombocytopenic purpura [J]. Semin Hematol,2007,44 (4Suppl 5):S3- S11. DOI:10.1053/j.senubgenatol. 2007. 11.002.
[7] Lazarus AH,Semple JW,Cines DB. Innate and adaptive immunity in immune thrombocytopenia[J]. Semin Hematol,2013,50 (Suppl 1):S68- S70.DOI:10.1053/j.seminhematol.2013.03.012.
[8] 钟隽,陈少华,郁志,等. ITP中T细胞活化信号分子c-Cbl和Cbl-b的表达变化[J].暨南大学学报(自然科学与医学版),2016,37(6):472- 475. DOI:10.11778/j.jdxb.2016.06.005.
[9] 邸鑫. ITP患者外周血T细胞FADD 表达对T细胞凋亡通路的调控作用[D]. 吉林长春:吉林大学,2015:1- 41.
[10] Huang ZX,Tian HY,HU ZF,et al. Genclip:a software program for clustering gene lists by literature profiling and constructing gene co-occurrence networks related to custom keywords[J]. BMC Bioinformatics,2008,13(19):308. DOI:10.1186/1471- 2105- 9- 308.
[11] 左尚明. 48例大剂量地塞米松冲击治疗儿童慢性特发性血小板减少性紫癜的临床疗效观察[J]. 中国妇幼卫生杂志,2013,4(2):51- 52.
[12] 李晓红,盛光耀. 儿童特发性血小板减少性紫癜多项细胞因子测定价值研究[J]. 现代预防医学,2011,38(15):2964- 2967.
[13] 冯越. 急慢性ITP患儿调节性T细胞及相关细胞因子改变的研究[J].临床军医杂志,2011,39(5):955- 956. DOI:10.j.issn.1671- 3286.2011.05.51.
[14] Matesic LE,Copeland NG,Jenkins NA. Itchy mice:the identification of a new pathway for the development of autoimmunity[M].Springer-Verlag Berlin Heidelberg:Current Topics in Microbiology Immunology,2008:185- 200. DOI:10.1007/978- 3- 540- 75203- 5.
[15] Lohr NJ,Molleston JP,StraussKA,et al. Human ITCH E3 ubiquitin ligase deficiency causes syndromic multisystem autoimmunedisease[J]. Am J Hum Genet,2010,86(3):447- 453. DOI:10.1016/j.ajhg.2010.01.028.
[16] Stohl W,Metyas S,Tan SM,et al. B lymphoeyte stimulator overexpression in patients with systemic lupus erythematosus:longitudinal observations[J]. Anhritis Rheum,2003,48(12):3475- 3486. DOI:10.1002/art.11354.
[17] 朱效娟. B细胞活化因子在ITP中的机制研究[D]. 山东济南:山东大学,2010:1- 151.

