海南山竹果实不同部位多酚提取物抗氧化活性、乙酰胆碱酯酶和α-葡萄糖苷酶抑制活性研究
谭 琳,周兆禧,王甲水,马伏宁,康由发
(1.中国热带农业科学院海口实验站/海南省香蕉遗传改良重点实验室,海南 海口 570102;2.海南大学城西校区管委会,海南 海口 571101)
乙酰胆碱是参与学习记忆等生理活动的一种重要神经递质。乙酰胆碱酯酶抑制剂能够抑制乙酰胆碱酯酶的活性,提高脑内乙酰胆碱的水平,从而延缓阿尔次海默症病情的发展[1]。α-葡萄糖苷酶抑制剂可竞争性抑制小肠内各种α-葡萄糖苷酶活性,降低餐后血糖水平的升高,可用于糖尿病的治疗[2]。近年研究发现,一些水果多酚在具有抗氧化性的同时,还能够抑制乙酰胆碱酯酶或α-葡萄糖苷酶的活性[3],这为人们通过膳食预防或治疗阿尔次海默症和糖尿病等慢性疾病提供了理论依据。因此,对水果中的功能因子进行相关活性评价,已经成为果品营养学研究的热点。
山竹(Garcinia mangostana)也称凤果、倒稔子或莽吉柿,是一种藤黄科藤黄属热带水果,广泛分布于马来西亚、泰国、印度尼西亚和菲律宾等东南亚国家[4-5],目前在我国台湾、广东、广西、云南和海南等地也有种植。山竹果重55~75 g,果肉白色透明,果实可食部分占29%~45%,不仅味道鲜美,而且营养丰富,含有多种氨基酸、蛋白质、脂肪 、维生素B以及丰富的矿物质和微量元素[6]。山竹果皮作为传统医药,被广泛用于治疗腹痛、腹泻、痢疾、感染性创伤、化脓、慢性溃疡等疾病[7]。近年来,人们对山竹果皮中的多酚及其化学成分开展了大量的抗氧化[8]、防癌[9]、抑菌[10]和抗癌活性评价[11],但是对山竹果肉多酚的抗氧化活性、乙酰胆碱抑制活性和α-葡萄糖苷酶抑制活性的报道极少,且产地不同的山竹其果皮多酚的含量及生物学活性可能存在差异。为此,本研究对海南山竹果肉和果皮的多酚含量、多酚的抗氧化活性以及乙酰胆碱酯酶和α-糖苷酶的抑制活性进行了测定,为引导山竹消费提供理论依据,为山竹的开发利用奠定基础。
1 材料与方法
1.1 试验材料
供试山竹果实于2014年10月30日采自海南省五指山毛道乡山竹果园。
主要试剂:没食子酸(gallic acid,GA),为阿拉丁试剂上海有限公司产品;乙酰胆碱酯酶(acetylcholine esterase)、5,5’-二硫代双(2-硝基苯甲酸)(dithiobisnitrobenzoicacid,DTNB)、碘化硫代乙酰胆碱(acetylthiocholine iodide,ATCI)、4-硝基苯基-β-D-吡喃葡萄糖苷(p-nitrophenyl-β-D-galactopyranoside,PNPG)、α-葡萄糖苷酶,购自美国Sigma公司。
仪器与设备:UV-1800紫外-可见分光光度计(日本岛津公司)、Thermo Multiskan FC全自动酶标仪(美国Thermo Scientific 公司)。
1.2 试验方法
1.2.1 山竹果皮和果肉多酚的提取 将山竹果皮和果肉分离,40℃烘干后粉碎,过孔径245 μm筛。称取2.5 g样品,加入95%乙醇100 mL,微波辅助提取(300 MHz,40℃)3 h,过滤,滤液旋转蒸发后,得到山竹果皮和果肉浸膏(多酚提取物)。
1.2.2 总酚含量的测定 采用Singleton等[12]的福林-酚比色法。将山竹果皮和果肉浸膏用无水乙醇配制成浓度为1 mg/mL的样品,取0.2 mL样品和 0.5 mL双蒸水、125 μL的Folin-Ciocalteu试剂反应6 min后,加入4 mL 2%(W/V)碳酸钠溶液及1 mL双蒸水,暗处反应90 min后,760 nm波长处检测吸光度。总酚含量用没食子酸为标准进行定量,最终的山竹果皮和果肉总酚含量用每克干粉所含有的没食子酸当量表示(mg GAE/g)。
1.2.3 羟自由基(·OH)清除能力的测定 参照陈健等[13]的方法,将山竹果皮和果肉浸膏用双蒸水配制成浓度为0.25~4 mg/mL的样品。在试管中依次加入1 mL 0.75 mmol/L邻二氮菲溶液、1 mL 0.1 mol/L磷酸盐缓冲液、1 mL双蒸水、1 mL 0.75 mmol/L硫酸亚铁溶液,充分混匀后,加入1 mL 0.01% 过氧化氢,37℃水浴1 h,在536 nm波长处测吸光度(A损,损伤管),以Vc作为阳性对照。IC50值为自由基清除率达到50%时的样品浓度,·OH清除率计算公式如下:

式中,A空为用双蒸水代替A损反应中的过氧化氢时的吸光度;A样为用样品代替A损反应中的双蒸水时的吸光度。
1.2.4 DPPH自由基清除能力的测定 参照文献[14]的方法,将山竹果皮和果肉浸膏用无水乙醇配制成0.25~4 mg/mL的样品,取0.2 mL样品溶液和2 mL含0.1 mmol/L DPPH的95%乙醇在室温反应30 min,517 nm波长处测定吸光度。DPPH清除率计算公式如下:
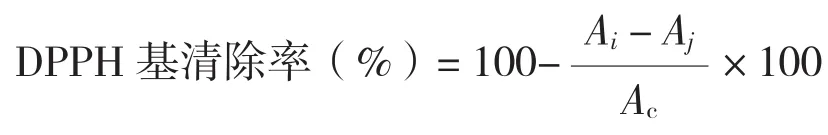
式中,Ai为样品吸光度,Ac为对照吸光度,Aj为样品本底吸光度。
1.2.5 ABTS自由基清除能力的测定 采用郑晓燕等[15]的方法,将山竹果皮和果肉多酚浸膏用双蒸水配制成浓度为0.25~6 mg/mL的溶液,取0.2 mL各浓度样品和1.9 mL ABTS+·工作液反应6 min,于 734 nm波长处量取吸光度(Ai),以Vc作为阳性对照,计算ABTS+·清除率:

式中,Aj为以双蒸水取代ABTS+·工作液反应体系的吸光度,A0为以双蒸水取代样品溶液反应体系的吸光度。

1.2.6 乙酰胆碱酯酶抑制活性的测定 采用文献[16-17]的方法,并稍作改动。将山竹果皮和果肉浸膏用PBS配制成62.5~1 000 μg/mL的样品,在96 孔板中依次加入50 μL PBS、25 μL样品、25 μL乙酰胆碱酯酶(1.0 μg/mL),4℃放置20 min,然后加入25 μL ATCI (0.30 mg/mL)、125 μL DTNB(0.59 mg/mL),37℃孵育20 min,以石杉碱甲为阳性对照,在405 nm波长处测定吸光度。计算乙酰胆碱酯酶活性抑制率:1.2.7 α-糖苷酶抑制活性的测定 参照朗国竣[18]的方法,将山竹果皮和果肉浸膏用PBS配制成1~5 mg/mL的样品,在96 孔板中依次加入 90 μL PBS缓冲液、20 μL 0.57 U/mL α-葡萄糖苷酶、10 μL 3 mmol/L谷胱甘肽溶液、20 μL样品,37℃反应15 min后,加入10 mmol/L PNPG 40 μL,37℃反应15 min,于405 nm波长处测定吸光度。同时设定相同条件下样品空白对照、阴性对照、空白对照以及以阿卡波糖为抑制剂的阳性对照。按下式计算α-糖苷酶活性抑制率,并求出相应IC 值:

采用Excel 2007绘制曲线,利用Excel中的FORECAST命令,通过线性回归方程,返回一个预测值,计算IC50値,使用SPSS19.0分析数据。
2 结果与分析
2.1 山竹果皮、果肉总酚含量
采用福林-酚比色法测定了山竹果皮、果肉的总酚含量,没食子酸对照品在20~100 μg的范围内线性良好,标准曲线方程为Y=0.0008X + 0.0559(R2= 0.997),测定获得的山竹果皮中的多酚含量为21.36 mg/g(干重),山竹果肉多酚为0.388 mg/g(干重)。
2.2 山竹果皮、果肉多酚的·OH清除能力
从图1可以看出,当山竹果皮多酚浓度为50 μg/mL时,清除率已达51.8(±1.41)%。随着浓度的增加,清除活性也逐渐上升。当浓度为200 μg/mL时,清除率达95.66(±1.74)%,与对照Vc相比,其清除能力更强(P<0.05)。山竹果皮多酚清除·OH的IC50值为37.39(±3.63) μg/mL。山竹果肉多酚在浓度为50 μg/mL时,对·OH的清除能力很弱,仅为5.72(±0.14)%,但是其清除能力表现出随浓度增加而增强的趋势。在山竹果肉多酚浓度为800 μg/mL时,其清除活性达50.37(±1.13)%。

图1 山竹果皮、果肉多酚的·OH清除活性
2.3 山竹果皮、果肉多酚的DPPH自由基清除能力
由图2可知,当山竹果皮多酚浓度为25 μg/mL时,其清除 DPPH的活性为27.82(±1.28)%,随着浓度的增大,山竹果皮多酚对DPPH自由基的清除活性明显增强,当山竹果皮多酚浓度达到100 μg/mL时,其对DPPH自由基清除率达到86.75(±1.72)%。之后随着浓度增加,清除能力逐渐达到饱和。山竹果皮多酚对DPPH自由基的清除能力与Vc的清除能力没有显著差异。其清除DPPH自由基的IC50值为46.34(±1.35) μg/mL。相对而言,山竹果肉多酚清除 DPPH自由基的能力较弱,当其浓度为400 μg/mL时,清除活性仅为20.37(±0.83)%,与Vc相比有极显著差异。
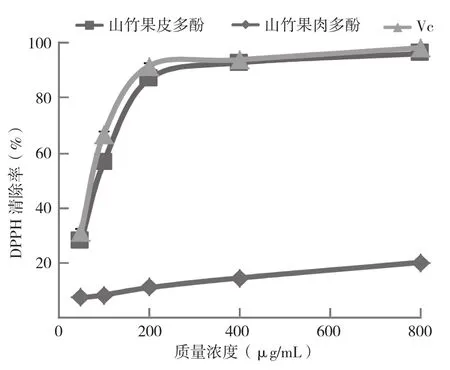
图2 山竹果皮、果肉多酚的DPPH自由基清除活性
2.4 山竹果皮、果肉多酚的ABTS+·清除能力
从图3可以看出,当山竹果皮多酚浓度为25 μg/mL时,对ABTS+·的清除能力为30.52(±1.28)%。随着浓度的增加,其ABTS+·清除能力逐渐增强,当浓度为100 μg/mL时,山竹果皮多酚对ABTS+·的清除率达90.52(±1.2)%,与Vc的ABTS+·清除能力相当。山竹果皮多酚清除ABTS+·的IC50为41.37(±0.98)μg/mL。山竹果肉多酚浓度为25 μg/mL时,对ABTS+·清除活性为12.02(±0.81)%。随着浓度的增加,清除活性也随之增加。当浓度为600 μg/mL时,其清除活性达65.41(±1.21)%。与山竹果皮多酚和Vc相比有显著差异,其IC50为361.96(±17.58) μg/mL。

图3 山竹果皮、果肉多酚的ABTS+· 清除活性
2.5 山竹果皮、果肉多酚的乙酰胆碱酯酶抑制活性
从图4可以看出,当山竹果皮多酚浓度为25 μg/mL时,对乙酰胆碱酯酶活性的抑制率达到51.5(±1.14)%。当浓度为100 μg/mL时,其抑制率达87.18(±2.4)%,其 IC50为29.46(±0.25) μg/mL。山竹果肉多酚对乙酰胆碱酯酶抑制活性较弱,浓度为100 μg/mL时抑制率仅为20.87(±0.89)%。在一定浓度范围内,抑制率呈现浓度依赖效应,但活性低,与阳性对照石杉碱甲相比有极显著差异。

图4 山竹果皮、果肉多酚的乙酰胆碱酯酶抑制活性
2.6 山竹果皮、果肉多酚的α-葡萄糖苷酶抑制活性
从图5可以看出,当山竹果皮多酚浓度为1 mg/mL时,对α-葡萄糖苷酶抑制活性达89.74(±2.2)%,表现出比阳性对照阿卡波糖更强的抑制活性(P<0.05)。随着质量浓度的增加,抑制活性略有增强并趋于饱和,其IC50为7 μg/mL。山竹果肉多酚在浓度为1 mg/mL时,对α-葡萄糖苷酶抑制活性为32.17(±0.83)%。随着浓度增加,抑制活性也上升。当浓度为2 mg/mL时,抑制活性达52.2(±1.39)%,其IC50为 2.24(±0.06) mg/mL。

图5 山竹果皮、果肉多酚的α-葡萄糖苷酶酶抑制活性
3 讨论
本研究以体积分数95%的乙醇提取了产自海南山竹的果皮和果实多酚,Folin-酚法测定其总酚含量分别为21.36、0.388 mg/g(干重)。山竹果皮多酚对·OH、DPPH自由基和ABTS+·均具有良好的清除活性,并且呈现浓度依赖性,IC50值分别为37.39(±3.63)、41.34(±1.55)、41.37(±0.98) μg/mL。陶钰等[19]从广西市售的山竹果皮提取的多酚对·OH 、DPPH自由基清除能力的IC50值分别为55.1(±0.7)、32.5(±0.5) μg/mL。张晓南等[20]从哈尔滨市售山竹果皮中提取的多酚物质清除DPPH·自由基IC50值为15.69 μg/mL,表明海南山竹果皮多酚的抗氧化活性与其他地区的相比差异不大。
海南山竹果皮多酚还具有显著的α-糖苷酶抑制活性和乙酰胆碱酯酶抑制活性,这可能与果皮中含有的氧杂蒽酮有关。研究显示,氧杂恩酮是山竹中的主要活性成分,在植物营养素家族中有着强大的抗氧化能力,而α-倒捻子素是其中一种最重要的天然氧杂蒽酮衍生物之一,具有良好的α-糖苷酶活性抑制[21]。Khaw等[22]研究发现,山竹果皮中的异戊烯基氧杂蒽酮类化合物具有乙酰胆碱酯酶抑制活性。
山竹果肉多酚对·OH、DPPH自由基和ABTS+·的清除活性显著低于山竹果皮多酚,其酚含量也远低于山竹果皮酚含量,这表明山竹的酚含量与其抗氧化活性、乙酰胆碱酯酶抑制活性和α-糖苷酶抑制活性有密切关系。
综上,本试验体外研究表明,海南山竹果皮多酚具有强抗氧化性、乙酰胆碱酯酶抑制活性和α-糖苷酶抑制活性;山竹果肉多酚也具有一定的抗氧化性和乙酰胆碱酯酶抑制活性以及中等程度的α-糖苷酶抑制活性,但它们在体内是否能够发挥同样的效应尚不得而知。因此,有必要进一步通过体内实验验证山竹果皮、果肉多酚的抗氧化活性、乙酰胆碱酯酶抑制活性和α-糖苷酶抑制活性。
参考文献:
[1]刘艳玲,李奴英. 乙酰胆碱酯酶抑制剂治疗老年痴呆症的研究进展[J]. 山西医药杂志,2008,37(1):64-66.
[2]刘杰超,焦中高,王思新. 苹果多酚提取物对α-淀粉酶和α-葡萄糖苷酶的抑制作用[J].果树学报,2011,28(4):553-557.
[3]Choi J S,Bhakta H K,Fujii H,et al. Inhibitory evaluation of oligonol on α-glucosidase,protein tyrosine phosphatase 1B,cholinesterase,and β-secretase 1 related to diabetes and Alzheimer's disease[J]. Arch Pharm Res.,2016,39(3):409-420.
[4]Shan T,Ma Q,Guo K,et al. Xanthones from mangosteen extracts as natural chemopreventive agents:potential anticancer drugs[J]. Curr Mol Med,2011,11:666-677.
[5]Pedraza-Chaverri J,Cárdenas-Rodríguez N,Orozco-Ibarra M,et al. Medicinal properties of mangosteen(Garcinia mangostana)[J]. Food Chem Toxicol,2008,46:3227-3239.
[6]蒋侬辉,李春雨,戴宏芬,等. 山竹的食用药用价值及综合利用研究进展[J]. 广东农业科学,2011,38(3):50-53.
[7]Tousian S H,Razavi B M,Hosseinzadeh H.Review of Garcinia mangostana and its xanthones in metabolic syndrome and related complications[J]. Phytother Res,2017,31(8):1173-1182.
[8]龙云飞,龙丽群,杨克迪. 山竹果皮提取物抗氧化活性的研究[J]. 食品工业科技,2010,31(6):127-129.
[9]王晓波,李金芳,王梅,等. 山竹壳总黄酮抗氧化及抑制亚硝化作用研究[J]. 食品研究与开发,2013,34(6):9-13.
[10]Wang M H,Zhang K J,Gu Q L,et al.Pharmacology of mangostins and their derivatives:A comprehensive review[J]. Chin J Nat Med,2017,15(2):81-93.
[11]Shan T,Ma Q,Guo K,et al. Xanthones from mangosteen extracts as natural chemopreventive agents:potential anticancer drugs[J]. Curr Mol Med,2011,11(8):666-677.
[12]Singleton V L,Orthofer R,Lamuela-Raventos R M. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteau reagent[J]. Methods of Enzymology,1999,299:152-178.
[13]陈健,欧阳玥,闫静. 磷酸盐缓冲溶液对邻二氮菲-Fe2+氧化法测定羟基自由基的影响[J]. 分子科学学报,2012,28(4):350-352.
[14]Li P Y,Huo L N,Su W,et al. Free radicalscavenging capacity,antioxidant activity and phenolic content of Pouzolzia zeylanica[J]. J Serb Chem Soc,2011:76(5):709–717.
[15]郑晓燕,王甲水,白林林,等. 四个油梨品种果实多酚提取物抗氧化活性及乙酰胆碱酯酶抑制活性研究[J]. 中国南方果树,2016,45(5):69-75.
[16]Seyed B J,Arash A,Naghmeh G,et al. A preliminary investigation of anticholinesterase activity of some Iranian medicinal plants commonly used in traditional medicine[J].DARU Journal of Pharmaceutical Sciences 2014,22(17):1-5.
[17]杨中铎,赖东海,张东博,等. 具有乙酰胆碱酯酶抑制活性的总生物碱提取物的筛选. 中医药学报. 2011,39(3):71-74.
[18]朗国竣. 微生物源-葡萄糖苷酶抑制剂筛选、分离纯化及产生菌的鉴定[D]. 上海:上海师范大学,2007:17-18.
[19]陶钰,黄丽,韦保耀,等. 山竹果皮植物多酚及其抗氧化活性研究[J],食品工业科技,2009,30(12):126-129.
[20]张晓南,江莲洲,崔茹,等. 山竹多酚匀浆的提取条件优化及抗氧化活性[J]. 食品科技,2015,40(11):225-234.
[21]Guo M,Wang X M,Lu X W,et al. α-Mangostin Extraction from the native mangosteen(Garciniamangostana L.)and the binding mechanisms of α-Mangostin to HAS or TRF[J].PLoS ONE,2016,11(9):1-22.
[22]Khaw K Y,Choi S B,Tan S C,et al. Prenylated xanthones from mangosteen as promising cholinesterase inhibitors and their molecular docking studies[J]. Phytomedicine,2014,21(11):1303-1309.

