紫外线和热力对55型腺病毒的灭活效果
刘 媛,王文博,邹自英,邱 薇,范泉水,冯子良,熊 杰
人腺病毒(human adenovirus,HAdV)是一类无包膜的双链DNA病毒,分为A~G 7个血清学组,60多个血清型。其中B组腺病毒感染目前已成为急性呼吸系统疾病的重要病原,其中引起军队新兵呼吸道感染流行的主要是腺病毒3型、7型和55型[1-5]。其中55型腺病毒(HAdV-55)是基于HAdV-B14型基因组骨架嵌合HAdV-B11型Hexon部分片段的重组新病毒,属于B组的B2亚组。该病毒第一次在我国引起感染疫情发生在2006年3~4月陕西岐山县[3]。近年来,HAdV-B55在成人特别是在学校和军队特殊人群中,引起日益频繁的急性呼吸道传染病流行[4-5]。另外也有研究表明,HAdV-55感染是成人社区获得性肺炎的重要病因之一,成人腺病毒肺炎流行有明显季节性,多在每年的2~3月份流感流行后期发生[6]。
由于腺病毒属于DNA病毒,且没有包膜,病毒本身比较稳定,能够在环境中存活时间相对较长。为了解紫外线和热力对HAdV-55的灭活效果,本研究开展了相关实验,现将结果报告如下。
1 材料与方法
1.1 细胞和试剂 人喉癌上皮细胞HEp-2购自中国科学院上海细胞库,由本实验室保存培养;GIBCO胎牛血清、DMEM、青/链霉素、Invitrogen PureLinkTMViral RNA/DNA Mini Kit购自赛默飞世尔科技(中国)有限公司;引物和PCR试剂购自成都擎科梓熙生物技术有限公司;生化试剂购自上海生工生物工程有限公司。
1.2 HAdV-55毒株 病毒毒株SF04/SC/2016为本实验室前期从HAdV-55感染者咽拭子标本中分离获得,按照Reed-Muench公式计算病毒滴度为2.5×105,具体信息见参考文献[7]。
1.3 紫外线对HAdV-55的灭活试验 取100μl病毒液(滴度为2.5×105)平铺于48孔板底部,均匀涂布孔底,形成一层薄层,随机分为紫外照射30min组、1 h组和2 h组及对照组。紫外照射组置于超净台紫外灯下,紫外线波长254 nm,功率20瓦(W),距离60 cm,分别照射30min、1 h和2 h;对照组不进行紫外线照射。紫外线照射组照射完成后,采用实时定量PCR(RT-PCR)法检测病毒液中HAdV-55 DNA水平。然后将4组分别接种HEp-2细胞,1×105个/孔,置于37℃、5%CO2饱和湿度培养箱中培养。培养24 h后,检测细胞内病毒DNA水平;培养72 h后,收集细胞上清,采用Reed-Muench法检测上清液中病毒滴度。
1.4 热力对HAdV-55的灭活试验 将100μl病毒(滴度为2.5×105)加入1.5 ml离心管中,随机分为热力灭活30min组、1 h组和2 h组及对照组。热力灭活组置于恒温水浴锅内,温度设置为65℃,时间分别为30 min、1 h和2 h,对照组不进行热力灭活,置于4℃暂存。热力处理完成后,采用RT-PCR法检测病毒液中HAdV-55 DNA水平。然后将4组病毒液各100μl分别置于48孔板中,接种HEp-2细胞,细胞密度 1×105个/孔,于 37℃、5%CO2饱和湿度培养箱中培养。此后,细胞内和细胞培养上清中病毒的检测方法和步骤同1.3。
1.5 RT-PCR方法 采用Invitrogen PureLinkTMViral RNA/DNA Mini Kit提取上述病毒分离液的腺病毒DNA,具体操作参照说明书进行。建立HAdV-55DNA检测的标准曲线,对提取的腺病毒DNA水平进行定量检测。相对定量以GAPDH作为内参基因,采用ΔΔCt法分析各组HAdV水平。所用引物如下,HAdV-F:5'-AGATGAAGAAAGTAAACCGATTT-3';HAdV-R:5'-CCATCAAGGTCAGTCCAA-3',预期产物86 bp;GAPDH-F:5'-TGGGCTACACTGAGCACCA G-3',GAPDH-R:5'-AAGTGGTCGTTGAGGGCAAT-3',预期产物 100 bp。
1.6 统计学方法 应用 SPSS 15.0软件分析,计量数据以x±s表示,多组间差异采用单因素方差分析,两组间比较采用Tukey检验,假设检验水准α=0.05。
2 结果
2.1 紫外线对HAdV-55的灭活效果 紫外线照射30min、1 h和2 h后,紫外线照射组HAdV-55 DNA水平与对照组相比无显著差异(P>0.05,图1A)。但紫外线照射组病毒感染HEp-2细胞水平降低,与对照组相比,紫外线照射30 min组细胞内病毒DNA水平降低约50%;紫外线照射1 h和2 h组细降低约 2个数量级(P<0.05,图1B)。
进一步检测细胞培养上清中子代病毒滴度,结果显示,对照组子代病毒滴度为(2.5±0.10)×105,紫外线照射30min组、1 h组和2 h组分别为(1.9±0.08)×103、(5.7±0.08)×10 和(2.3±0.05)×10。见图 2。

图2 各组子代病毒滴度比较
2.2 热力对HAdV-55的灭活效果 65℃热力灭活30min、1 h和2 h后,热力灭活组HAdV-55 DNA水平与对照组相比显著降低(P<0.05,图3A)。热力灭活组病毒感染HEp-2细胞水平也降低,65℃处理30 min、1 h和2 h,病毒感染HEp-2水平降低>104个数量级(P< 0.05,图 3B)。
热力灭活病毒感染细胞产生子代病毒的滴度也显著降低。65℃处理30min病毒组感染细胞产生的子代病毒滴度为(2.04±0.06)×101;而 1 h 组和 2 h组产生的子代病毒,不能再次感染细胞。
3 讨论
人腺病毒属腺病毒科,是无包膜的DNA病毒,病毒的核心由双链DNA及蛋白质组成,病毒的衣壳呈规则的20面体结构,直径80~110 nm。人腺病毒无类脂质包膜,耐乙醚和氯仿等脂溶性消毒剂,耐酸,在环境中稳定性相对较高。由于病毒的有效灭活涉及到病毒的传播和控制、生物安全等多个方面,因此,探讨紫外线和热力对腺病毒的灭活效果具有重要意义。
目前腺病毒的灭活主要使用含氯消毒剂。李杰等[8]研究了常用消毒剂对HAdV-55的灭活效果,发现用含有效氯400 mg/L的次氯酸钠和600mg/L的过氧乙酸作用20min,或含有效碘1000mg/L的碘伏溶液作用40min,对HAdV-55的灭活对数值可≥4.00;而醋酸氯己定和苯扎氯铵等低效消毒剂对该病毒的灭活作用稍弱。

图1 紫外照射对HAdV-55活力的影响
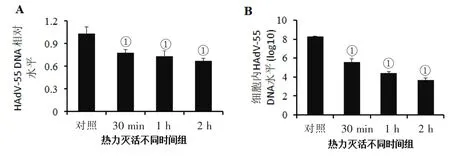
图3 热力灭活对HAdV-55病毒活力的影响
杨玲等[9]报道了紫外线照射对腺病毒气溶胶活力和粒级分布的影响,采用HEK293包装细胞制备绿色荧光蛋白标记的重组腺病毒,通过在荧光显微镜计数带绿色荧光的PKl5细胞数以检测病毒的感染力及活力,发现波长为254 nm的紫外线照射5 min时,细胞内感染的病毒数即明显减少;254 nm紫外线照射30min时,感染细胞内不能检测到绿色荧光。该研究还发现波长为254 nm的紫外线比365 nm的紫外线照射灭活腺病毒气溶胶的效果更显著。
本研究发现,波长254 nm的紫外线照射HAdV-55,对病毒DNA水平影响不大,但显著降低病毒的感染活力。紫外线照射30 min后,细胞内病毒DNA水平降低约50%;照射1 h和2 h,细胞内病毒DNA水平降低约2个数量级,而且病毒感染细胞产生子代病毒的滴度也显著降低,均证明紫外线照射可在一定程度上灭活腺病毒,采用紫外线照射能在一定程度上控制腺病毒的传播。但由于实验条件所限,本研究采用的紫外灯功率为20W,照射距离为60 cm,仅设置了照射时间一个变量。此外,由于紫外灭活的效果与时间、距离、功率、环境温度、湿度等都有关,因此,在实际工作中,可通过适当延长紫外照射时间、缩短照射距离、提高照射功率等方法,提高灭活效果。
文献报道,不同温度对病毒灭活强弱效果也有差异[10-11],65℃灭活病毒可作为筛选灭活疫苗株的一个条件。本研究结果显示,热力对HAdV-55的灭活作用较强,65℃处理30 min后,病毒感染水平的对数值降低4.0左右,产生子代病毒的滴度显著降低;65℃处理1 h和2 h后,HAdV-55感染细胞产生的新病毒极少。因此,对腺病毒污染物品进行加热消毒是可行且有效的。
254 nm紫外线和65℃热力对HAdV-55均有不同程度的灭活作用,其中紫外线照射可作为实验室空间整体消毒的一种方法,热力灭活可作为筛选灭活疫苗株的一种手段,其中65℃热力对HAdV-55处理1 h以上可使其不能产生子代病毒,为后续研究HAdV-55灭活疫苗提供参考。
【参考文献】
[1]袁跃彬,赵京生,段新科,等.腺病毒3型急性呼吸道感染暴发流行的病原学诊断[J].第三军医大学学报,2010,32(22):2468-2469.
[2]王琳,陆海宇,刘其会,等.人类腺病毒B组7型致军营聚集性感染的临床特征[J].中华传染病杂志,2015,33(2):79-82.
[3]杨朝辉.人腺病毒11a型的全基因序列测定及分析研究[D].兰州:兰州大学,2009.
[4]Lu Qingbin,Tong Yigang,Wo Y,et al.Epidemiology of human adenovirus and molecular characterization of human adenovirus 55 in China,2009-2012 [J].Influenza&Other Respiratory Viruses,2014,8(3):302-308.
[5]Li X,Mei K,Xu S,et al.An outbreak of acute respiratory disease in China caused by human adenovirus type B55 in a physical training facility[J].International Journal of Infectious Diseases,2014,28:117-122.
[6]Cao B,Huang GH,Pu ZH,et al.Emergence of communityacquired adenovirus type 55 as a cause of community-onset pneumonia[J].Chest,2014,145(1):79-86.
[7]刘媛,王文博,邹自英,等.快速获取 55型腺病毒基因组序列的方法[J].微生物学通报,2017,44(11):2708-2713
[8]李杰,魏秋华,饶林,等.常用消毒剂对新发现腺病毒55型灭活效果研究[J].中国消毒学杂志,2016,33(5):405-407.
[9]杨玲,李晓岩,毕新慧,等.紫外线照射对腺病毒气溶胶活力和粒级分布的影响[J].中华生物医学工程杂志,2007,13(5):286-289.
[10]饶林,王太星,蒋莉,等.紫外线和热力灭活脊髓灰质炎病毒效果的试验观察[J].中国消毒学杂志,2001,18(2):69-74.
[11]李晓东,廖昊,刘妍,等.60℃加热1 h灭活病毒方法对常规临床检测指标的影响研究[J].传染病信息,2016,29(3):160-163.

