纤维支气管镜肺泡灌洗治疗不同病因导致肺部感染效果观察
孙春荣 杨霁 薛兵
北京市垂杨柳医院呼吸科,北京 100022
肺部感染包括支气管扩张感染、肺脓肿、吸入性肺炎、呼吸机相关性肺炎等多种病因[1]。以敏感抗生素辅以雾化、体位引流等的综合手段有时临床效果不够理想,其原因与局部抗生素有效浓度低、粘膜充血水肿所致引流不畅有关[2]。纤维支气管镜能够实现痰液堵塞情况的直视观察,肺泡灌洗能够显著提高局部抗生素浓度[3]。目前临床文献中对不同病因导致肺部感染的肺泡灌洗效果报道不多,本文收集了不同病因患者进行观察。
1 资料与方法
1.1 一般资料
将2015年2月至2017年8月172例肺部感染患者纳入此次前瞻性对照分析。患者均经高分辨率CT等影像学检查明确肺部感染病因[4-5];结合病因随机分组,观察组、对照组临床资料见表1。此次研究已获取本院医学伦理委员会批件。
1.2 治疗方案
两组患者均接受抗生素、体位引流、气道湿化、营养支持等常规综合治疗,药敏试验结果得出前,给予哌拉西林/他唑巴坦静脉滴注,待药敏结果得出后换用敏感抗生素[6]。在上述治疗方案的基础上,观察组加用纤维支气管镜肺泡灌洗治疗,2%利多卡因行雾化吸入麻醉,必要时以芬太尼和咪唑安定行静脉麻醉。经鼻腔置入BF-P40纤维支气管镜(日本Olympus公司),经鼻入镜困难者可经口入镜,于气管、左右主支气管口及声门处喷注2%利多卡因麻醉,采用生理盐水行病变肺段支气管肺泡灌洗,单次灌洗液用量约20 mL,行负压吸引,压力7~10 kPa,每次灌洗时间≤20 s,重复次数≤6次;灌注完毕后将0.4 g阿米卡星和10 mL生理盐水保留于感染较重的肺段内[7],退镜。

表1 两组患者一般临床资料比较(n/%)
1.3 观察指标和统计
记录两组患者体温正常、咳嗽消失、胸片吸收时间以及住院时间,检测其治疗前、治疗72 h后白细胞计数(WBC)、呼吸频率、氧分压(PaO2)、氧合指数(PaO2/ FiO2)等实验室指标变化,并于治疗72 h后评价其临床疗效[8]:显效:咳嗽、咳痰症状消失,实验室检查WBC、中性粒细胞计数恢复正常,胸片显示炎症病灶吸收>70%;有效:咳嗽、咳痰症状明显改善,实验室检查WBC、中性粒细胞计数明显下降,胸片显示炎症病灶吸收30%~70%;无效:咳嗽、咳痰症状未见改善,实验室检查WBC、中性粒细胞计数未见下降,胸片提示炎症病灶吸收<30%;总有效率=(显效+有效)/总例数×100%。
数据分析采用SPSS 22.0,双侧检验,以P<0.05为差异有统计学意义。
2 结果
观察组灌洗治疗期间发生窦性心动过速1例、血氧饱和度下降2例,经对症处理后恢复,所有患者均完成治疗。
2.1 临床症状恢复时间
观察组体温正常、咳嗽消失、胸片吸收时间及住院时间均低于对照组,差异有统计学意义(P<0.05)。见表2。

表2 两组患者临床症状恢复时间比较(d,x±s)
2.2 疗效和实验室指标变化
治疗72 h后,两组患者WBC、呼吸频率均较治疗前下降,PaO2、PaO2/FiO2均较治疗前升高;观察组治疗72 h后WBC低于对照组,其PaO2、PaO2/FiO2高于后者,差异有统计学意义(P<0.05)。见表3。治疗72 h后,观察组临床总有效率为75.58%(65/86),高于对照组的55.81%(48/86),差异有统计学意义(P<0.05)。
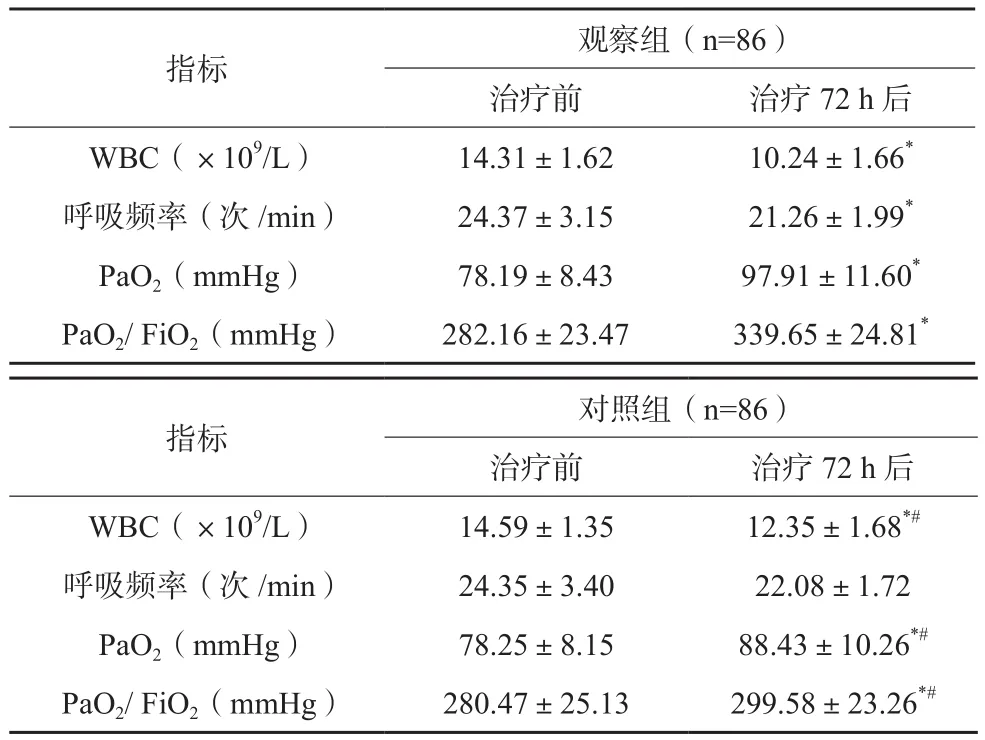
表3 两组患者各项实验室指标变化比较(x±s)
3 讨论
本研究172例患者中,最常见的肺部感染病因为呼吸机相关性肺炎,其原因与近年来机械通气使用率升高有关[9],气管插管、气管切开可使上呼吸道保护性功能消失,而上呼吸道对气体调节功能的丧失可使呼吸道内皮细胞、纤毛、腺体更易受损,周围环境中病原微生物更易进入下呼吸道,引发肺部感染[10]。支气管扩张也是肺部感染的常见病因之一,其发病诱因包括支气管-肺组织的感染,以及支气管阻塞感染,二者均可引发支气管管腔粘膜充血、水肿,导致管腔内分泌物引流不畅,加剧肺部感染发生风险,而肺部感染伴随的局部炎性病灶浸润又会进一步促进支气管扩张进展,形成恶性循环[11-12]。因此,无论是对于肺脓肿、吸入性肺炎所致肺部感染,还是呼吸机相关性肺炎、支气管扩张所致肺部感染,其治疗原则均应以控制炎性病变进展、清除气道分泌物、保持呼吸道通畅为主,同时,促进患者通气、换气功能的改善也是治疗中的关键环节[13]。
此次研究对照组86例患者接受抗生素、气道湿化、营养支持等常规治疗,治疗72 h后,对照组临床总有效率为55.81%,说明该方案的局限性,其原因一方面与全身使用抗生素后肺组织药物浓度偏低有关,另一方面,患者支气管粘膜充血水肿、大量粘稠分泌物引流不畅,均对常规体位引流排脓效果有着负面影响[14-15]。为解决这一不足,本研究观察组患者加用纤维支气管镜肺泡灌洗治疗,该方案的优势包括:1)可在直视下降纤维支气管镜送入支气管叶段,针对性较强,能够吸出因咳嗽无力而聚集在小气道内的粘痰、痰栓,通过彻底清理气道,达到缓解气道阻塞、恢复气道通畅的目的,且较传统吸痰技术而言,损伤更小、效率更高[16]。2)术中局部刺激可促使气道内分泌物排出,对于改善气道功能、缓解呼吸道症状亦有着积极意义。3)通过纤维支气管镜将有效抗生素直接注入病灶及邻近支气管,可大大提高局部药物浓度,在保证杀菌效果的同时避免全身大剂量应用抗生素所致不良反应发生风险[17]。得益于上述优势,本研究观察组患者临床症状恢复时间更短、实验室指标改善更为理想且临床总有效率达到75.58%,同时为保证治疗过程安全,我们将负压吸引压力控制在7~10 kPa,据报道负压吸引压力超过13.3 kPa,易发支气管粘膜损伤[18],本研究观察组未见支气管粘膜损伤发生。
综上所述,纤维支气管镜肺泡灌洗治疗不同病因导致的肺部感染均有着确切的疗效与良好的安全性。
[1] HAAS B M, CLAYTON J D, ELICKER B M, et al. CT-Guided Percutaneous Lung Biopsies in Patients With Suspicion for Infection May Yield Clinically Useful Information[J]. Am J Roentgenol, 2017, 208(2): 459-463.
[2] 陶英秀. 天津地区社区获得性肺炎治疗现状及早期治疗失败相关因素分析[D]. 天津:天津医科大学, 2013.
[3] HARDAK E, AVIVI I, BERKUN L, et al. Polymicrobial pulmonary infection in patients with hematological malignancies: prevalence, co-pathogens, course and outcome[J].Infection, 2016, 44(4): 491-497.
[4] WEBSTER I, GOUSSARD P, GIE R, et al. The indications and role of paediatric bronchoscopy in a developing country, with high prevalence of pulmonary tuberculosis and HIV[J]. Expert Rev Respir Med, 2017, 11(2): 159-165.
[5] HARTMAN J E, KLOOSTER K, GORTZAK K, et al. Long-term follow-up after bronchoscopic lung volume reduction treatment with coils in patients with severe emphysema[J].Respirology, 2015, 20(2): 319-326.
[6] 印洁, 施毅. 降阶梯治疗在重症肺部感染治疗中的地位[J]. 中国呼吸与危重监护杂志, 2008, 7(1):9-12.
[7] FRUCHTER O, ROSENGARTEN D, GOLDBERG E, et al.Airway bacterial colonization and serum C-reactive protein are associated with chronic obstructive pulmonary disease exacerbation following bronchoscopic lung volume reduction[J].Clin Respir J, 2016, 10(2): 239-245.
[8] VOGELMEIER C F, CRINER G J, MARTINEZ F J, et al.Global strategy for the diagnosis, management and prevention of chronic obstructive lung disease 2017 report[J]. Respirology,2017, 22(3): 575-601.
[9] BECK J M, SCHLOSS P D, VENKATARAMAN A, et al.Multicenter comparison of lung and oral microbiomes of HIV-infected and HIV-uninfected individuals[J]. Am J Respir Crit Care Med, 2015, 192(11): 1335-1344.
[10] LAVIGNE M C. Nonbronchoscopic Methods [Nonbronchoscopic Bronchoalveolar Lavage (BAL), Mini-BAL, Blinded Bronchial Sampling, Blinded Protected Specimen Brush] to Investigate for Pulmonary Infections, Inflammation, and Cellular and Molecular Markers: A Narrative Review[J]. Clin Pulm Med,2017, 24(1): 13-25.
[11] SARKISS M. Anesthesia for Bronchoscopy[M]//Out of Operating Room Anesthesia. Springer, Cham, 2017: 131-143.
[12] ROSENFELD M, GIBSON R L, MCNAMARA S, et al. Early pulmonary infection, inflammation, and clinical outcomes in infants with cystic fibrosis[J]. Pediatric Pulmonology, 2001,32(5):356-66.
[13] MORRIS A, PAULSON J N, TALUKDER H, et al. Longitudinal analysis of the lung microbiota of cynomolgous macaques during long-term SHIV infection[J]. Microbiome, 2016, 4(1): 38.
[14] 曹彬, 蔡柏蔷. 美国胸科协会和美国感染病协会对医院内获得性肺炎诊治指南的修订[J]. 中华内科杂志, 2005, 44(12):945-948.
[15] KOYAMA K, OHSHIMA N, KAWASHIMA M, et al.Characteristics of pulmonary Mycobacterium avium complex disease diagnosed later in follow-up after negative mycobacterial study including bronchoscopy[J]. Respir Med, 2015, 109(10):1347-1353.
[16] EKREN P K, AYDOGAN B B, GURGUN A, et al. Can fiberoptic bronchoscopy be applied to critically ill patients treated with noninvasive ventilation for acute respiratory distress syndrome? Prospective observational study[J]. BMC Pulm Med, 2016, 16(1): 89.
[17] GUY M, VANHEMS P, DANANCHÉ C, et al. Outbreak of pulmonary Pseudomonas aeruginosa and Stenotrophomonas maltophilia infections related to contaminated bronchoscope suction valves, Lyon, France, 2014[J]. Eurosurveillance, 2016,21(28): 30286.
[18] HAYAMA M, IZUMO T, MATSUMOTO Y, et al.Complications with endobronchial ultrasound with a guide sheath for the diagnosis of peripheral pulmonary lesions[J].Respiration, 2015, 90(2): 129-135.

