拟穴青蟹抗菌肽SCY2在毕赤酵母中的表达及其抗菌活性
彭会, 刘杰, 陈慧芸
(1.厦门大学海洋与地球学院,福建厦门361102;2.海洋生物制备技术国家地方联合工程实验室,福建厦门361102)
抗生素作为抗菌药物是目前人类使用最广泛的预防和治疗病原微生物感染的手段之一。然而由于抗生素长期过量使用所引起的细菌耐药性问题已成为全球公共健康问题[1-2]。寻找抗生素的有效替代品是国内外农业、医学等领域的研究热点之一。抗菌肽是一类从生物体中分离的、具有广谱抗微生物活性的小分子多肽,已证实是生物体先天免疫系统的重要组成成分,被科学家誉为 “天然抗生素”[3-5]。 目前, 抗菌肽在细菌[6]、 植物[7]、 昆虫[8]和脊椎动物[9]等多种生物体中均有发现,截至2013年,在真核生物中已经发现报道了超过2000种抗菌肽[10]。
SCY2是从雄性拟穴青蟹Scylla paramamosain生殖腺中发现的一种阴离子抗菌肽,本课题组在对青蟹新型抗菌肽Scygonadin的研究过程中,在拟穴青蟹中克隆获得了与Scygonadin具有65.08%同源性的 cDNA序列[11-12],命名为 SCY2基因 (Gen-Bank登录号:EF555444)。与 Scygonadin基因组DNA相似,SCY2基因组DNA同样由3个外显子和2个内含子基因组成。运用ProtParam工具分析结果显示,SCY2成熟肽含有100个氨基酸残基,平均相对分子量为10 925 400,等电点PI为4.84,为阴离子抗菌肽[12-13]。厦门大学海洋生物制备技术国家地方联合工程实验室研究发现,SCY2是在拟穴青蟹雄性射精管显著高表达的抗菌肽基因,交配后射精管中SCY2基因表达低于交配前,而在雌蟹阴道及纳精囊中交配后SCY2基因表达量高于交配前,Western Blot与免疫荧光检测结果证实SCY2蛋白从雄蟹体内转移到了雌蟹中,提示抗菌肽SCY2在交配过程中可能起到保护精子免受细菌感染的作用[13]。因此,拟穴青蟹抗菌肽SCY2可能在青蟹的生殖免疫中起着重要作用[13]。
本研究中构建了真核表达载体pPIC9K-SCY2,在毕赤酵母Pichia pastoris GS115菌株中诱导表达获得重组蛋白,对获得的重组蛋白纯化后进行基质辅助激光解吸/离子化飞行时间质谱分析,同时用纯化后得到的重组蛋白测定抗菌活性,以便阐明获得的抗菌肽SCY2的抗菌活性和抗菌谱。
1 材料与方法
1.1 材料
1.1.1 载体和菌株 真核表达用菌株、质粒和抗菌试验用菌株、毕赤酵母菌株GS115、表达载体pPIC9K均购自Invitrogen公司;大肠杆菌DH5α感受态细胞由厦门大学海洋生物制备技术国家地方联合工程实验室制备保存。
抗菌试验用菌株:大肠杆菌模式株Escherichia coli、施氏假单胞菌Pseudomonas stutzeri、荧光假单胞菌Pseudomonas fluorescens、弗氏志贺氏菌Shigella flexneri、金黄色葡萄球菌 Staphylococcus aureus、藤黄微球菌Micrococcus luteus、溶壁微球菌Micrococcus lysodeikticus和谷氨酸棒杆菌Corynebacterium glutamicum均购自中国科学院微生物研究所菌种保藏中心 (CGMCC)。
1.1.2 主要试剂 HisTrapTMFF crude 5 mL购自GE公司;凝胶回收试剂盒、质粒小量提取试剂盒购自东盛公司;DNA Ligation Kit、限制性内切酶购自TaKaRa公司;FastPfu聚合酶购自全式金公司;Bradford蛋白浓度测定试剂盒购自碧云天生物技术研究所;胰蛋白胨、酵母粉均购自OXOID公司;琼脂糖为Promega公司产品;YNB(无氨基酵母氮源)、D-山梨醇均购自索莱宝公司;其他蛋白表达与纯化相关试剂均为国产分析纯。
1.2 方法
1.2.1 pPIC9K-SCY2表达载体的构建 根据pPIC9K载体多克隆位点和真核表达载体pPIC9KSCY2的目的基因序列,设计上下游引物。上游引物为F1:GGGGAATTC GGCCTGGCACTCAACAGACTTATG;下游引物为R1:ATGCGGCCGCTCAATGGTGATGGTGATGATGGTAGGAAGCAAGCCAGTCCTCGAGGTC。其中,划线部分分别为EcoRⅠ和NotⅠ的酶切位点,终止密码子前引入组氨酸标签,斜体部分为6×His序列。
以本实验室前期已获得的SCY2序列 (Gen-Bank登录号:EF555444)为模板,F1和R1为上、下游引物,用FastPfu聚合酶进行PCR扩增SCY2目的片段。对获得的目的片段进行凝胶回收后,利用EcoRⅠ和NotⅠ内切酶对目的片段进行酶切,同时对制备的pPIC9K真核表达载体同样使用EcoRⅠ和NotⅠ内切酶进行酶切。使用凝胶回收试剂盒将酶切后的SCY2目的片段和pPIC9K真核表达载体分别进行回收后,将具有相同黏性末端的SCY2目的片段和pPIC9K真核表达载体以及T4 DNA连接酶在16℃下进行连接,转化至大肠杆菌DH5α感受态细胞中,涂布于含有Amp的LB琼脂平板上,于37℃下培养过夜。挑取单克隆PCR扩增鉴定阳性克隆,并送至英潍捷基贸易有限公司进行测序。
1.2.2 pPIC9K-SCY2载体的转化和鉴定 将测序正确的pPIC9K-SCY2表达载体用SacⅠ限制性内切酶线性化,将线性化的表达载体电转化至毕赤酵母GS115感受态细胞中。将转化后的细胞涂布于MD平板上,于28℃下培养2 d至产生单克隆,挑取单克隆进行PCR扩增,验证目的基因片段是否插入酵母基因组中,选取阳性克隆进行摇瓶培养,保种于超低温冰箱 (-80℃)中,以备后续表达使用。
1.2.3 抗菌肽SCY2的真核表达和纯化 将保种于超低温冰箱中的菌株GS115/pPIC9K-SCY2划线于YPD平板,挑取单克隆接种于20 mL YPD培养基中,于30℃下以230 r/min振荡培养约20 h至对数生长期。将培养液转入400 mL BMGY(pH 6.0)培养基中继续培养,于30℃下以230 r/min振荡培养至对数生长期,测定OD600nm达到2.0~6.0时,在室温条件下以2000 g离心收集细胞。将离心后收集到的细胞重悬于等体积BMMY表达培养基中,于 28℃下以 230 r/min,用终浓度为0.5%的甲醇诱导表达24 h,离心收集培养基上清液。取450 μL培养上清液,加入50 μL的100%三氯乙酸 (TCA)浓缩,采用SDS-PAGE电泳分析蛋白的表达量。将其余的上清液于4℃下在磷酸盐缓冲液中透析2~3次,对透析后的上清液进行离心,经0.45 μm滤膜过滤后上柱纯化。
用5~10个柱体积 Milli-Q水清洗预装柱(HisTrapTMFF Crude 5 mL),接着用5~10个柱体积平衡缓冲液 (20 mmol/L磷酸缓冲液+50 mmol/L NaCl+10 mmol/L咪唑,pH 8.0) 平衡HisTrap层析柱,将过滤后的上清液以2 mL/min全部上柱,同时收集流穿样品;然后用3~5个柱体积的平衡缓冲液过柱,洗去未结合的蛋白;用洗脱缓冲液(20 mmol/L磷酸缓冲液+150 mmol/L NaCl+300 mmol/L咪唑,pH 8.0)过柱,洗脱目的蛋白收集洗脱峰,取少量进行 SDS-PAGE电泳鉴定。经SDS-PAGE电泳后,切胶回收相对分子质量为11 000的目的蛋白条带,用液相分离-基质辅助激光解析串联飞行时间质谱仪 (LC-MALDI-TOFTOF)及数据库搜索对目的蛋白进行鉴定。
1.2.4 抗菌肽SCY2最小抑菌浓度的测定 最小抑菌浓度 (Minimal inhibitory concentration,MIC)的测定在96孔细胞培养板上进行[14-15]。取被测细菌,在营养肉汤平板上划线,培养过夜;挑取2~3个克隆接种于MH培养基的固体斜面,继续培养12~16 h;用 10 mmol/L磷酸钠盐缓冲液 (pH 7.2)冲洗新鲜制备的MH细菌斜面培养物,调整OD600nm值为0.003。设置阳性对照组、空白对照组和待测样品试验组。其中,阳性对照组为50 μL磷酸钠盐缓冲液和50 μL含MH培养液的菌悬液;空白对照组为50 μL待测蛋白样品和50 μL磷酸钠盐缓冲液;样品试验组为50 μL待测蛋白样品和50 μL含MH培养液的菌悬液。
细菌在最适条件下培养24~48 h后,观察MIC结果。以上试验重复3次,每次每种被测菌设2个平行样。
1.2.5 抗菌肽SCY2与抗生素的协同抗菌作用试验 运用棋盘法[16-17]测定抗菌肽与试验用抗生素之间的协同抗菌作用。连续2倍稀释抗菌肽和抗生素的浓度为1/32MIC~1/2MIC,将稀释后的抗菌肽和抗生素分别添加25 μL到96孔细胞培养板中与50 μL细菌混合均匀,每种被测菌设置阳性对照组、空白对照组和待测样品试验组。其中阳性对照组加50 μL磷酸钠盐缓冲液和50 μL菌悬液;空白对照组 (抗菌肽)加50 μL待测抗菌肽样品和50 μL磷酸钠盐缓冲液;空白对照组 (抗生素)加50 μL待测抗生素样品和50 μL磷酸钠盐缓冲液;样品试验组分别向96孔细胞培养板中顺序加入25 μL 1/32×MIC~1×MIC 待测抗菌肽样品和 25 μL 待测抗生素样品,以及50 μL菌悬液。
在细菌最适条件下共孵24~48 h后,观察MIC结果。以上试验重复3次,每次每种被测菌设2个平行样。
抗菌肽与抗生素之间的抗菌作用可用分级抑制浓度指数 (Fractional inhibitory concentration index,FICI)来定量检测,FICI的计算公式为[16-17]

通过FICI可以得到A和B两种试剂之间的相互关系[16-17]:当FICI≤0.5时,A试剂和B试剂间存在协同作用;当0.5<FICI≤1时,A试剂和B试剂间存在增强作用;当1<FICI<4时,A试剂和B试剂间不存在相互作用;当FICI≥4时,A试剂和B试剂间存在拮抗作用。
2 结果与分析
2.1 重组表达载体的构建与鉴定
利用特异性引物F1和R1扩增SCY2成熟肽基因,用15 g/L琼脂糖凝胶电泳分析,PCR扩增出一条约300 bp的条带 (图1-A),与预期目的条带大小相符。将PCR产物用限制性内切酶EcoRⅠ和NotⅠ做双酶切,用凝胶回收试剂盒回收酶切后的目的基因片段。表达载体pPIC9K同样经过EcoRⅠ和NotⅠ双酶切后,用8 g/L琼脂糖凝胶电泳检测酶切效率 (图1-B),酶切前的pPIC9K质粒为环状,酶切后的pPIC9K为清晰且单一的条带,长度约9 000 bp,与实际大小相符。将 PCR扩增的SCY2目的基因用EcoRⅠ和NotⅠ双酶切后与经同样双酶切的载体pPIC9K连接,并转化至大肠杆菌DH5α中,重组表达载体 pPIC9K-SCY2经转化、涂板、菌液PCR鉴定,得到的阳性克隆片段长度约300 bp(图1-C),与预期大小相符。
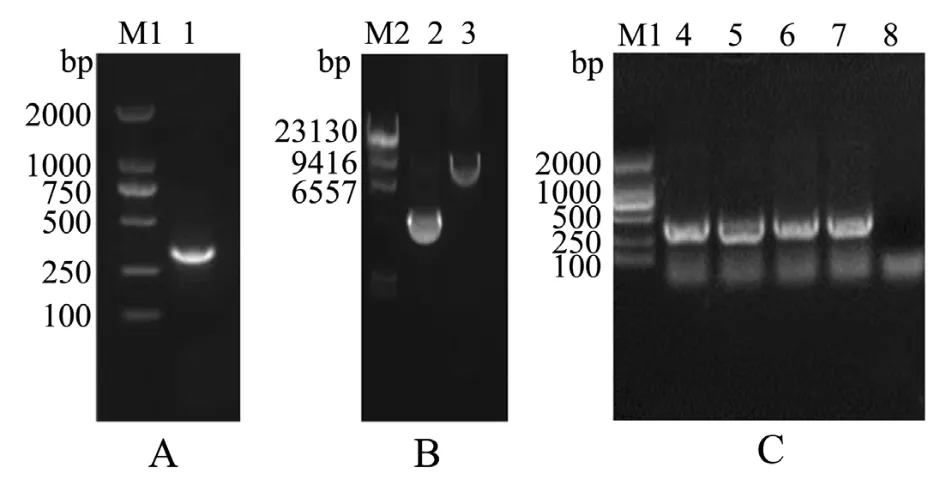
图1 重组载体pPIC9K-SCY2的构建与鉴定Fig.1 Construction and identification of recombinant vector plasmid pPIC9K-SCY2
选择阳性克隆送至英潍捷基贸易有限公司进行测序,测序结果用DNAssist软件进行分析,分析结果表明,目的基因同载体的连接正确,其核苷酸的开放阅读框 (ORF)编码连续,与预期要表达的抗菌肽SCY2成熟肽的氨基酸序列相符合。真核重组表达载体pPIC9K-SCY2采用AOX1启动子,酵母信号肽α-factor因子引导目的基因的分泌表达,在C-末端设计带有6×His-Tag,便于对表达所得到抗菌肽进行亲和层析纯化。重组质粒载体pPIC9K-SCY2的构建如图2所示。

图2 pPIC9K-SCY2重组质粒载体的构建示意图Fig.2 Schematicrepresentation ofthevectorof pPIC9K-SCY2
2.2 SCY2在毕赤酵母中的分泌表达
将pPIC9K-SCY2重组质粒转化至毕赤酵母GS115后,挑取单克隆菌株在10 mL YPD培养基中培养至对数生长期,取2 mL培养液转入40 mL BMGY培养基中继续培养至OD600nm达到2.0~6.0时,离心收集菌体,转入等体积的表达培养基(BMMY培养基)中用0.5%甲醇诱导表达96 h,结果如图3所示。甲醇诱导后在相对分子质量约11 000的位置出现1条蛋白相对分子质量条带,与预测目的蛋白SCY2分子量相当,且在诱导表达12 h时即可检测到目的蛋白SCY2的表达,在24 h已获得高表达,之后目的蛋白表达量稳定,且无明显变化。

图3 SCY2在毕赤酵母GS115中的分泌表达Fig.3 SDS-PAGE analysis of SCY2 expression in yeast Pichia pastoris GS115
2.3 重组蛋白SCY2的纯化
重组毕赤酵母菌株GS115/pPIC9K-SCY2诱导表达24 h后,离心去沉淀,收集胞外上清液。镍离子螯合亲和层析柱亲和纯化,用低浓度咪唑(10 mmol/L)洗脱杂蛋白,用高浓度咪唑 (300 mmol/L)洗脱螯合的目的蛋白SCY2,将诱导表达产物、纯化的流出组分和洗脱组分进行SDS-PAGE电泳 (图4),结果显示,相对分子量约11 000的SCY2重组蛋白能够特异性地与镍离子螯合亲和层析柱结合,在较高浓度的咪唑溶液竞争洗涤后,目的蛋白SCY2被洗脱。
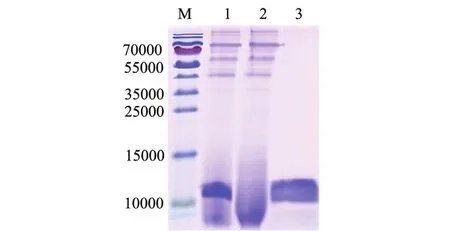
图4 SCY2蛋白的纯化Fig.4 SDS-PAGE analysis of the SCY2 purification
2.4 肽指纹图谱的分析
将获得的SCY2目的条带切胶后用胰酶酶解,用液相分离-基质辅助激光解析串联飞行时间质谱仪 (LC-MALDI-TOF-TOF) 鉴定后,在数据库中搜索比对序列并进行分析 (表1)。从表1可见:检测到6段质子分子量分别为1607.809 3 MH+、2021.081 1 MH+、 2053.961 2 MH+、 2069.943 8 MH+、 2246.056 9 MH+和3027.559 3 MH+, 其对应于美国国家生物技术信息中心数据库中SCY2前体肽 (GenBank登录号:ABU40184.1)的位置分别为82~96、 82~100、 64~81、 64~81、 106~124和35~63。在SCY2前体肽序列中,SCY2成熟肽的对应位置为25~124,如上质谱检测到的6段肽段共85个氨基酸与编码的SCY2成熟肽序列完全相同,占SCY2成熟肽序列的85%。结果表明,获得的目的蛋白即为拟穴青蟹抗菌肽SCY2。
2.5 重组SCY2的抗菌活性
将重组SCY2蛋白溶液分别倍比稀释至1.6~50.0 μmol/L,与等体积的菌悬液共同孵育24 h或48 h后观察最小抑菌浓度 (MIC)[14-15]。对8种细菌测定的MIC结果显示 (表2),真核表达的抗菌肽SCY2能抑制革兰氏阳性菌的生长,对被测的革兰氏阴性菌无抑杀活性。其中SCY2对被测的革兰氏阳性菌如金黄色葡萄球菌和溶壁微球菌具有较好抗菌活性 (MIC为12.5~25.0 μmol/L),对藤黄微球菌、谷氨酸棒杆菌具有一定的抗菌活性 (MIC为25~50 μmol/L);对被测的革兰氏阴性菌无抑杀活性 (>50 μmol/L)。

表1 SCY2酶解指纹MALDI-TOF-MS图谱与从cDNA推导的SCY2前体肽序列 (GenBank登录号:ABU40184.1)的匹配情况Tab.1 Matching of SCY2 MALDI-TOF-MS fingerprint to amino acid sequence deduced from SCY2(GenBank No.:ABU40184.1)

表2 SCY2真核重组表达产物的抗菌活性Tab.2 Antimicrobial activities of SCY2 expressed product in GS115
2.6 抗菌肽SCY2与抗生素的协同抗菌作用
采用液体倍比稀释法分别对抗生素和抗菌肽进行稀释,得到浓度分别为1/32×MIC、1/16×MIC、1/8×MIC、 1/4×MIC、 1/2×MIC、 1×MIC 的抗生素及抗菌肽,将抗生素、抗菌肽和待测菌株分别加入到96孔细胞培养板中,测定了抗菌肽SCY2与青霉素、链霉素和四环素对大肠杆菌模式菌株、荧光假单胞菌、弗氏志贺氏菌和施氏假单胞菌的协同抗菌结果 (表3)。结果显示,抗菌肽SCY2与四环素对荧光假单胞菌有协同抑菌作用 (FICI=0.266),SCY2与青霉素对施氏假单胞菌的抑杀有增强作用 (FICI=0.508)。
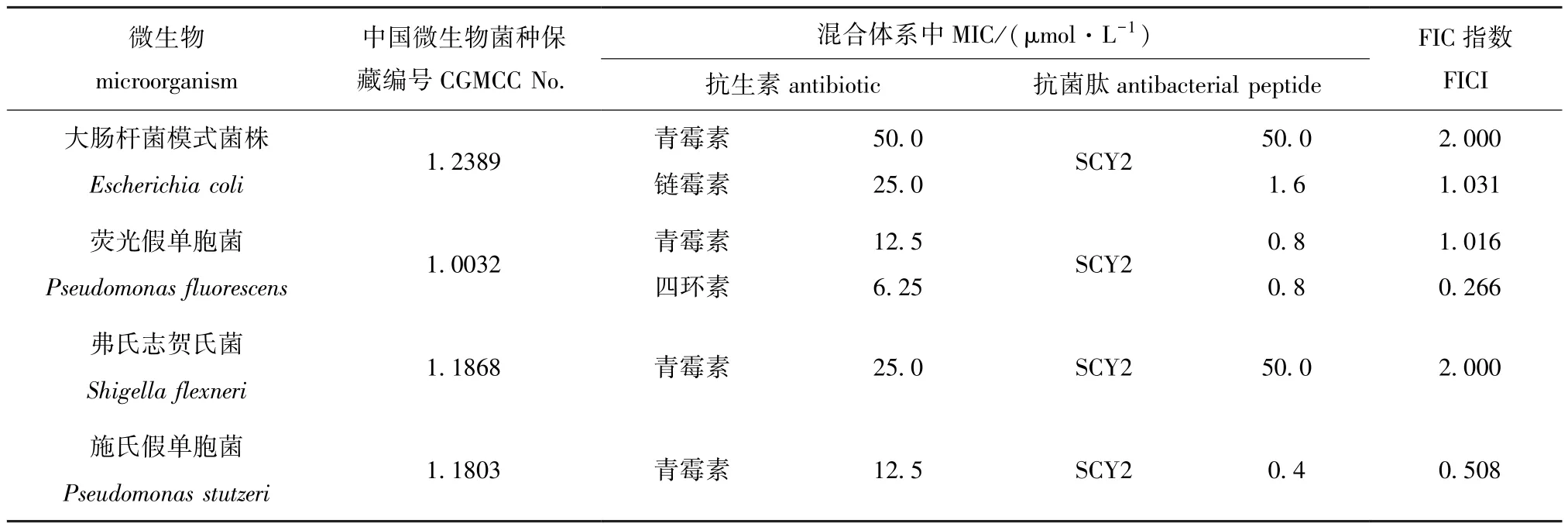
表3 抗菌肽SCY2和抗生素对被测细菌的协同抗菌试验Tab.3 Minimal inhibitory concentration(MIC)and fractional inhibitory concentration index(FICI)of SCY2 and antibiotics synergistic against the test bacterial strains
3 讨论
抗生素为人类的健康生存和发展做出了巨大贡献,然而抗生素的耐药性正在以惊人的速度发展[18-20],数月到数年的时间内,抗生素便会在临床上表现出显著地耐药性[21]。细菌可以通过主动外排、产生水解酶或钝化酶破坏抗生素的功能结构域、改变目标靶点结构等方式产生对抗生素的耐药性[22-25]。而抗菌肽来源于生物体本身,其抗菌机理独特,不易产生耐药性,抗菌活性强。抗菌肽可直接引起宿主先天性免疫应答,并能对广泛的病原菌做出高效而迅速的反应,甚至对成团细菌也起作用,因而将作其为一种新型的生物药物替代现有的化学类抗生素, 具有广阔的应用前景[4-5,26-28]。 但直接从生物体内提取抗菌肽过程复杂且成本高,不适于未来产业化的要求,目前,公认的最有效方法是利用基因工程表达系统进行体外表达。
3.1 表达系统与表达载体的选择
为了获得高表达量的目的蛋白,通常需要建立基因的体外高效表达系统。常用的体外表达系统有原核表达系统、酵母表达系统、昆虫杆状病毒表达系统和哺乳动物细胞表达系统。作为真核表达系统,酵母表达系统兼有原核和高等真核系统的优点,其繁殖快,可进行规模化高密度发酵,表达量高,操作简单,成本低廉,且蛋白翻译后能进行正确加工和修饰,合理的空间折叠,从而使表达出的蛋白具有生物活性。为确定SCY2的抗菌功能,本实验室根据SCY2成熟肽编码序列,构建了pTrc-CKS/SCY2融合基因的原核表达载体,将表达载体质粒转化至大肠杆菌,以IPTG诱导表达,表达产物主要以包涵体形式存在,通过变性复性和金属鳌合层析纯化获得融合蛋白CKS-SCY2,用3C蛋白酶酶切后,纯化获得重组蛋白SCY2[12]。用该方法获得的SCY2原核融合表达虽然表达量较高,但多以包涵体形式存在,需要进行变性复性以及二次酶切,步骤较繁琐,难以直接获得大量具有天然活性的抗菌肽。因此,本研究中设计构建了抗菌肽SCY2的真核表达载体pPIC9K-SCY2,转入毕赤酵母GS115中,用甲醇诱导表达,易于在体外表达并获得了大量具有天然活性的抗菌肽SCY2。
3.2 抗菌肽SCY2的抗菌活性
重组表达的SCY2的抗菌试验结果表明,抗菌肽SCY2对革兰氏阳性菌,如溶壁微球菌具有较强的抗菌活性 (MIC=12.5~25.0 μmol/L), 对藤黄微球菌、谷氨酸棒杆菌具有一定的抗菌活性(MIC=25~50 μmol/L),对革兰氏阴性菌无抗菌活性 (MIC>50 μmol/L)。
SCY2虽然具有一定的抗菌效果,但并非对所有细菌都具有较好的抑杀效果。本研究中,进一步将抗菌肽SCY2与青霉素、链霉素和四环素3种常用的抗生素进行协同抗菌试验,抗菌试验的菌株为大肠杆菌模式菌株、荧光假单胞菌、弗氏志贺氏菌和施氏假单胞菌4种革兰氏阴性菌,以探究抗菌肽SCY2与被测的3种抗生素的协同抗菌作用,为抗菌肽替代或部分替代抗生素的使用奠定理论基础。抗菌试验结果表明,抗菌肽SCY2与四环素对荧光假单胞菌的抑杀具有协同作用,抗菌肽SCY2与青霉素对施氏假单胞菌的抑杀具有增强作用。可见,抗菌肽SCY2与抗生素协同使用时,在一定程度上可以减少使用抗生素的种类或降低抗生素的用量。较低浓度的抗生素与抗菌肽协同使用比单独使用高浓度的抗生素抗菌效果更好,可有效地减少抗生素的使用,降低食品中抗生素的残留风险。
参考文献:
[1] Coates A,Hu Y M,Bax R,et al.The future challenges facing the development of new antimicrobial drugs[J].Nature Reviews Drug Discovery,2002,1(11):895-910.
[2] Walsh C.Where will new antibiotics come from?[J].Nature Reviews Microbiology,2003,1(1):65-70.
[3] Clardy J,Fischbach M A,Walsh C T.New antibiotics from bacterial natural products[J].Nature Biotechnology,2006,24(12):1541-1550.
[4] Zasloff M.Antimicrobial peptides of multicellular organisms[J].Nature,2002,415(6870):389-395.
[5] da Costa J P,Cova M,Ferreira R,et al.Antimicrobial peptides:an alternative for innovative medicines?[J].Applied Microbiology and Biotechnology,2015,99(5):2023-2040.
[6] Hassan M,Kjos M,Nes I F,et al.Natural antimicrobial peptides from bacteria:characteristics and potential applications to fight against antibiotic resistance[J].Journal of Applied Microbiology,2012,113(4):723-736.
[7] Avitabile C,Capparelli R,Rigano M M,et al.Antimicrobial peptides from plants:stabilization of the γ core of a tomato defensin by intramolecular disulfide bond[J].Journal of Peptide Science,2013,19(4):240-245.
[8] Carter V,Underhill A,Baber I,et al.Killer bee molecules:antimicrobial peptides as effector molecules to target sporogonic stages of Plasmodium[J].PLoS Pathogens,2013,9(11):e1003790.
[9] Lehrer R I.Evolution of antimicrobial peptides:a view from the cystine chapel[M]//Hiemstra P S,Zaat S A J.Antimicrobial Peptides and Innate Immunity.Basel:Springer,2013:1-27.
[10] Phoenix D A,Dennison S R,Harris F.Antimicrobial peptides:their history,evolution,and functional promiscuity[M].Weinherm:Wiley-VCH Verlag GmbH & Co.KGaA,2013:1-37.
[11] Wang K J,Huang W S,Yang M,et al.A male-specific expression gene,encodes a novel anionic antimicrobial peptide,scygonadin,in Scylla serrate[J].Molecular Immunology,2007,44(8):1961-1968.
[12] 陈慧芸.锯缘青蟹阴离子抗菌肽SCY2基因克隆、表达特性及其抗菌活性的研究[D].厦门:厦门大学,2007.
[13] Qiao K,Xu W F,Chen H Y,et al.A new antimicrobial peptide SCY2 identified in Scylla paramamosain exerting a potential role of reproductive immunity[J].Fish & Shellfish Immunology,2016,51:251-262.
[14] Bulet P,Dimarcq J L,Hetru C,et al.A novel inducible antibacterial peptide of Drosophila carries an O-glycosylated substitution[J].The Journal of Biological Chemistry,1993,268(20):14893-14897.
[15] López-García B,Ubhayasekera W,Gallo R L,et al.Parallel evaluation of antimicrobial peptides derived from the synthetic PAF26 and the human LL37[J].Biochemical and Biophysical Research Communications,2007,356(1):107-113.
[16] Odds F C.Synergy,antagonism,and what the chequerboard puts between them[J].Journal of Antimicrobial Chemotherapy,2003,52(1):1.
[17] 宫霞,乐国伟,李云飞.家蝇幼虫抗菌肽的抗菌谱及其与抗生素的协同作用研究[J].微生物学报,2005,45(4):516-520.
[18] Neu H C.The crisis in antibiotic resistance[J].Science,1992,257(5073):1064-1073.
[19] Gold H S,Moellering R C Jr.Antimicrobial-drug resistance[J].The New England Journal of Medicine,1996,335(19):1445-1453.[20] Levy S B.The challenge of antibiotic resistance[J].Scientific A-merican,1998,278(3):46-53.
[21] Davies J.Bacteria on the rampage[J].Nature,1996,383(6597):219-220.
[22] 马瑞芬,张文羿,张和平,等.细菌抗生素耐药机制研究进展[J].中国微生态学杂志,2014,26(7):854-857.
[23] McKeegan K S,Borges-Walmsley M I,Walmsley A R.The structure and function of drug pumps:an update[J].Trends in Microbiology,2003,11(1):21-29.
[24] Philippon A,Labia R,Jacoby G.Extended-spectrum beta-lactamases[J].Antimicrobial Agents and Chemotherapy,1989,33(8):1131-1136.
[25] Shaw K J,Rather P N,Hare R S,et al.Molecular genetics of aminoglycoside resistance genes and familial relationships of the aminoglycoside- modifying enzymes[J].Microbiological Reviews,1993,57(1):138-163.
[26] 方玉航,陈树溢,耿倩,等.抗菌肽的研究及其应用进展[J].黑龙江畜牧兽医,2017(17):9-12.
[27] 杜明洋,叶仕根,刘娟,等.水产动物病原拮抗微生物及其应用研究进展[J].大连海洋大学学报,2017,32(6):753-758.
[28] Kang H K,Seo C H,Park Y.Marine peptides and their anti-infective activities[J].Marine Drugs,2015,13(1):618-654.

