桑叶粉中钙的含量测定及生物利用
李佳玮,张宇聪,张素葵,黄 艳,钟 耕,2,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学国家级本科实验教学示范中心,重庆 400716)
桑叶(MorusalbaL),又名铁扇子、神仙叶等,主要分布在亚热带、北温带、非洲热带和美洲等地区,我国有近千万亩桑园,其中在四川、广西及长江中下游地区分布较广[1]。研究表明,桑叶富含多种功能性成分,例如糖类、脂肪、氨基酸、胆碱、有机酸、黄酮类化合物、植物甾醇、矿物质、维生素等[2-3],具有降血糖、降血压、降低胆固醇、抗衰老、增强免疫力等功效[4-5]。近年来,各国学者都在致力于开发天然、安全的保健食品,桑叶因其资源丰富,便宜易得,并具有多重保健功能而受到广泛关注。据报道,桑叶中钙含量可高达2699 mg/100 g[6],远高于牛奶(110 mg/100 g)、豆制品(230 mg/100 g)、奶酪(410 mg/100 g)等食品[7],但未见其补钙和增强骨密度功效等研究报道。
钙对机体健康十分重要,增加膳食钙的摄入量可降低骨质疏松、高血压、癌症等疾病发生的机率[8]。研究表明,人体中回肠是钙吸收的主要部位,其吸收量超过机体所吸收钙总量的80%,结肠也有少量钙的吸收[9]。1986年Harvey提出新的钙吸收理论,认为Ca2+先在肠道内与氨基酸或短链多肽结合,然后再以整体的分子状态被吸收[10],目前该理论已被大量的实验证明。Miller[11]等发明了简单快速的体外评价方法,并发现体内外评价具有很好的相关性,因此常用于评价不同钙源钙的生物利用性,通常测定指标为在模拟胃肠道环境中钙的溶解度和透析度[12]。
本文对产自四川大竹县的桑叶粉中总钙含量及不同形态钙含量进行测定,同时,体外模拟胃/肠消化体系,比较了桑叶粉、碳酸钙、葡萄糖酸钙三种钙源在模拟胃肠道消化环境中钙的溶解度和透析量,从而达到对桑叶粉中钙生物利用性的体外初步评估,为进一步开发以桑叶粉为主要原料的天然补钙制品提供参考。
1 材料与方法
1.1 材料与试剂
桑叶粉 由四川今日农业开发有限公司提供;硝酸 优级纯,成都市科龙化工试剂厂;盐酸 优级纯,重庆川东化工;硫酸 分析纯,重庆川东化工;醋酸、乙醇、乙醚 分析纯,成都市科龙化工试剂厂;碳酸钙、葡萄糖酸钙 优级纯,天津市光复精细化工研究所;胃蛋白酶 2500 U/mg蛋白 1∶2500,Sigma Chemicals,USA;胰蛋白酶 250 U/mg胰蛋白 1∶250,Amresco,USA。
高速台式离心机5810 德国Eppendorf公司;原子吸收分光光度计TAS-990 北京普析通用仪器有限公司;脂肪测定仪SZF-06A 上海新嘉电子有限公司;凯氏定氮仪KT260 丹麦福斯;马弗炉SX-4-10 天津市泰斯特仪器有限公司;全自动氨基酸分析仪L-8800 日本日立公司。
1.2 实验方法
1.2.1 桑叶粉中基本成分含量测定 水分含量测定:采用直接干燥法,参照GB 5009.3-2010进行。灰分的测定:采用灼烧法,参照GB 5009.4-2010进行。蛋白质:采用凯氏定氮法,参照GB 5009.5-2010进行。粗脂肪:采用索氏抽提法,参照GB/T 5009.6-2003进行。粗纤维:参照GB/T 5009.10-2003进行检测。
1.2.2 桑叶粉中总钙含量测定 称取1.00 g左右桑叶粉于150 mL三角瓶中,加入20.0 mL HNO3-HClO4(4∶1)混合酸,三角瓶口放小漏斗,在电炉上加热消化,直至无色透明为止,加入2.0 mL超纯水用于除去多余的硝酸,待三角瓶中所剩液体约为2~3 mL时停止加热,冷却后,将样品转移到50 mL容量瓶中,用20 g/L的氧化镧多次清洗三角瓶,合并洗液,用20 g/L氧化镧定容,摇匀,待测。试样做3个重复,同时取与消化样品所用等量的混酸,按照相同的操作方法做空白实验。标准曲线绘制方法及测定参数参见GB/T 5009.92-2003[13]。
1.2.3 桑叶粉中不同形态钙含量测定 参照Ohat等[14]的方法进行提取,具体提取顺序、提取剂及对应钙的形态见表1。具体操作步骤:称取桑叶粉(0.500±0.005) g于50 mL离心管中,于37 ℃恒温振荡器上用不同溶剂10 mL依次提取1 h,4000 r/min离心10 min,将上清液移至25 mL容量瓶中,用5%盐酸定容[15],最后剩余的残渣用蒸馏水冲洗后烘干,混和酸消化,浸提液和消化液采用原子吸收分光光度计测定钙含量。
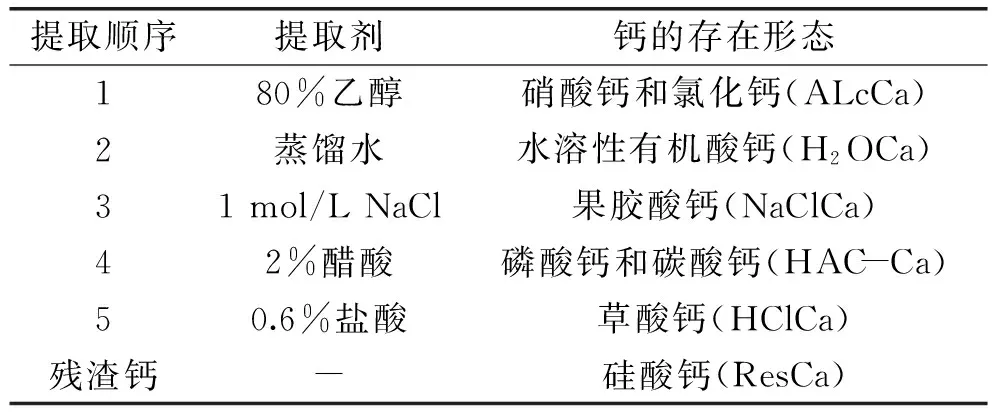
表1 不同形态钙提取顺序及所用试剂[8]Table 1 Extraction procedure and reagents of calcium from mulberry leaf powder[8]
1.2.4 桑叶粉中氨基酸组成分析 准确称取100.00 mg桑叶粉于水解管中,在水解管中加入10 mL盐酸(6 mol/L),加入蒸馏的苯酚3~4滴,再将水解管放入冷冻剂中,冷冻3~5 min,用真空泵抽真空(接近0 Pa),充入高纯氮气,重复抽真空充氮气三次,在充氮气状态下封口,将已封口的水解管放在110 ℃恒温干燥箱内水解22 h,取出冷却至室温。打开水解管,将水解液过滤,用去离子水对水解管进行多次冲洗,将水解液全部移到50 mL容量瓶中并用去离子水定容。吸取滤液1 mL于5 mL容量瓶中,真空干燥器40~50 ℃干燥,残留物用1~2 mL水溶解,干燥,反复进行两次,最后蒸干,用1 mL pH2.2的缓冲液溶解,待上机测定[16-18]。
1.2.5 模拟胃部及肠道消化 人工胃蛋白酶液:准确称取1.00 g NaCl、1.60 g胃蛋白酶于500 mL烧杯中,加入400 mL纯水,搅拌至完全溶解,再加入3.5 mL浓盐酸。纯水稀释至近500 mL,调节pH至1.5,纯水定容,现配现用。
人工模拟肠液:称取0.68 g KH2PO4,加入25 mL蒸馏水使其溶解,加入7.7 mL 0.2 mol/L NaOH和50 mL纯水,混匀,加入1.00 g胰蛋白酶和6.00 g猪胆盐,搅拌至完全溶解,用0.2 mol/L的NaOH调节pH至7.6,现配现用。
人工模拟肠液(不含胰蛋白酶):称取0.68 g KH2PO4,加入25 mL蒸馏水使其溶解,加入7.7 mL 0.2 mol/L NaOH和50 mL蒸馏水,混匀,调节pH至7.6[19]。
透析袋(10KD)的处理:将透析袋剪断成12 cm左右,碱性EDTA溶液煮沸30 min,纯水反复冲洗以除去EDTA,于蒸馏水中4 ℃保存待用,接触透析袋时需戴手套。
体外模拟胃部消化方法:将25 mL pH=1.5的HCl溶液加入到50 mL离心管中,在37 ℃水浴锅中预热5 min,再各加入0.25 g碳酸钙、葡萄糖酸钙及桑叶粉和0.16 g/mL胃蛋白酶液0.5 mL,旋紧盖子,在37 ℃恒温振荡器中,恒速150 r/min模拟消化,n min(n分别为5、10、20、30、60、120)后取出置于沸水中灭酶5 min,冷却后用冷冻离心机8000 r/min离心10 min,取适量上清液经混和酸消化,原子吸收分光光度计测钙含量[20]。
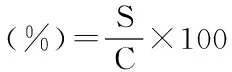
式中:S:样品中可溶性钙含量(mg),C:样品中总钙含量(mg)。
体外模拟肠道消化方法:将25 mL pH=1.5的HCl溶液加入到50 mL离心管中,在37 ℃水浴锅中预热5 min,再加入0.25 g碳酸钙、葡萄糖酸钙及桑叶粉和0.16 g/mL胃蛋白酶液0.5 mL,在37 ℃恒温振荡器中,恒速150 r/min模拟消化2 h。取出样品用0.2 mol/L NaOH溶液调节pH为7.6,加入2.5 mL模拟肠液,装入透析袋(10KD)内,透析袋置于玻璃瓶中,向玻璃瓶中加入100 mL人工肠液,在37 ℃恒温振荡器中,恒速150 r/min模拟消化,n h(n分别为0.5、1、2、4、6、8)时移取1 mL透析液,经混和酸消化后测定钙含量,同时添加1 mL不含酶消化液[19]。
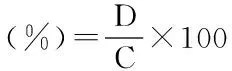
式中:D:透析液中钙含量(mg);C:样品中总钙含量(mg)。
2 结果与分析
2.1 桑叶粉中基本成分测定结果
桑叶粉基本成分含量测定结果如表2所示。由表可知,桑叶粉蛋白质含量丰富,近年来的研究表明,当机体摄入蛋白质水平升高时,机体对钙的吸收会显著增加,这可能是因为增加蛋白质或氨基酸的摄入量会增加Ca2+结合配体所致[21]。粗脂肪含量为6.62%。桑叶的其他成分中剩余部分为碳水化合物、淀粉等多糖,因不属于本实验讨论范围,故而没有列出。
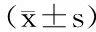
表2 桑叶粉中基本成分含量表Table 2 The basic composition of mulberry
2.2 桑叶粉中总钙及不同形态钙含量
钙标准曲线见图1。
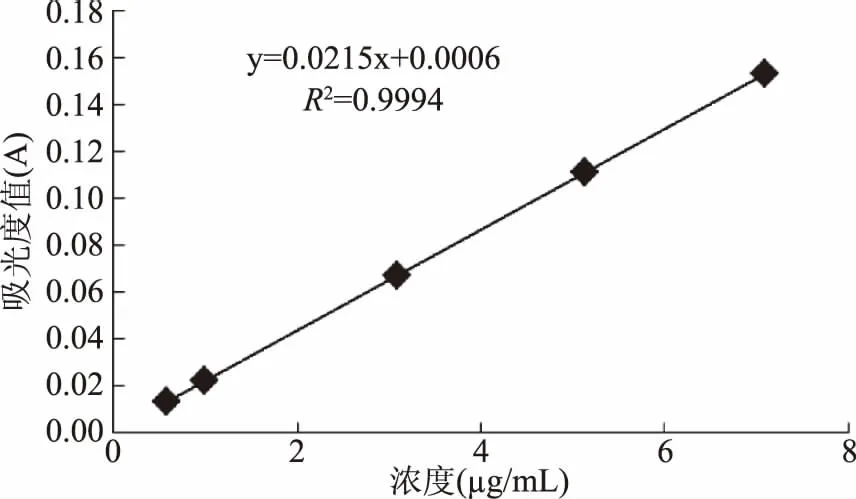
图1 钙标准曲线Fig.1 Standard curve of calcium
桑叶粉总钙及不同形态含量如表3所示。由表可知,所选桑叶粉中钙含量丰富,达到1614.85 mg/100 g,高于牛奶(110 mg/100 g)、豆制品(230 mg/100 g)、奶酪(410 mg/100 g)等食品[7]。对于人体而言,可以吸收的钙为水溶性钙、果胶钙及碳酸钙,桑叶粉中这3种钙的比例接近总钙含量的60%。因此,桑叶粉不仅钙含量高,而且其中钙的存在形态有利于人体的消化吸收。
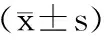
表3 桑叶粉中不同形态钙含量Table 3 The content of calcium in different forms of
2.3 桑叶粉中氨基酸组成分析
桑叶粉氨基酸组成分析结果如表4所示。由表可知,桑叶粉氨基酸含量丰富,其中含量最高的是谷氨酸,占氨基酸总量的13.27%。谷氨酸在维护脑组织功能、糖代谢及蛋白质代谢中具有重要地位,而且是γ-氨基丁酸(GABA)的前体物质[6],赖氨酸占氨基酸总量的7.38%。同时,桑叶粉含有赖氨酸、苯丙氨酸、蛋氨酸、苏氨酸、异亮氨酸、亮氨酸、缬氨酸这7种人体必需氨基酸,占总氨基酸的40.79%,比例接近鸡肉、草鱼、猪肉[22]等,易于被人体吸收利用。必需氨基酸与非氨基酸含量的比值为68.88%,与WHO/FAO规定的EAA/TAA=40%,EAA/NEAA=60%接近,表明桑叶中的蛋白质比例与理想蛋白质标准较接近[23-24]。

图2 桑叶粉氨基酸组成分析图谱Fig.2 Analytical pattern of the amino acid composition of mulberry leaf powder

表4 桑叶粉中氨基酸组成分析Table 4 Amino acid composition of mulberry leaf powder
2.4 桑叶粉中钙的生物利用
2.4.1 模拟胃部消化 碳酸钙、葡萄糖酸钙、桑叶粉在模拟胃部消化环境中钙的溶解度随时间变化情况如图3所示。由图可知,碳酸钙和葡萄糖酸钙在胃酸的作用下快速释放出大量钙离子,消化5 min时钙的溶解度分别达到79.51%和68.13%;随着消化时间的延长,钙离子继续溶出,但速率有所放缓,当消化时间为1 h时溶解度分别达到97.66%和89.71%;1 h后钙离子的释放速率逐渐趋于平稳。这与刘凤茹[25]的研究结果一致。总体而言,桑叶粉钙离子释放速率较碳酸钙和葡萄糖酸钙更为缓慢。胃部消化结束时,钙的溶解度关系为碳酸钙>葡萄糖酸钙>桑叶粉,这可能与桑叶粉中钙的结合态有关,而不同结合态钙在胃中的溶解度及与时间的关系,值得进一步深入研究。碳酸钙、葡萄糖酸钙及桑叶粉在胃部消化中对于钙的溶解度的p值为0.005(<0.01),因此具有极显著的差异。

图3 模拟胃部消化钙的溶解度随消化时间变化情况Fig.3 Effects of digestion times on the solubility of calcium in simulated gastric fluid
碳酸钙在胃中的快速释放与自身易溶于酸的性质有关,胃部属于强酸性环境,且实验所用的碳酸钙呈粉末状,与酸充分接触,所以短时间内快速释放出大量钙离子。碳酸钙因其含钙量高,价格便宜而被广泛用作补钙剂原料,但碳酸钙不溶于水,人体摄入后必须由胃酸作用解离出钙离子后才能被小肠吸收,对胃酸的依赖性强,对于胃酸分泌不足的人而言,摄入碳酸钙吸收率低,不能达到补钙的目的。在胃中释放出的大量钙离子易与胃中胃酸结合形成氯化钙;钙离子进入小肠后与小肠中的次碳酸作用形成不溶性的钙盐如磷酸钙,由粪便排出,所以胃部大量释放钙离子将会使得肠道可吸收的钙相对减少[26]。
模拟胃部消化结果表明,桑叶粉能在胃酸的作用下释放出钙离子,相较于碳酸钙和葡萄糖酸钙的快速释放能减轻对胃的刺激。理论角度分析,在与碳酸钙和葡萄糖酸钙中总钙量相当时,桑叶粉由于在胃部释放出较少的钙离子,使得肠道可吸收的钙量相对增多。
2.4.2 模拟肠道消化 肠道是人体钙吸收的主要部位,实验中模拟肠道环境(包括胰蛋白酶、猪胆盐),并用透析袋模拟肠壁,测定不同消化时间点透析液中钙的浓度从而计算钙的透过率。
碳酸钙、葡萄糖酸钙、桑叶粉在模拟小肠消化环境中钙的透过率随时间变化情况如图4所示。由图可知,随消化时间的延长,3种钙源钙的透过率都呈上升趋势,消化结束时钙的透过率关系为桑叶粉>葡萄糖酸钙>碳酸钙。碳酸钙、葡萄糖酸钙及桑叶粉在肠道消化中对于钙的透过率的p值为0.042(p<0.05),因此之间具有显著的差异性。
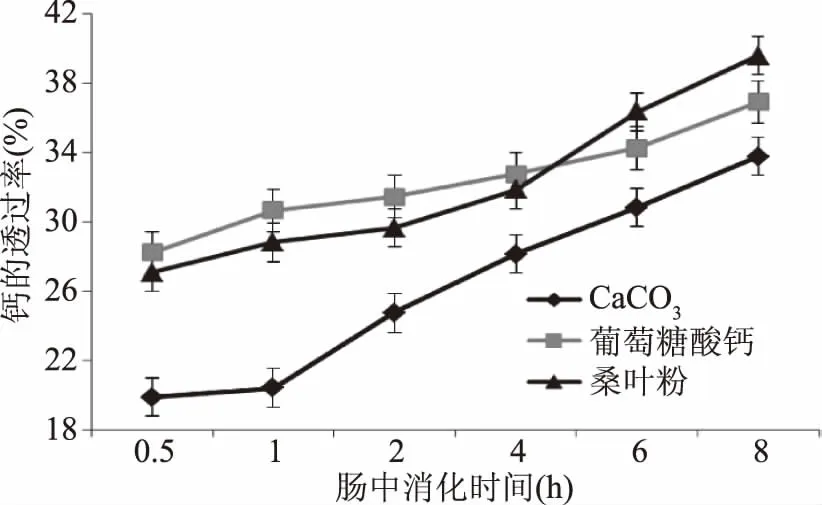
图4 模拟肠道消化钙的透过率随消化时间变化情况Fig.4 Effects of digestion times on the dialysis of calcium in simulated intestinal fluid
肠道属于碱性环境,碳酸钙在前期胃部消化时游离出的大量钙离子在碱性环境下生成氢氧化钙沉淀,且碳酸钙不溶于水,因此钙的透过率一直较低,消化结束后仅达到34.05%;葡萄糖酸钙微溶于水,且在胃部消化结束后部分钙未溶出,所以钙的透过率高于碳酸钙。桑叶粉中钙的透过率在前4 h低于葡萄糖酸钙,4 h后高于葡萄糖酸钙,可能是因为桑叶粉在模拟胃部消化时钙的溶解度低于葡萄糖酸钙,膜内外渗透压更低,因此扩散运动速率慢,所以透析液中钙含量少;随着消化时间的延长桑叶粉中一些大分子物质在胰蛋白酶的作用下被分解为小分子,进而释放出更多的钙离子,膜内外渗透压升高,扩散速率加快;或者钙离子与赖氨酸、精氨酸等形成可溶性的钙盐,一方面避免了在碱性环境中形成氢氧化钙沉淀,另一方面一些小分子钙盐可以直接通过透析袋,所以钙的透过率增大[27]。而葡萄糖酸钙在碱性环境中钙离子不断与氢氧根离子形成沉淀,在肠道内的溶解度逐渐降低,钙的透过率逐渐低于桑叶粉。
3 结论
本文对产自四川大竹的桑叶粉基本成分、总钙及不同形态钙含量进行测定,同时分析其氨基酸组成,体外模拟胃肠道消化体系对其生物利用度进行评价,得出以下结论:
桑叶粉中钙含量为1614.85 mg/100 g,相较于常见食品其钙含量更为丰富。人体可吸收的水溶性钙、果胶钙及碳酸钙在桑叶粉中的比例接近总钙含量的60%,有利于人体的消化吸收。
桑叶粉中氨基酸含量丰富,含有赖氨酸、苯丙氨酸、蛋氨酸、苏氨酸、异亮氨酸、亮氨酸、缬氨酸7种人体必需氨基酸,占总氨基酸的40.79%,该比例接近鸡肉、鲢鱼、猪肉等,易被人体吸收利用;EAA/NEAA=68.88%,接近FAO/WHO标准模式。
桑叶粉可以在胃酸的酸化作用下缓慢释放出Ca2+,相对于碳酸钙和葡萄糖酸钙的快速释放,可减轻对胃部的刺激;在模拟肠道中钙的透过率高于碳酸钙和葡萄糖酸钙。
[1]吴胜芳,王树英,汤坚. 桑叶的生物功能特性及其应用[J].食品科技,2003,10:95-98.
[2]Doi K,Kojima T,Makino M,et al. Studies on the constituents of the leaves ofMorusalbaL[J]. Chemical & Pharmaceutical Bulletin,2001,49(2):151-3.
[3]Imran M,Khan H,Shah M,et al. Chemical composition and antioxidant activity of certain Morus species[J]. Journal of Zhejiang University-Science B,2010,11(12):973-980.
[4]娄德帅,范涛,王储炎,等. 全蚕粉中1-脱氧野尻霉素的提取分离及分离物对肿瘤细胞的抑制作用[J]. 蚕业科学,2010,36(1):109-114.
[5]Hunyadi A,Martins A,Hsieh T J,et al. Chlorogenic acid and rutin play a major role in theinvitroanti-diabetic activity of morus alba leaf extract on type II diabetic rats[J]. Plos One,2012,7(11):e50619-e50619.
[6]王芳,励建荣. 桑叶的化学成分、生理功能及应用研究进展[J]. 食品科学,2005,26(21):111-117.
[7]李宏梁,王建,郭文. 膳食中钙磷比例风险评估的研究[J].食品科技,2012,37(4):101-104.
[8]Kennefick S,Cashman K D. Investigation of aninvitromodel for predicting the effect of food components on calcium availability from meals[J]. International Journal of Food Sciences & Nutrition,2009,51(1):45-54.
[9]李云飞,祝传宝,何文,等. 钙体内研究进展[J]. 中南药学,2006,4(1):46-50.
[10]Harvey H. Pure amino acid chelates:US,45999152[P].1986.
[11]Miller D D,Schricker B R,Rasmussen R R,et al. Aninvitromethod for estimation of iron availability from meals[J]. American Journal of Clinical Nutrition,1981,34(10):2248-56.
[12]Unal G,El S N,Kiliç S.Invitrodetermination of calcium bioavailability of milk,dairy products and infant formulas[J]. International Journal of Food Sciences & Nutrition,2009,56(1):13-22.
[13]中华人民共和国卫生部. GB/T 5009.92-2003食品中钙的测定[S]. 北京:中国标准出版社,2004.
[14]Ohta Y,Yamamoto K,Deguchi M. Chemical fractionation of calcium in the fresh rice leaf blade and influences of deficiency or oversupply of calcium and age of leaf on the content of each calcium fraction:Chemical fractionation of calcium in some plant species(Part 1)[J]. Journal of the Science of Soil & Manure Japan,1970,41:19-26.
[15]曹建华,朱敏洁,黄芬,等. 不同地质条件下植物叶片中钙形态对比研究—以贵州茂兰为例[J]. 矿物岩石地球化学通报,2011,30(3):251-260.
[16]中华人民共和国卫生部. GB/T 5009.124-2003食品中氨基酸的测定[S].北京:中国标准出版社,2003.
[17]胡家禹,俞静芬,张志祥,等. 果蔬氨基酸成分测定方法的比较分析[J]安徽农业科学,2016,44(31):42-44.
[18]张苏平,邱伟强,卢祺,等. 全自动氨基酸分析仪法测定4 种贝类肌肉中谷胱甘肽和游离氨基酸含量[J]. 食品科学,2017,38(4):170-176.
[19]李俶,翟宇鑫,陈军,等. 南酸枣皮中酚类化合物体外模拟消化与溶剂提取的比较研究[J]. 食品科学,2015,36(9):12-16.
[20]Cámara F,Amaro M A,Barberá R,et al. Bioaccessibility of minerals in school meals:Comparison between dialysis and solubility methods[J]. Food Chemistry,2005,92(3):481-489.
[21]黄金明,王根林,杭苏琴. 钙的吸收和转运机制及其影响因素[J]. 动物医学进展,2001,22(4):8-11.
[22]阙婷婷,谢妍,胡亚芹,等. 暹罗鳄肌肉营养及腥味成分分析[J]. 浙江大学学报,2013,39(2):122-132
[23]张璟琳,黄明泉,孙宝国. 四大名醋的游离氨基酸组成成分分析[J]. 食品安全质量检测学报,2014(10):3124-3131.
[24]王芳,乔璐,张庆庆,等. 桑叶蛋白氨基酸组成分析及营养价值评价[J]. 食品科学,2015,36(1):225-228.
[25]刘凤茹. 麦胚蛋白聚集行为及其钙离子螯合肽的制备与评价[D]. 无锡:江南大学,2014.
[26]蒋丽蓉,朱玮琪. 碳酸钙治疗儿童胃酸过多性疾病的疗效与安全性[J]. 临床儿科杂志,2006,24(9):717-718.
[27]刘丽莉. 牛骨降解菌的筛选及其发酵制备胶原多肤鳌合钙的研究[D]. 武汉:华中农业大学,2010.

