柠檬烯对铜绿假单胞菌的抑菌活性及其机理
刘 雪,王静楠,陈文学,陈荣豪,张观飞
(海南大学食品学院,海南海口 570228)
柠檬烯,又称苎烯,学名为 1-甲基-4-异丙基环己烯,分子式为C10H16,是一种环己酮单萜,常温下是一种无色油状液体[1-2]。天然柠檬烯存在3种异构体形式,包括D、L和DL构型,其中最常见的是D-柠檬烯[3]。由于其透明度和令人愉快的柑橘香味,柠檬烯在食品和饮料行业通常被用作添加剂[4]。在国外,美国食用香料与提取物制造商协会认定其毒性属于GRAS(一般公认安全)级,FAO和WHO对D-柠檬烯的ADI(每日容许摄入量)也不进行特殊规定[5-6]。在国内,GB2760-2011食品添加剂使用标准中规定D-柠檬烯为允许使用的香料[3]。
柠檬烯是很多植物油如柠檬油、柑橘油、橙皮油等的主要成分,在胡椒油中含量也比较丰富[2]。徐可文等通过气相色谱-质谱法(GC-MS)测得黑胡椒挥发油中D-柠檬烯的含量在12.32%~20.35%之间,也有研究表明胡椒提取物中含有萜烯类物质,包括柠檬烯[7-8]。目前,国内外研究表明柠檬烯具有抑菌作用。LIS-BALCHIN等人[9]研究了(+)-柠檬烯和(-)-柠檬烯在体外对25种不同的革兰氏菌以及20种单核细胞增生李斯特菌的抗菌活性,结果表明二者都具有抑菌性。SINGH等[10-11]发现柠檬烯对青霉、绿霉和黄曲霉均具有较好的抑制性。王雪梅等人[12]的研究表明柠檬烯具有广谱抗菌性。
近年来,由食源性致病菌引起的食源性疾病频发,对整个社会的食品安全和公共安全造成了重大威胁[13]。铜绿假单胞菌(Pseudomonasaeruginosa),又称绿脓杆菌,是一种食源性致病菌,也是常见的条件致病菌,会引起食源性疾病包括食物中毒、肠道传染病等[14]。研究表明,柠檬烯对铜绿假单胞菌存在抑菌效果[15],然而关于柠檬烯对铜绿假单胞菌的抑菌机理尚未见有报道。本研究通过测定柠檬烯的最小抑菌浓度(MIC)及细菌生长曲线等指标,探讨柠檬烯的抑菌活性,进一步揭示柠檬烯对铜绿假单胞菌的抑菌机理,为柠檬烯应用于食品的保鲜提供理论依据。
1 材料与方法
1.1 材料与仪器
(+)-柠檬烯(>95.0%) 日本东京化成工业株式会社(TCI);铜绿假单胞菌(ATCC 9027) 广东省微生物菌种保藏中心;牛肉膏、琼脂、蛋白胨、无菌磷酸盐缓冲液(PBS) 北京索莱宝科技有限公司;氯化钠、氢氧化钠、无水乙醇 广州化学试剂厂;罗丹明123 上海源叶生物科技有限公司。
高压灭菌锅 致微(厦门)仪器有限公司;无菌超净工作台 苏州佳宝净化工程设备有限公司;SPX生化培养箱 宁波江南仪器厂;SHA-2恒温振荡器 常州澳华仪器有限公司;高速冷冻离心机 上海卢湘仪离心机仪器有限公司;F-280荧光分光光度计 天津港东科技发展股份有限公司;艾本德 5804R台式高速冷冻离心机 德国艾本德股份公司;DDS-307电导率仪 上海仪电科学仪器股份有限公司;S-3000扫描式电子显微镜 日本日立公司;电子分析天平 上海舜宇恒平科学仪器有限公司。
1.2 实验方法
1.2.1 菌种活化 将铜绿假单胞菌在营养肉汁琼脂培养基中传代活化后保存备用,采用麦氏比浊法[16],将铜绿假单胞菌置于37 ℃培养箱培养18~24 h,用生理盐水(0.9% NaCl)将培养后的细菌从斜面上洗脱下来,并将菌悬液的浓度稀释至含菌量约为106~107cfu/mL。
1.2.2 最小抑菌浓度(MIC)的测定 采用肉汤稀释法[17],根据黄聪亮、潘旭迟[18-19]的方法做适当调整,用70%乙醇溶解柠檬烯,并将其二倍梯度稀释成200.000、100.000、50.000、25.000、12.500、6.250、3.125 mL/L的抑制液,在平板中加入上述配制好的2 mL抑制液,与18 mL降温至50 ℃左右的营养肉汁培养基混合均匀,使其终浓度分别为20.0000、10.0000、5.0000、2.5000、1.2500、0.6250、0.3125 mL/L。待培养基凝固后取0.2 mL浓度约为107cfu/mL的供试菌悬液于平板上涂布均匀。以无菌水和70%乙醇作为空白对照和阴性对照,每个浓度设置3个平行,将各平板于37 ℃中倒置培养24 h。观察,以完全不长菌的最小稀释浓度确定为柠檬烯对铜绿假单胞菌作用的MIC。
1.2.3 细菌生长的测定 采用干重法,使用无菌生理盐水(0.9%)将铜绿假单胞菌梯度稀释至106~107cfu/mL,将菌悬液按照1%(v/v)的接种量接种到液体培养基中,于37 ℃、150 r/min摇床中培养12 h后,加入柠檬烯使其终浓度为1 MIC、2 MIC,每隔1 h取样,先置于预先烘干并称重的离心管中8000 r/min离心,弃上层菌液,然后用无菌水重悬洗涤,将菌体置于80 ℃下烘干至恒重后,测得菌体干重。以无菌水作为对照组。
1.2.4 扫描电镜(SEM) 根据Diao Wen-Rui等人[20]的方法做适当调整,对所测试的细菌进行SEM观察。供试菌在液体培养基中培养至对数期,分别加入1 MIC和2 MIC浓度的柠檬烯,以无菌水和70%乙醇作为空白对照和阴性对照,将各组菌悬液37 ℃摇床培养,取培养4、16 h的菌悬液,6000 r/min离心10 min收集菌体。先用0.1 mol/L PBS洗涤3次,再分别用浓度为20%、40%、60%、80%乙醇溶液进行梯度脱水,每个浓度洗脱2次,最后用无水乙醇洗脱3次。将脱水后的样品在-20 ℃条件下预冻,再使用真空冷冻干燥器冷冻干燥12 h。取出干燥完全的样品、上样、通过阴极喷涂将样品金覆盖,在扫描电子显微镜上观察供试菌放大8000倍的细胞形态。
1.2.5 菌液电导率的测定 根据张新虎[21]等的方法做适当调整,将生长到对数期的铜绿假单胞菌用无菌磷酸盐缓冲液(pH=7.4)洗涤3次,取菌液与柠檬烯溶液混合,使其终浓度为1 MIC、2 MIC,用70%乙醇替代柠檬烯溶液作为对照组,每隔10 min测定1次电导率,连续2 h。
1.2.6 膜电位的测定 根据Zhang Yunbin[22]的方法做适当调整,采用罗丹明123荧光染色法测定膜电位。供试菌在液体培养基中于37 ℃培养24 h,调整菌液浓度约为106~107cfu/mL。分别加入1 MIC和2 MIC浓度的柠檬烯,以无菌水和70%乙醇作为空白对照和阴性对照,150 r/min振摇培养3 h后离心弃上清再用无菌磷酸盐缓冲液冲洗2次。将罗丹明123用无菌磷酸盐缓冲液溶解,配制成浓度为1 mg/mL的母液,加入菌液中使其终浓度为2 μg/mL,避光孵育30 min。菌液用无菌磷酸盐缓冲液充分洗净、重悬。转移到石英比色皿中,用荧光分光光度计测定平均荧光强度。激发波长为480 nm,发射波长为530 nm,狭缝宽度为10 nm,该数据用平均荧光强度表示。
1.3 数据分析
实验数据采用DPS的单因素方差分析进行差异性分析(p<0.05),并使用Origin 9.0进行绘图。
2 结果与分析
2.1 柠檬烯的最小抑菌浓度
最小抑菌浓度(MIC)是衡量物质抑菌能力的标准之一[23]。柠檬烯对铜绿假单胞菌的MIC见表1。

表1 柠檬烯的最小抑菌浓度(MIC)Table 1 MIC of limonene on bacteria
表1可知,柠檬烯对铜绿假单胞菌存在较强的抑菌作用,MIC为10 mL/L,而且随着柠檬烯浓度的提高,其抑菌能力也在增强。同时,无菌水和乙醇组均有菌生长,说明其不能对铜绿假单胞菌产生抑制作用。潘旭迟[19]等研究发现柠檬烯作为柠檬油的有效抑菌成分,其标准品对金黄色葡萄球菌的MIC为6.25 μg/mL,抑制作用较强。
2.2 柠檬烯对铜绿假单胞菌生长的影响
微生物生长曲线是反映微生物数量(活细菌个数或细菌重量)随培养时间变化的曲线,测定方法包括比浊法、干重法、血球板计数法和平板菌落计数法[24]。柠檬烯对铜绿假单胞菌生长的影响见图1。

图1 柠檬烯对铜绿假单胞菌生长的影响Fig.1 Effect of limonene on the growth of P. aeruginosa
由图1可见,对照组的菌体干重随着培养时间增加不断提高,在前11 h里持续上升至1.0,细菌不断增殖,生长速度快,11~12 h期间保持稳定,可能是细菌生长已达到稳定期,新增殖的细胞数与老细胞的死亡数几乎相等,新细胞使干重增加,而老细胞死亡后发生自溶减少干重,所以干重保持相对稳定。对于实验组,当铜绿假单胞菌经过1 MIC和 2 MIC柠檬烯处理后,其生长曲线发生明显变化,菌体干重随着培养时间的延长围绕0.2上下波动,在8 h后逐渐平稳并在11 h发生下降,并且均显著低于对照组(p<0.05)。2 MIC组与1 MIC组相比,前者的菌体干重小于后者,说明柠檬烯浓度的提高会使铜绿假单胞菌生长受到更强的抑制,即抑制程度2 MIC>1 MIC。实验表明,柠檬烯能够显著抑制铜绿假单胞菌的正常生长,抑制其细胞增殖速度,从而发挥抑菌作用。
2.3 铜绿假单胞菌的扫描电镜
为了进一步确认柠檬烯对铜绿假单胞菌的抑菌作用方式,进行扫描电镜分析[25],见图2。

图2 铜绿假单胞菌的扫描电镜图Fig.2 Scanning electron microphotographs of P. aeruginosa注:A1、B1、C1、D1:4 h处理后的空白组、对照组、1MIC组、2MIC组;A2、B2、C2、D2:16 h处理后的空白组、对照组、1MIC组、2MIC组。
通过图中A1、A2能够看出,不添加抑菌物质的铜绿假单胞菌菌体外表光滑,呈杆状分布,结构规则完整,无褶皱变形。如图B1、B2所示,添加乙醇的阴性对照组处理4 h后,供试菌形态无明显变化,处理16 h后,部分菌体发生凹陷。根据图C1、D1,添加1 MIC和2 MIC的柠檬烯作用4 h后,铜绿假单胞菌小部分出现空洞干瘪,同时有细胞堆叠、粘结。作用16 h后,由图C2、D2所示,菌体变化明显,细胞形态已遭到严重破坏,绝大部分菌体发生萎陷,出现空洞,表面粗糙不平整,同时部分菌体变短,有细胞断裂现象,难以发现形态正常的菌体。而且,添加2 MIC柠檬烯的菌体与1 MIC相比受破坏程度更严重,断裂和存在孔洞的菌体更多。说明柠檬烯可以抑制铜绿假单胞菌的生长,改变细胞原有的正常形态,破坏细胞壁和细胞膜,最终导致其死亡。Di Pasqua等[26]人通过扫描电镜观察,发现大肠杆菌O157∶H7、鼠伤寒沙门氏菌和假单胞菌属菌株经柠檬烯作用后,细胞膜结构发生明显改变,菌体出现粘结、肿胀,甚至裂解,与本实验结果相类似。
2.4 柠檬烯对铜绿假单胞菌电导率的影响
在细菌受到强抑菌物质的作用时,菌体的细胞膜遭到破坏,失去原有保护能力,细胞内有带电离子等溶出,内部电解质向外泄露到培养液中,导致培养液的电导率增加。因此,细菌细胞膜通透性的变化可以通过菌液电导率值的变化来反映[27]。
由图3可知,对照组的电导率在前40 min内持续增加,40~110 min时相对平稳,可能是因为细胞的正常裂解和死亡,导致其电导率上升。当柠檬烯浓度为1 MIC和2 MIC时,随着时间的增加,铜绿假单胞菌菌液的电导率均高于对照组,同时,其电导率总体呈上升趋势。这意味着细胞膜的渗透性增加,导致细胞内成分的渗漏,特别是电解质的损失,包括K+、Ca2+、Na+。对实验组来说,添加1 MIC和2 MIC的菌液电导率曲线在时间变化过程中出现交叉、重合,二者的电导率值在大部分时间点不存在显著差异(p>0.05),原因可能是达到1 MIC浓度的柠檬烯已经对细胞膜进行了充分的破坏,使电解质大量外渗,2 MIC从数值上在前期略有增加但无显著差异。结果表明,柠檬烯能够提高铜绿假单胞菌细胞膜的通透性,破坏细胞内部稳定性,从而发挥抑菌作用。王亚丽[28]等的研究也显示,蓝莓叶多酚能够增加铜绿假单胞菌细胞膜的通透性,反映出抑菌性。
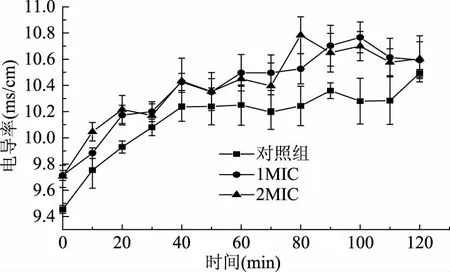
图3 柠檬烯对铜绿假单胞菌电导率的影响Fig.3 Changes in electric conductivity of broth for P. aeruginosa by limonene
2.5 柠檬烯对铜绿假单胞菌膜电位的影响
柠檬烯对铜绿假单胞菌膜电位的影响如图4所示,未添加柠檬烯的菌液中铜绿假单胞菌的平均荧光强度为386.38 AU,当添加1 MIC、2 MIC浓度的柠檬烯后,铜绿假单胞菌的平均荧光强度分别为140.23 AU和11.50 AU,与对照组相比分别降低了63.73%和97.02%,二者与对照组相比,均存在极显著差异(p<0.01)。同时2 MIC组在1 MIC组的基础上下降了91.80%,表明柠檬烯浓度的增加会使铜绿假单胞菌的平均荧光强度显著降低(p<0.01)。
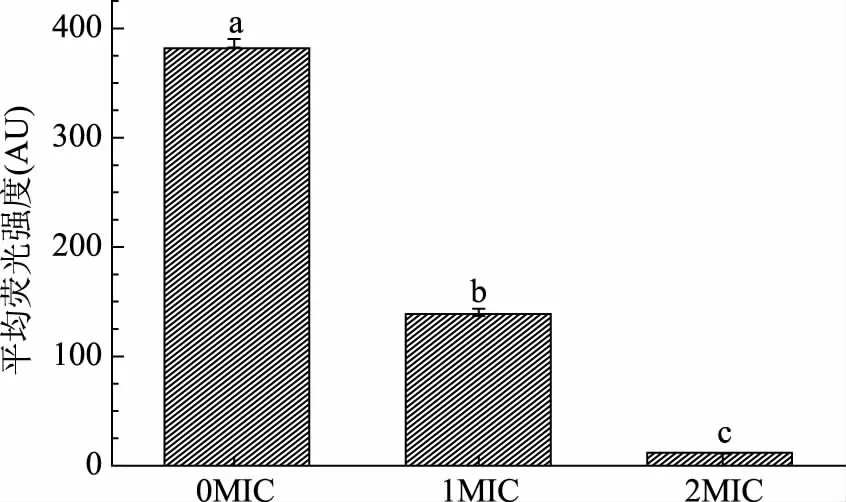
图4 柠檬烯对铜绿假单胞菌膜电位的影响Fig.4 Effect of limonene on the membrane potential(MP)of P. aeruginosa
膜电位是指生物细胞膜内部和外部之间存在的电势差,典型的例子是线粒体膜电位,维持正常的线粒体膜电位是保持线粒体氧化磷酸化水平和产生ATP以维持细胞功能的前提[29]。罗丹明123是一种亲脂性阳离子染料,凭借跨膜电位进入到细胞基质中,其荧光强度的大小可反映膜电位的变化[30]。对于正常的细菌来说,通常膜内的电压比膜外的低。如果膜电位降低,则说明细胞发生了去极化现象,反之,如果升高说明发生了超极化现象[31]。本实验表明,柠檬烯的添加导致铜绿假单胞菌膜电位降低,引起了细胞的去极化,影响细胞的正常代谢活动,进而抑制其生长,导致细菌死亡。
3 结论
本研究通过测定最小抑菌浓度(MIC)评估了柠檬烯的抑菌活性,通过测定细菌生长曲线、扫描电镜观察形态、测定细胞膜通透性以及膜电位揭示了柠檬烯对铜绿假单胞菌的抑菌机理。结果表明:柠檬烯对铜绿假单胞菌具有抑制作用,抑菌活性较强;柠檬烯抑制了铜绿假单胞菌的生长,其细胞膜原有完整结构遭到破坏;在柠檬烯作用下,铜绿假单胞菌细胞膜通透性增大,内部电解质溶出,菌液的电导率不断增加;细胞膜电位降低,荧光丧失,细胞发生去极化导致不规则的细胞代谢活动,引发铜绿假单胞菌走向死亡。柠檬烯是许多精油的主要组成部分,尤其是黑胡椒油的主要活性成分,本研究初步探究柠檬烯对铜绿假单胞菌的抑菌机理,也为胡椒中柠檬烯和其他活性成分进一步开发和利用提供了理论依据。
[1]关天旺,刘嘉煜. 柠檬烯的防腐作用及抑菌机理研究进展[J]. 保鲜与加工,2015,15(6):83-87.
[2]Denise C Arruda,Danilo C Miguel,Jenicer KU,et al. Inhibitory activity of limonene againstLeishmaniaparasitesinvitroandinvivo[J]. Biomedicine & Pharmacotherapy,2009,63(9):643-649.
[3]郝静梅,盛冉,孙志高,等. 柠檬烯抗菌性研究进展[J]. 食品与发酵工业,2017,43(2):274-278.
[4]Zahi MR,Hattab ME,Liang H,et al. Enhancing the antimicrobial activity of D-limonene nanoemulsion with the inclusion of e-polylysine[J]. Food Chemistry,2017,221:18-23.
[5]Sun J. D-Limonene:Safety and clinical applications[J]. Alternative Medicine Review,2007,12(3):259-264.
[6]王伟江. 天然活性单萜-柠檬烯的研究进展[J]. 中国食品添加剂,2005(1):33-37.
[7]张铁涛,尤少芬. 超声波提取胡椒中有效成分条件优化[J]. 琼州学院学报,2012,19(5):18-21.
[8]徐可文,阚海峰,杜宏金. 黑胡椒挥发油的FTIR鉴定与GC-MS分析[J]. 现代中药研究与实践,2011,25(3):28-30.
[9]Lisbalchin M,Ochocka RJ,Deans S,et al. Bioactivity of the enantiomers of limonene[J]. Medical Science Research,1996,24:309-310.
[10]Singh P,Shukla R,Prakash B,et al. Chemical profile,antifungal,antianatoxigenic and antioxidant activity ofCitrusmaxima,BurmandCitrussinensis(L.)Osbeck essential oils and their cyclic monoterpene,DL-limonene[J]. Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association,2010,48(6);1734-1740.
[11]Tao N,Jia L,Zhou H. Antifungal activity ofCitrusreticulataBlanco essential oil againstPenicilliumitalicumandPenicilliumdigitatum[J]. Food Chemistry,2014,153,265-271.
[12]王雪梅,谌徽,李雪姣,等. 天然活性单萜-柠檬烯的抑菌性能研究[J]. 吉林农业大学学报,2010,32(1):24-28.
[13]李泰然. 中国食源性疾病现状及管理建议[J]. 中华流行病学杂志,2003,24(8):651-653.
[14]吕国平,李波. 肉鸡中铜绿假单胞菌的研究[J]. 中国食品卫生杂志,2012,24(2):114-115.
[15]郭苗苗,郑炜圣,王韵章,等. 柑橘皮挥发油的成分分析及抗菌活性的研究[J]. 食品工业,2013,34(5):149-151.
[16]Wu H,Zhang L,Wang N,et al. Analysis of the bioactive components ofSapindussaponins[J]. Industrial Crops & Products,2014,61:422-429.
[17]Yao X,Zhu X,Pan S,et al. Antimicrobial activity of nobiletin and tangeretin againstPseudomonas[J]. Food Chemistry,2012,132(4):1883-1890.
[18]黄聪亮,邹兰,胡月英,等. 金线莲乙醇提取物对金黄色葡萄球菌抑菌性能研究[J]. 热带作物学报,2017,38(1):150-154.
[19]潘旭迟,许剑锋,傅昱晟,等. 3种植物挥发油抑制食源细菌生长活性成分及机理[J]. 食品科学,2017,38(13):143-149.
[20]Diao W R,Hu Q P,Zhang H,et al. Chemical composition,antibacterial activity and mechanism of action of essential oil from seeds of fennel(FoeniculumvulgareMill.)[J]. Food Control,2014,35(1):109-116.
[21]张新虎,何静,沈慧敏. 苍耳提取物对番茄灰霉病菌的抑制作用及抑菌机理初探[J]. 草业学报,2008,17(3):99-104.
[22]Zhang Y,Liu X,Wang Y,et al. Antibacterial activity and mechanism of cinnamon essential oil againstEscherichiacoliandStaphylococcusaureus[J]. Food Control,2016,59:282-289.
[23]Pesavento G,Calonico C,Bilia A R,et al. Antibacterial activity of Oregano,Rosmarinus and Thymus essential oils againstStaphylococcusaureusandListeriamonocytogenesin beef meatballs[J]. Food Control,2015,54(20):188-199.
[24]周德庆. 微生物学教程(第三版)[M]. 北京:高等教育出版社,2011:183-186.
[25]Mehlika B,Nazife Y,Fatmagul G,et al. Antimicrobial activity of endemicCrataegustanacetifolia(Lam.)Pers and observation of the inhibition effect on bacterial cells[J]. Cell Biochemistry & Function,2008,26(8):844-851.
[26]Pasqua R D,Betts G,Hoskins N,et al. Membrane toxicity of antimicrobial compounds from essential oils[J]. Journal of Agricultural & Food Chemistry,2007,55(12):4863-4870.
[27]钱丽红,陶妍,谢晶. 茶多酚对金黄色葡萄球菌和铜绿假单胞菌的抑菌机理[J]. 微生物学通报,2010,37(11):1628-1633.
[28]王亚丽,李颖畅,马春颖,等. 蓝莓叶多酚提取物对3种细菌的抑菌活性[J]. 食品与发酵工业,2015,41(3):163-167.
[29]Xu C,Li J,Yang L,et al. Antibacterial activity and a membrane damage mechanism of Lachnum YM30 melanin againstVibrioparahaemolyticusandStaphylococcusaureus[J]. Food Control,2017,73:1445-1451.
[30]张赟彬,刘笑宇,姜萍萍,等. 肉桂醛对大肠杆菌和金黄色葡萄球菌的抑菌作用及抑菌机理研究[J]. 现代食品科技,2015,31(5):31-36.
[31]乔只红,程永强,鲁战会,等. 乳酸对三种食源性致病菌的抑菌及杀菌作用[J]. 食品科技,2008(10):187-191.

