颗粒活性炭促进高温厌氧消化的研究
潘怡然,崔康平,张 硕,常佳丽,黄 霞* (.合肥工业大学资源与环境工程学院,安徽 合肥 30009;.清华大学,环境模拟与污染控制国家重点实验室,北京 00084)
厌氧消化是有机废物资源化的重要手段.厌氧消化按照操作温度的不同可分为低温消化、中温消化和高温消化.高温厌氧消化由于具有更好的水解效果往往比中低温消化具有更好的产甲烷效果[1].厌氧消化一般认为需要经过三个阶段:水解、产氢产乙酸及产甲烷.其中产甲烷阶段因为产甲烷古菌的世代周期长、对生长条件要求苛刻等原因,生长缓慢,所以往往是厌氧消化过程主要的限制性步骤[2].
最近研究发现颗粒活性炭(GAC)能通过直接种间电子传递(DIET)过程提高产甲烷的速率[3-4].DIET是一种新型互营产甲烷方式.传统的产甲烷互营过程[5],是指互营菌通过产生的载体即氢气或者甲酸盐将电子传递给产甲烷菌[6-7].而DIET是通过细菌自身产生的中介体实现电子转移[8-9],这种过程由于减少了传质阻力而速度快于传统互营方式[10].Liu等[3]首次发现DIET产甲烷过程的存在.但是,目前的研究只关注 GAC对中温厌氧消化产甲烷的影响,GAC对于高温消化的影响尚未有文献记载.由于温度条件的差异,高温消化的群落与中温差异明显[11].另外,目前研究确认的可以通过DIET给出电子的细菌仅有电活性菌Geobacter,而且已知的Geobacter均生活在35℃以下[12],所以GAC能否通过DIET作用来促进高温消化产甲烷尚不清楚.因此本研究的目的是观察 GAC对高温消化过程的影响,分析微生物量和群落结构的变化并探究其中的机理.
1 材料与方法
1.1 产甲烷潜势批实验
1.1.1 接种源 厌氧污泥取自北京市小红门污水处理厂的中温厌氧发酵罐,污泥浓度 MLVSS为(17.62±0.61)g/L.
1.1.2 GAC预处理 实验选用椰壳制颗粒活性炭,购买于上海市 Heaton环保科技有限公司,经过研磨过20目筛,酸洗、碱洗、水洗、105℃烘干备用.为避免活性炭对基质吸附的影响,在培养基不添加厌氧污泥的情况下对颗粒活性炭进行吸附饱和.

表1 实验设计Table 1 Experiment design
1.1.3 批实验 以 120mL血清瓶作为反应器,每瓶添加培养基 50mL.实验设置如表 1所示,每一种设置有 3个平行样.培养基成分:乙酸钠20mmol/L, NH4Cl 1.0g, NaCl 0.25g, MgCl2⋅6H2O 0.1g, CaCl2⋅2H2O 0.1g, KH2PO40.11g,K2HPO4⋅3H2O 0.22g, Na2SO40.05g,微量元素和维生素配方参考之前的研究[13].培养基中分别加入 1g鲜重的厌氧污泥,1g预处理过的颗粒活性炭,CO2/N2混合气(体积比 1:4)曝气除氧,密封后至于55℃, 150rpm摇床培养.在培养过程中监测顶空产气和液相中乙酸浓度变化,产气达到平台期时,批实验结束.
1.2 化学分析
1.2.1 MLVSS 污泥浓度用混合液挥发性固体浓度MLVSS表征,依据国标法测试.
1.2.2 甲烷含量 顶空甲烷含量采用 gilent 7890B气相色谱仪(TCD检测器,porapak Q柱和molsieve 5A柱;N2载气45mL/min;He载气25mL/min;气体烘箱温度70℃;进样器温度250℃;TCD温度200℃).
1.2.3 乙酸浓度 使用 Agilent HPLC Model-1100(Atlantis T3色谱柱和UV柔性波长检测器)分析样品中乙酸基质的浓度,流动相为0.05%H3PO4,流速为 3mL/min,柱温为 55℃.自动进样,进样量为20µL.
1.3 分子生物学分析
1.3.1 DNA提取、高通量测序和数据分析 批实验后,提取主要的3组实验样品的DNA,分别标记为AS-origin (起始厌氧污泥), AS-end (未添加GAC的对照组厌氧泥),GAC+AS(添加GAC的实验组厌氧泥).收集含有颗粒活性炭的生物样品时,需要水洗剧烈摇晃多次,将颗粒活性炭表面的生物膜洗下来,将生物样品离心冷冻保存.本研究使用Fast-DNA Spin Kit for Soil(MP Biomedicals,santa Ana,CA)试剂盒提取 DNA,使用 Nanodrop®Spectrophotometer ND-1000 (Thermo Fisher Scientific, MA, USA)分析提取的核酸浓度和纯度.
16S rRNA测序使用引物515F(5’-GTGCCAGCMGCCGCGGTAA-3’)和 806R(5’-GGACTACHVGGGTWTCTAAT-3’),借助 Illumina Miseq平台(北京计算中心)进行.使用 QIIME进行序列分析,选择 UCLUST方法分析操作分类单位(OTUs)的代表性序列,在RDP分类器上注释分类信息.
1.3.2 定量PCR 运用定量PCR测定总细菌、总古菌和产甲烷菌的量,总细菌通过测定细菌16S rRNA基因的拷贝数来定量,选择的引物为Bac519f/Bac907r;总古菌通过测定古菌 16S rRNA基因的拷贝数来定量,选择的引物为Ar364f/Ar934r[14];产甲烷菌通过测定 mcrA基因的拷贝数来定量,选择的引物为 ME1f/ME3r[15].在iCycler IQ三倍体器(Bio-Rad)上经过热循环,采集荧光信号等过程得出标准样和模板相应的拷贝数[14-16].
2 结果与讨论
2.1 GAC促进高温消化产甲烷
如图1所示,在投加GAC条件下高温厌氧消化产甲烷过程得到促进.投加 GAC的实验组最大产甲烷速率开始于第 7d,最大产甲烷速率为0.217mol/(L⋅d)快于开始于第10d的未投加GAC的对照组的最大产甲烷速率0.083mol/(L⋅d);且前者达到平台期需要的时间为 16d,要明显短于后者4d左右.如图2所示,添加GAC的实验组乙酸消耗较快,乙酸平均降解速率达到 0.093g/(L⋅d),速率明显大于未添加GAC对照组的乙酸平均降解速率 0.074g/(L⋅d),与产气趋势相对应.未投加乙酸只加厌氧泥的空白对照CK1的产甲烷量只有对应实验组的 2%不到,乙酸也未见降解.该结果可排除吸附饱和的乙酸对试验的影响.未加乙酸和厌氧泥的非生物空白对照 CK2,未见甲烷的产生和乙酸的降解,该结果可排除背景生物环境的影响.

图1 顶空中甲烷含量Fig.1 The amount of methane in headspace
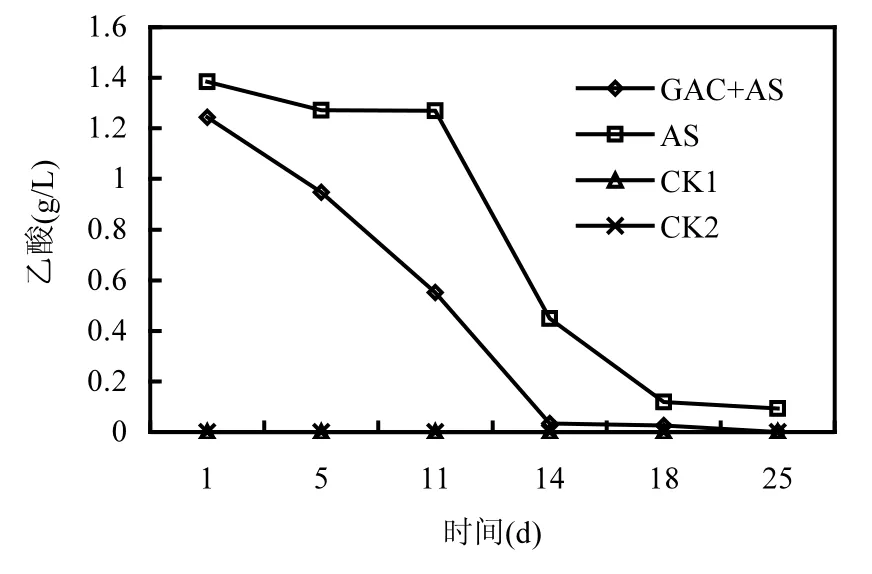
图2 乙酸浓度的变化Fig.2 Variation of Acetate concentration
本研究结果与近期的研究相似.Liu等[3]在Geobacter metallireducens和 Methanosarcina barkeri互营共培养体系中,发现投加 GAC促进产CH4速率约2.5倍.Lee等[4]在半连续厌氧反应器中投加 GAC,发现 GAC促进产 CH4速率约80%.
2.2 生物量变化
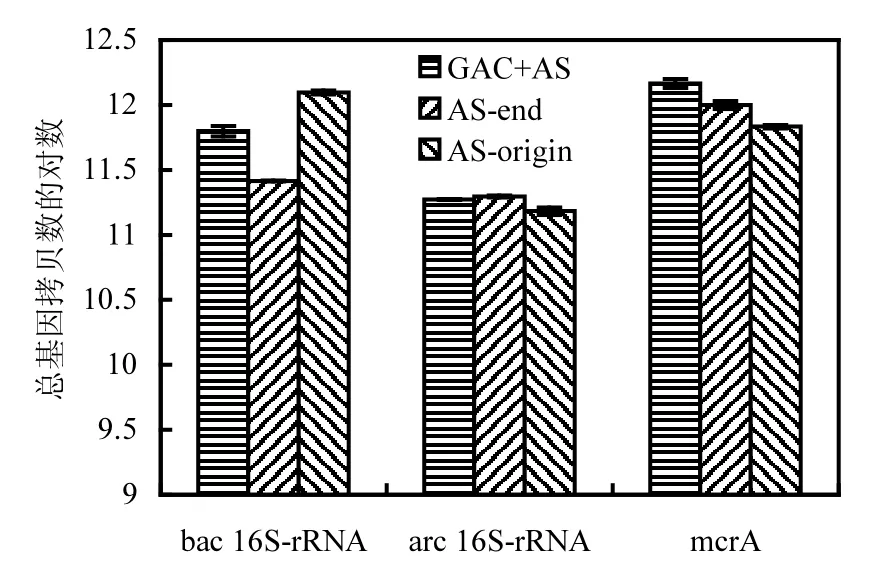
图3 细菌、古菌和甲烷古菌的定量PCR结果Fig.3 Quantative PCR results of bacteria, archaea, and methangen
采用定量PCR分析总细菌、古菌、产甲烷古菌的总数.如图 3所示,实验组与对照组总细菌、古菌、产甲烷古菌的总数变化不大,均在同一数量级范围内,说明 GAC载体对于生物量的贡献微小.这有可能是因为载体表面之间的摩擦使得生物难以附着.GAC的添加对甲烷古菌有明显的促进作用,宿程远等[17]研究生物质炭的添加对厌氧体系的作用,通过三维荧光光谱和傅里叶红外分析发现,生物质炭的投加能够促进产甲烷菌的活性.
2.3 微生物群落结构变化
生物种群结构数据基于16sRNA基因高通量测序.如图 4所示,在门水平,厌氧污泥处理前后具有一定的相似性,Euyarchaeota均为优势古菌,Firmicutes,Synergistetes, Chloroflexi为共同的优势细菌.但厌氧污泥处理前后也表现出明显的差异,起始污泥的优势细菌Bacteroidetes和WWE1经过批实验处理后成为非优势细菌,另外Termotogae和OP8经过实验处理后比例明显上升.

图4 门水平种群结构Fig.4 Microbial structure in pylum level
在科水平进一步分析群落结构变化.在细菌方面,如图 5所示,起始污泥优势菌群Dethiosulfobiaceae (7%), D2 (13%),经过高温以及加入GAC的处理后,这两种菌群的比例下降明显;在经过高温处理但未加 GAC的处理中,Thermodesulfolbiaceaea (9%)比例增加明显并成为其优势细菌,并强化出 Termotogae;在经过高温处理且加入GAC的处理中, Thermodesulfolbiaceaea(21%)和 Anaerobaculaceae (11%)的比例增加明显且称为优势菌群,并强化出Termotogae.在古菌方面,如图 6所示,起始污泥优势甲烷古菌为Methanosaetaceae (14%),在经过高温处理但未加GAC的处理中以及加入GAC的处理中,优势的甲烷古菌均变为Methanosacinaceae (比例分别为42%和11%).

图5 科水平优势细菌分布Fig.5 Dominate bacteria in family level
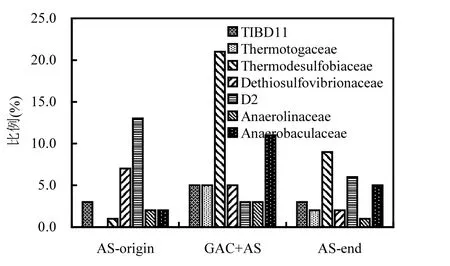
图6 科水平优势产甲烷古菌分布Fig.6 Dominate methanogen at fanmily level
本研究种群结构的明显变化与高温处理紧密相关.高温处理后的污泥中,不论有无添加GAC,高温消化菌 Thermodesulfolbiaceae均成为优势细菌,高温消化菌 Termotogae均得以强化,Methanosacinaceae成为优势古菌.这与以往高温消化的群落研究相似.Ho等[1]在剩余污泥高温消化的研究中,发现Methanosacinaceae为优势甲烷古菌,高温消化菌Termotogae的比例明显提高.
添加GAC和未加GAC的处理相比,群落结构非常相近,主要的差异表现在Anaerobaculaceae上,在加入GAC的处理中该科细菌明显富集并成为优势菌群,目前对于 Anaerobaculaceae(属于梭杆菌纲)的研究较少,尚不能确认其在添加 GAC的厌氧群落中的功能.加入 GAC的处理中没有发现已知电活性菌的存在,这意味着在高温消化群落之中可能存在其他可以向甲烷古菌直接传递电子的细菌,这留待进一步更为细致的研究.
3 结论
3.1 GAC的加入明显促进高温消化,通过定量PCR分析这种促进的机理与GAC对生物量的贡献并不相关.
3.2 高通量测序结果发现高温下添加 GAC富集了高温消化菌 Thermodesulfolbiaceae,Anaerobaculaceae,以及古菌Methanosacinacea.
3.3 需要进一步研究 GAC对高温消化的强化机理,在下一步研究中需要进行长期实验,解析微生物群落的响应.
参考文献:
[1]Ho D P, Jensen P D, Batstone D J. Methanosarcinaceae and acetate-oxidizing pathways dominate in high-rate thermophilic anaerobic digestion of waste-activated sludge [J]. Applied &Environmental Microbiology, 2013,79(20):6491.
[2]Carballa M, Regueiro L, Lema J M. Microbial management of anaerobic digestion: exploiting the microbiome-functionality nexus [J]. Current Opinion in Biotechnology, 2015,33:103-111.
[3]Liu F, Rotaru A E, Shrestha P M, et al. Promoting direct interspecies electron transfer with activated carbon [J]. Energy &Environmental Science, 2012,5(10):8982-8989.
[4]Lee J Y, Lee S H, Park H D. Enrichment of specific electro-active microorganisms and enhancement of methane production by adding granular activated carbon in anaerobic reactors [J].Bioresource Technology, 2016,205:205.
[5]Schink B. Energetics of syntrophic cooperation in methanogenic degradation [J]. Microbiology & Molecular Biology Reviews Mmbr, 1997,61(2):262-280.
[6]McInerney M J, Sieber J R, Gunsalus R P. Syntrophy in anaerobic global carbon cycles [J]. Current opinion in biotechnology, 2009,20(6):623-632.
[7]Stams A J M, Plugge C M. Electron transfer in syntrophic communities of anaerobic bacteria and archaea [J]. Nature Reviews Microbiology, 2009,7(8):568-577.
[8]Reguera G, Mccarthy K D, Mehta T, et al. Extracellular electron transfer via microbial nanowires [J]. Nature, 2005,435(7045):1098-1101.
[9]Malvankar N S, Vargas M, Nevin K P, et al. Tunable metallic-like conductivity in microbial nanowire networks [J]. Nature Nanotechnology, 2011,6(9):573-579.
[10]Cruz V C, Rossetti S, Fazi S, et al. Magnetite particles triggering a faster and more robust syntrophic pathway of methanogenic propionate degradation [J]. Environmental Science & Technology,2014,48(13):7536.
[11]Dang H, Jensen P, Batstone D. Effects of Temperature and Hydraulic Retention Time on Acetotrophic Pathways and Performance in High-Rate Sludge Digestion [J]. Environmental Science & Technology, 2014,48(11):6468-6476.
[12]Lovley D R, Ueki T, Zhang T, et al. Geobacter : The Microbe Electric's Physiology, Ecology, and Practical Applications [J].Advances in Microbial Physiology, 2011,59:1.
[13]Morita M, Malvankar N S, Franks A E, et al. Potential for Direct Interspecies Electron Transfer in Methanogenic Wastewater Digester Aggregates [J]. Mbio, 2011,2(4):e00159-11.
[14]Kemnitz D, Kolb S, Conrad R. Phenotypic characterization of Rice Cluster III archaea without prior isolation by applying quantitative polymerase chain reaction to an enrichment culture[J]. Environmental Microbiology, 2005,7(4):553–565.
[15]Bao Q L, Xiao K Q, Chen Z, et al. Methane production and methanogenic archaeal communities in two types of paddy soil amended with different amounts of rice straw [J]. Fems Microbiology Ecology, 2014,88(2):372–385.
[16]Xu Y, Ma K, Huang S, et al. Diel cycle of methanogen mcrA transcripts in rice rhizosphere [J]. Environmental Microbiology Reports, 2012,4(6):655–663.
[17]宿程远,郑 鹏,卢宇翔,等.海泡石与生物质炭强化厌氧处理养猪废水 [J]. 中国环境科学, 2017,37(10):3764-3772.

