消化系统神经内分泌肿瘤的临床病理特征与生存分析*
神经内分泌肿瘤(neuroendocrineneoplasms,NENs)是一组起源于肽能神经元和神经内分泌细胞的异质性肿瘤,可发生于全身多个器官和组织,其中以消化系统最为常见。消化系统肿瘤世界卫生组织(WHO)分类2010版对NENs进行了新分类。近几年消化系统NENs的诊断和治疗逐渐规范化,但对于新分类也发现一些问题。另外,我国病理和临床医生在实践工作中也发现我国的消化系统NENs在发病部位、临床特征等方面与欧美国家存在一定差异。我国目前关于消化系统NENs的相关报道相对较少,大宗病例的细致分析更少。因此,本研究收集了使用新分类后明确诊断为消化系统NENs的284例患者的临床病理资料和随访数据,根据部位、WHO分类进行了深入分析,旨在探讨我国消化系统NENs的临床病理特征及与患者生存相关的因素。
1 材料与方法
1.1 病例资料
回顾性分析天津医科大学肿瘤医院2011年3月至2015年12月收治并经病理诊断为消化系统NENs的患者284例,收集患者性别、年龄、肿瘤部位、肿瘤大小、肿瘤浸润深度、WHO分类、临床分期、淋巴结转移、远处转移、随访等数据。284例患者中,男性169例(59.5%),女性115例(40.5%),男女比例为1.47∶1。确诊年龄9~80岁,平均年龄(55.1±12.7)岁,中位年龄57岁。原发肿瘤263例,临床病理资料见表1。随访时间从疾病确诊之日截至2016年8月31日。
1.2 方法
1.2.1 免疫组织化学染色 每例肿瘤组织经福尔马林固定、石蜡包埋,均进行Syn、CgA、Ki-67免疫组织化学染色。对于Syn、CgA表达不佳的部分病例加染CD56,基于鉴别诊断的需要,依据肿瘤部位补充免疫组织化学检测。所有石蜡标本制成4 μm切片后常规脱蜡,枸橼酸钠抗原修复,加入3%过氧化氢封闭10 min后按照说明书常规进行免疫组织化学染色。
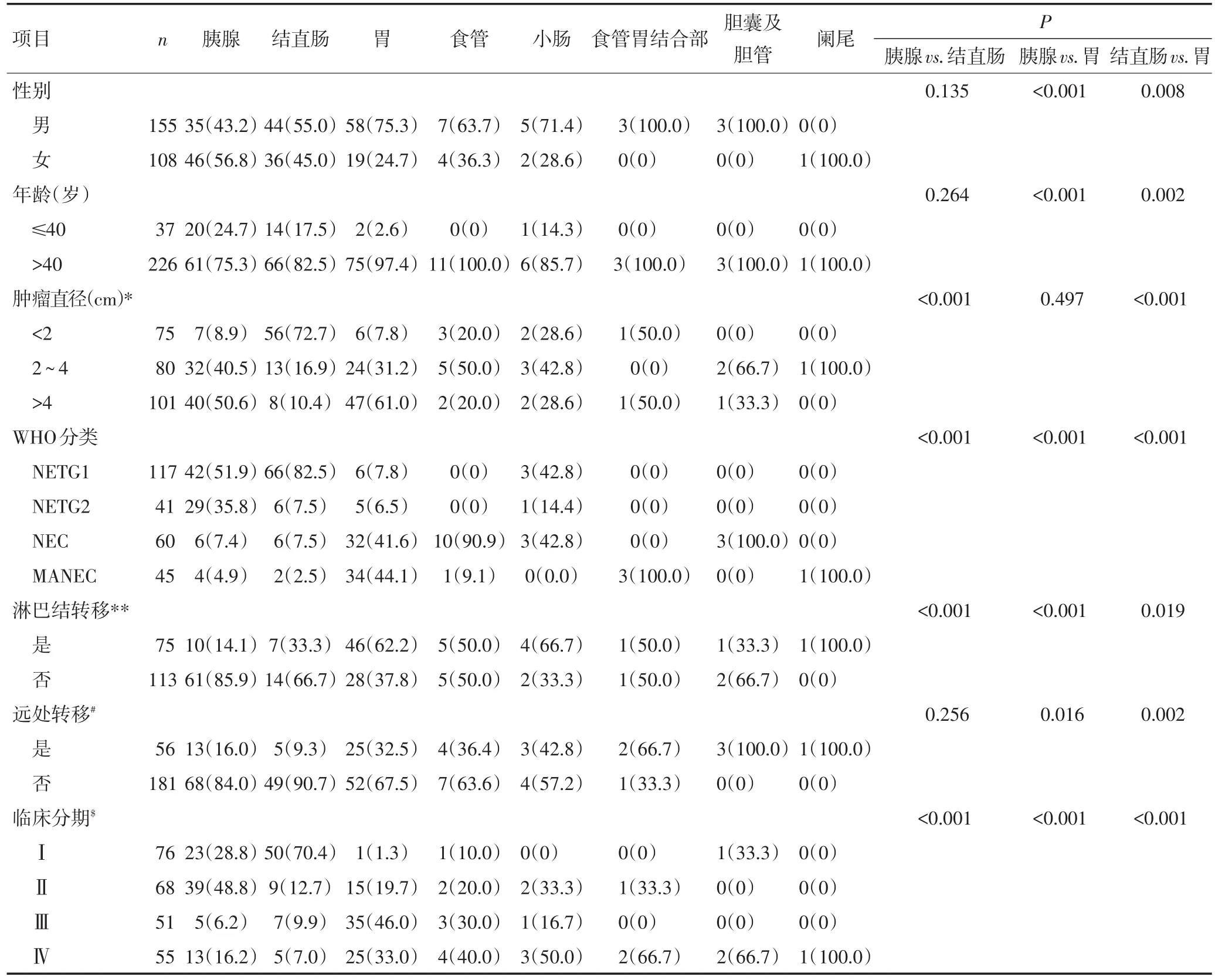
表1 263例原发胃肠胰NENs的部位分布及其临床病理特征 n(%)
1.2.2 消化系统NENs分类 依据WHO 2010分类标准[1],消化系统NENs分为神经内分泌瘤(neuroendo⁃crine tumor,NET)G1、NETG2、神经内分泌癌(neuro⁃endocrine carcinoma,NEC)和混合性腺神经内分泌癌(mixed adenoneuroendocrine carcinoma,MANEC)(图1)。当核分裂象与Ki-67指数不一致时,以级别高的为准。MANEC严格按照WHO的定义,具有典型的腺癌和神经内分泌癌成分,且每种成分占30%以上。
1.3 统计学分析
采用SPSS 22.0软件进行统计学分析。计量资料以表示,组间比较采用t检验;计数资料组间比较采用χ2检验或Fisher确切概率法;采用Kaplan-Meier法、Logrank检验进行单因素生存分析,Cox回归进行多因素生存分析。以P<0.05为差异具有统计学意义。
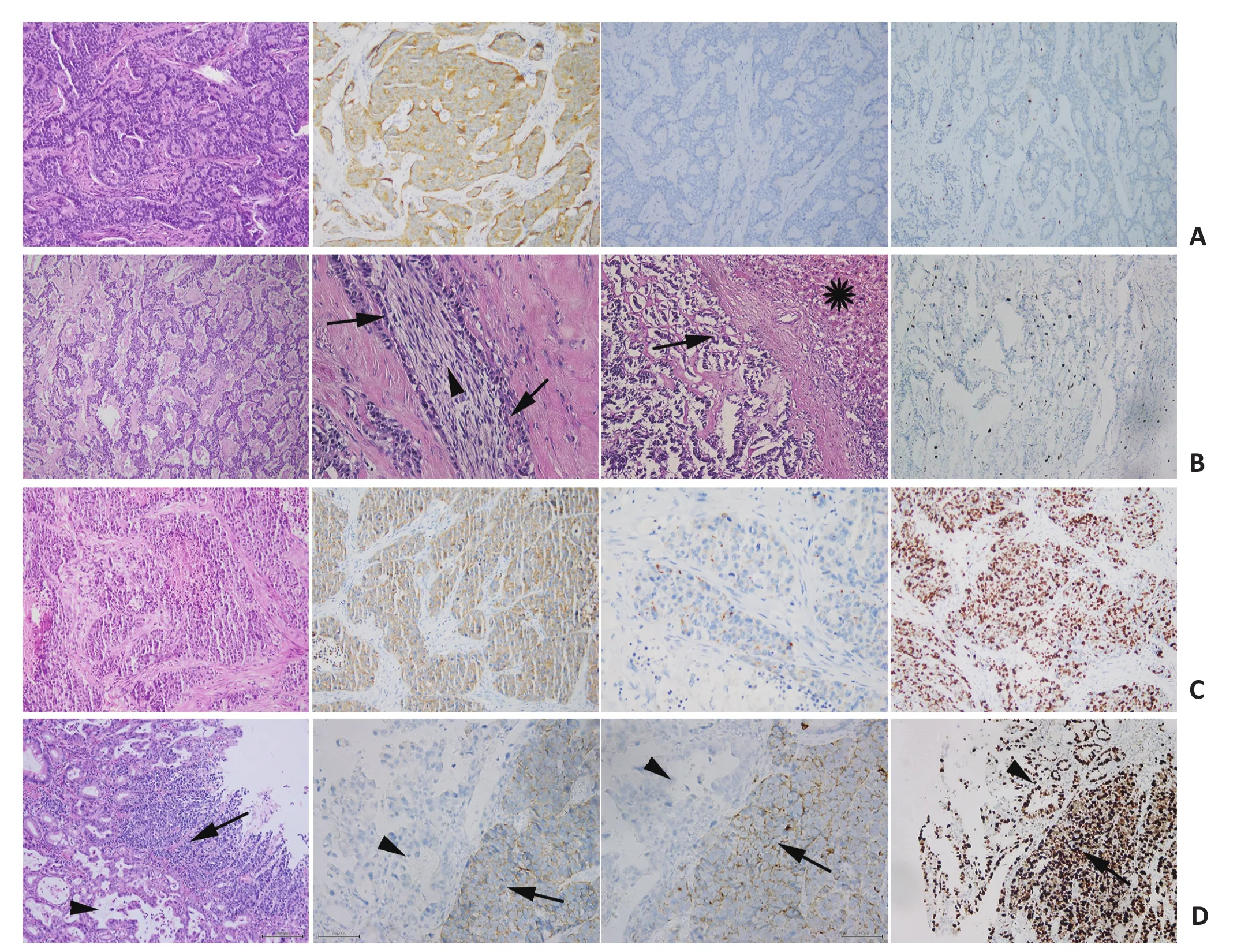
图1 胃肠胰NENs的病理图像
2 结果
2.1 全部病例的分布特征与生存分析
284例患者中,263例原发肿瘤部位分布为胰腺81例(30.8%)、结直肠80例(30.4%)、胃77例(29.3%)、食管11例(4.2%)、小肠7例(2.7%)、食管胃结合部3例(1.1%)、胆囊及胆管3例(1.1%)、阑尾1例(0.4%)。21例来自转移灶,其中肝转移灶16例(原发于胰腺、胆道和十二指肠分别为10、2、1例,3例排除肺原发、同时有腹膜后淋巴结转移但原发灶不明)、腹膜后转移灶5例(原发于胰腺和十二指肠分别为3、1例,1例原发灶不明)。在263例原发肿瘤中,256例经手术切除,7例经咬检、穿刺或切取活检确诊。手术切除的原发瘤平均直径为(4±3.2)cm,其中<2 cm、2~4 cm和>4 cm者各为75例(29.3%)、80例(31.3%)和101例(39.4%)。依照2010年WHO分类标准,对全部肿瘤进行分类:NET G1 119例(41.9%)、NET G2 51例(18.0%)、NEC 69例(24.3%)、MANEC 45例(15.8%)。各器官肿瘤的分类见图2A。在全部病例中,177例(62.3%)行手术切除原发肿瘤,72例(25.4%)手术切除联合化疗,4例(1.4%)手术切除联合生物治疗,3例(0.7%)手术切除联合化疗与靶向治疗,8例(2.8%)仅进行转移灶切除,13例(4.6%)仅进行化疗,2例(0.7%)化疗联合生物治疗,1例(0.4%)仅行靶向治疗,1例(0.4%)行放疗联合化疗,3例(1.1%)放弃治疗。在263例原发肿瘤中,188例进行了淋巴结清扫,其中有75例(39.9%)发生淋巴结转移。250例原发性肿瘤具有临床分期资料,根据美国癌症联合委员会(AJCC)TNM分期标准,Ⅰ期76例(30.4%)、Ⅱ期68例(27.2%)、Ⅲ期51例(20.4%)、Ⅳ期55例(22.0%)。
全部病例的随访时间为1~66个月,平均32.4个月。截至随访结束,死亡51例,均为肿瘤相关性死亡(2例放弃治疗),平均总生存期为(26.8±17.3)个月,中位生存期为26个月。单因素生存分析显示,年龄、部位、直径大小、WHO分类、分期、淋巴结转移、远处转移与患者生存相关(均P<0.05,图2B~I),患者年龄>40岁、发生于胃部、肿瘤直径>4 cm、NEC和MAN⁃EC、Ⅳ期、发生淋巴结转移和发生远处转移的患者总生存期较短。而性别与总生存期无相关(P=0.250)。对单因素分析有意义的指标进行Cox回归分析,结果显示有无淋巴结转移(P=0.003,HR=2.847,95%CI:1.433~5.658)和有无远处转移是独立预后因素(P=0.023,HR=2.125,95%CI:1.111~4.063)。

图2 284例胃肠胰NENs临床病理参数相关的生存曲线
2.2 胰腺NENs
81例胰腺NENs中,30例(37.0%)位于胰头颈,51例(63.0%)位于胰体尾;78例进行根治切除,1例进行肿物切除,1例肿物切检,1例穿刺活检。患者的平均年龄为(49.9±14.2)岁。原发肿瘤和患者的临床病理特征见表1。在根治标本中,8例(10.3%)侵犯神经,14例(17.9%)侵犯周围器官,13例(16.7%)提示脉管瘤栓。根据WHO分类与上述侵袭性行为及转移之间的关系(图3A)进行分析,结果显示,与NEC和MANEC相比,NET G1、G2中淋巴结转移、周围器官侵犯、神经侵犯比例更高(分别为P=0.003、0.008、0.003),而不同分类肿瘤在脉管瘤栓、远处转移和临床分期方面差异无统计学意义(分别为P=0.138、0.620、0.393)。截至随访结束,8例患者死亡,其中G1 5例、G2 2例、NEC 1例,患者的平均总生存期为(30.6±19.3)个月。单因素生存分析显示,性别(P=0.658)、年龄(P=0.222)、直径(P=0.330)、WHO分类(P=0.217)、侵犯周围器官(P=0.483)、侵犯神经(P=0.689)和脉管瘤栓(P=0.192)、有无淋巴结转移(P=0.938)、有无远处转移(P=0.381)、临床分期(P=0.126)均与总生存期无关。
另有,13例转移性NENs来自胰腺。对转移灶进行分类评估,G1、G2和NEC分别为2例(15.4%)、6例(46.1%)和5例(38.5%)。截至随访结束,4例(G2 2例、NEC 2例)患者死亡,患者的平均总生存期为(29±19.9)个月。对全部原发于胰腺的94例NENs患者进行单因素生存分析,结果显示有远处转移的患者总生存期较短(P=0.048,图3B)。
2.3 结直肠NENs
80例结直肠NENs的临床病理资料见表1。其中,右半结肠5例(6.2%),左半结肠3例(3.8%),直肠72例(90.0%)。患者的平均年龄为(53.4±12.9)岁。21例进行了肠区段切除手术,37例进行了内镜下肿物切除术,19例经肛门直肠肿物局切术,3例咬检。其中,NET占90%(G1为82.5%,G2为7.5%),而NEC和MANEC分别仅占7.5%和2.5%。21例进行淋巴结清扫的病例中有7例(33.3%)出现淋巴结转移,其中G1 1例、G2 1例、NEC 5例。与NET G1和G2相比,NEC和MANEC中淋巴结转移、远处转移、进展期的比例更高(分别为P=0.020、<0.001、<0.001,图3C)。在随访结束时,6例患者死亡,其中G1 2例、NEC 4例。单因素生存分析结果显示,有淋巴结转移(P=0.001)、有远处转移(P=0.039)的患者总生存期较短(图3D,E),进展期患者的生存期有较短的趋势但差异无统计学意义(P=0.078),而性别(P=0.124)、年龄(P=0.490)、肿瘤直径(P=0.164)、WHO 分类(P=0.212)均与患者总生存期无关。
与胰腺NENs相比,结直肠NENs中NET G1所占比例更高(P<0.001)、肿瘤体积更小(P<0.001)、淋巴结转移的病例更少(P<0.001)、临床分期更早(P<0.001,表1)。
2.4 胃NENs
77例胃NENs的临床病理资料见表1。男女比例为3.1∶1,患者的平均年龄为(60.0±9.4)岁,97.4%的患者在确诊时>40岁。肿瘤位于近端胃者47例(61.0%),远端胃30例(39.0%)。74例行胃大部切除或全胃切除术,3例行内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)。74例进行淋巴结清扫的病例中46例(62.2%)发生淋巴结转移,其中G1、G2、NEC、MANEC各为1、1、17、27例,NEC和MANEC中淋巴结转移的比例更高(P=0.022)。诊断时发现远处转移的25例患者中,NEC 14例,MANEC 11例,而NET未见远处转移,WHO分类与远处转移有显著相关性(P=0.013)。
另外,NEC和MANEC中进展期的患者比例较高(P<0.001)。WHO分类与淋巴结转移、远处转移和分期的关系见图3F。在随访结束时,17例患者死亡,其中G1、NEC、MANEC各为2、7、8例。单因素生存分析显示,NEC和MANEC(P=0.045)及有淋巴结转移(P=0.021)的患者总生存期较短(图3G,H);而性别(P=0.605)、年龄(P=0.463)、肿瘤直径(P=0.501)、有无远处转移(P=0.426)、临床分期(P=0.116)均与总生存期无关。与胰腺和结直肠相比,胃NENs中男性患者的比例更大(分别为P=0.008、<0.001),40岁以上的患者更多(分别为P=0.002、<0.001),NEC和MANEC比例更高(均P<0.001),淋巴结转移的比例更高(分别为P=0.019、<0.001),远处转移的比例更高(分别为P=0.002、0.016),进展期的患者更多(均P<0.001,表1)。
2.5 其他部位NENs
其他部位NENs的临床病理资料见表1。发生在食管的11例NENs中,NEC 10例(90.9%),MANEC 1例(9.1%),未见NET G1或G2。10例进行了根治性手术,其中5例(50.0%)发现淋巴结转移,4例(40.0%)发现远处转移。在随访结束时,6例死亡,平均总生存期为(11.6±9.1)个月。3例食管胃结合部的NENs均为MANEC,2例进行了根治性手术,其中1例发现淋巴结转移,2例出现远处转移。在随访结束时,2例死亡,平均总生存期为(16±11.3)个月。
7例发生在小肠的NENs中,5例来自十二指肠。NET G1、G2、NEC分别为3例(42.8%)、1例(14.4%)、3例(42.8%)。6例进行了根治性手术切除,1例行肿物切除术。在根治性手术切除的病例中,4例(57.1%)发现淋巴结转移(G1、G2、NEC各为1、1、2例)。3例发现远处转移,均为NEC。在随访结束时,仅1例NEC患者死亡,生存9个月。另外,1例腹膜后转移性NET G2和1例肝转移性NEC的原发病灶为十二指肠,肝转移性NEC患者在随访结束时已死亡,生存8个月。
2例胆囊NENs均为NEC,均累及肝脏与肠系膜或网膜。1例胆囊管NEC,虽未检测到淋巴结转移或远处转移,但肿瘤内可见神经侵犯及脉管瘤栓,且肿瘤细胞沿胆管播散,胆管上、下切端均见肿瘤累犯。另外,2例肝转移性NEC的原发灶为胆管下段。这5例患者截至随访结束,3例死亡,平均总生存期为(26.0±22.9)个月。仅收集到1例发生在阑尾的NE⁃Ns,为MANEC,未见淋巴结转移,但发现远处转移,术后仅生存2个月。

图3 特定部位NENs的WHO分类与临床病理参数的关系及生存曲线
3 讨论
1907年德国病理学家Oberndorfer首次提出了“类癌(carcinoid)”或“类癌瘤(carcinoid tumor)”这一术语。随后,又出现了“胺前体摄取及脱羧(amine precursor uptake and decarboxylation,APUD)肿瘤”或“弥散性神经内分泌系统肿瘤”的名称。WHO于2000年在消化系统规范了“神经内分泌肿瘤”的概念,并于2010年又提出新的分类标准,逐渐统一了对这一类肿瘤的命名及分级。Yao等[2]对美国国立癌症研究所监测、流行病学和结果数据库(SEER)的统计分析显示,美国消化系统NENs的发病率从1973年的1.09/10万增长至2004年的5.25/10万。在挪威、英国和德国,消化系统NENs的发病率在近年来也出现显著上升[3-5]。而中国目前鲜见对消化系统NENs的发病率、死亡率的报道。
在本组病例中,胰腺(30.8%)、结直肠(30.4%)和胃(29.3%)占据消化系统NENs的前三位。来自中国23个医院、包含2001年至2010年共2 010例胃肠胰NENs的流行病学研究显示,胰腺(31.5%)和直肠(29.6%)是胃肠胰NENs的最常见原发部位,随后是胃(15.4%)和贲门(11.6%)[6]。中国其他一些小样本研究也显示,国内消化系统NENs以胰腺、结直肠、胃多见[7-15]。而Sandvik等[3]通过对挪威的204例病例进行分析,结果显示胃肠胰NENs在挪威多发生于小肠,其次为阑尾。法国的668例病例分析表明发生于小肠和结肠的胃肠胰NENs占主要部分,其次为胰腺[16]。Tsikitis等[17]通过对SEER 数据库 1975年至2008年的19 669例胃肠胰NENs进行分析,结果显示以小肠的发病率最高,其次为直肠。中国与欧美国家胃肠胰NENs主要发病部位的差异可能与人种、饮食生活习惯、医疗检测水平差异等因素有关。
本研究对284例胃肠胰NENs的单因素生存分析显示,年龄>40岁、发生于胃、肿瘤直径>4 cm、NEC和MANEC、Ⅳ期、淋巴结转移和远处转移的胃肠胰NENs患者的总体生存较差。进一步的多因素Cox回归分析显示,有无淋巴结转移和远处转移是患者总体生存的独立预后因素。国内其他几个研究也显示发生淋巴结转移和远处转移为影响胃肠胰NENs患者生存的重要因素[7,13,18]。另外,几个国内研究还提示肿瘤直径、WHO分类或患者年龄也是影响胃肠胰NENs患者生存的重要因素[8-9,12,14]。Garcia-Carbonero等[19]通过对西班牙胃肠胰NENs国家癌症登记处(RGETNE)的837例胃肠胰NENs数据进行统计分析发现,临床分期和Ki-67指数为独立预后因素。但是,一些研究者对目前Ki-67指数判断NEN分类的标准提出质疑,至少在胰腺NENs中,以Ki-67标记指数为2%作为G1、G2的界值不能很好地提示预后,而将5%作为界值进行生存分析更有意义[20-25]。并且,有报道在即将出版的WHO新胃肠胰NENs分类中,将原来的NEC分为NET G3和分化差的NEC[26]。在本研究中,WHO分类仅在胃NENs中与患者生存有关。鉴于不同部位的组织发生存在差异,如胃和结直肠分别来源于胚胎期的前肠和后肠、胰腺是一个既包括内分泌又包括外分泌组织的器官,因此本研究认为在某一特定部位分析NENs的临床病理特征和预后因素更合理、更有临床意义。本研究结果显示,胰腺NENs中NET G1和G2的比例均较大,且具有与胰腺癌类似的侵袭性行为,可见肝转移及腹膜后转移。甚至胰腺NET G1、G2中淋巴结转移、周围器官侵犯、神经侵犯比例高于NEC。Yadav等[27]对2003年至2012年间印度68例胰腺NENs进行研究发现,发生神经侵犯、周围器官侵犯、淋巴管浸润和淋巴结转移的胰腺NENs中,NET G1、G2所占比例更高,与本研究结果相一致。但是,本研究中NEC病例仅占胰腺NENs的7.4%,而NET占87.7%,并且临床送检淋巴结的数量、病理报告的详细程度均可能影响统计分析结果,WHO分类与胰腺NENs侵袭性行为的关系需要更多的大样本研究。另外,本研究结果显示,WHO分类与胰腺NENs患者的总体生存期无关,仅远处转移与患者生存有关。Ekeblad等[28]对瑞典324例胰腺NENs病例进行分析,结果显示TNM分期、WHO分类、根治性手术以及Ki-67指数≥2%为独立预后因素。Kim等[29]通过对韩国首尔峨山医院1995年至2015年277例胰腺NENs进行分析,结果显示WHO分级和淋巴血管侵犯为影响患者生存的独立预后因素。如上所述,一些研究者认为以Ki-67指数5%界定G1和G2的预后意义更强[20-25]。
本组病例的结直肠NENs中,NET占90.0%(G1为82.5%,G2为7.5%),与我国23家医院多中心研究中的直肠NET占87.6%(G1为75.8%,G2为11.8%)的研究结果基本一致[6],而Kourie等[30]对2001年至2012年间黎巴嫩89例胃肠胰NENs的统计结果显示,结直肠NENs仅9例,NET与NEC的比例为4:5。Sandvik等[3]对挪威的204例病例进行分析,结果显示结直肠NENs仅33例,NET与NEC的比例为16∶17,均与中国患者的比例有明显的差别。在本组病例中,WHO分类与结直肠NENs患者的总体生存无关,淋巴结转移和远处转移与患者生存有关。Chagpar等[31]通过对美国国家癌症数据库(NCDB)中1998年至2002年被诊断为结直肠NENs的5 457例患者进行统计分析发现,肿瘤浸润深度、肿瘤直径大小、发生淋巴结转移及远处转移为独立预后因素,其中远处转移为最重要的影响因素。Shafqat等[32]对SEER数据库中2000年至2011年诊断为结直肠NEC的1 367例病例进行统计分析,结果显示确诊时年龄更大、男性、Ⅲ期或Ⅳ期以及小细胞类型与更差的生存显著相关。
在本组病例中,与结直肠NENs相比,胃部NENs中男性患者更多、40岁以上的患者更多、NEC和MANEC比例更高、淋巴结转移和远处转移的比例更高、进展期的患者更多。虽然食管及食管胃结合部的NENs病例较少,但也是以NEC和MANEC为主,淋巴结和远处转移多见,患者临床分期晚、预后差。这提示在前肠来源的消化道器官中,恶性度更高的NEC/MANEC更多见,患者预后更差。生存分析显示,WHO分类和淋巴结转移与胃NENs患者的总体生存有关。韩国首尔峨山医院1996年至2014年175例被诊断为胃NENs的患者数据研究显示,WHO G3级、淋巴结转移以及肿瘤浸润深度为影响患者生存的独立预后因素[33]。
上述结果提示,消化系统不同部位的NENs存在表型差异,导致临床处理方式不同,而且其内在的发病机制可能也存在差异。Meeker等[34]总结了68例胰腺NENs、48例小肠NETs与114例胰腺导管腺癌的测序结果,显示与胰腺导管腺癌和小肠NETs相比,胰腺NENs具有其独特的肿瘤相关基因变化,包括MEN1突变、ATRX/DAXX缺失和mTOR通路相关的基因PTEN、TSC2等的突变。Yadav等[27]报道ATRX/DAXX的缺失更多见于直径>5 cm的胰腺NENs,并且存在周围器官侵犯的胰腺NENs均检测到ATRX/DAXX缺失,提示ATRX/DAXX缺失可能与侵袭性表型有关。Kim等[35]报道ATRX/DAXX表达缺失、确诊年龄更晚、更高的肿瘤分级是未发现转移的胰腺NENs患者不良预后的独立因素;而对于发生转移的胰腺NENs,ALT阳性和ATRX/DAXX缺失则与更好的预后相关。Yachida等[36]利用测序和免疫组织化学的方法比较了胰腺NET和NEC,仅在NEC中检测到KRAS突变、p53表达异常、Rb缺失及Bcl-2的高频表达。但是,目前胃肠胰NENs的分类仍是建立在核分裂数目和Ki-67标记指数的基础上,其他分子标志物对于NENs的分类没有明确的诊断意义,但是可能具有潜在的预后意义。对于消化系统其他部位NENs分子标志物的报道较少,仍需要进一步研究。
目前,除了上述的分类标准还存在争议,胃肠胰NENs的临床分期也有待完善。现用的分期为AJCC2010年第7版TNM分期和欧洲神经内分泌协会的ENETS分期,但均有其局限性。在TNM分期中,尚无食管、胆囊和胆管NENs的内容(参照癌分期),阑尾、结直肠NENs的TNM分期系统尚未确定(仅有类癌/高分化肿瘤的TNM分期,低分化肿瘤参照癌),胰腺NENs采用胰腺导管腺癌的TNM分期。同时,临床医生对ENETS分期也存在争议[37]。Luo等[38]提出了对胰腺NENs改善的临床分期“mENETS”。本研究中均采用国内广泛使用的AJCC2010第7版的TNM分期方法,发现仅在结直肠NENs中,进展期患者具有较差的总体生存的趋势,但差异未达到统计学意义。因此,不同部位胃肠胰NENs的分类/分级及临床分期仍需要改善。
综上所述,胃肠胰NENs是一组异质性肿瘤,其发生发展机制、临床转归等方面尚未完全清楚。需要多中心、大样本研究完善诊断及分类标准,建立更好的分期标准,提出更有效的预后参数,从而改善胃肠胰NENs的诊治和预防,降低胃肠胰NENs的发病率及死亡率。
[1]Bosman FT,Carneiro F,Hruban RH,et al.WHO classification of tu‐mours of the digestive system[M].IARC Press,Lyon,2010:64‐68.
[2]Yao JC,Hassan M,Phan A,et al.One hundred years after"carci‐noid":epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States[J].J Clin Oncol,2008,26(18):3063‐3072.
[3]Sandvik OM,Soreide K,Gudlaugsson E,et al.Epidemiology and classification of gastroenteropancreatic neuroendocrine neoplasms using current coding criteria[J].Br J Surg,2016,103(3):226‐232.
[4]Fraenkel M,Kim M,Faggiano A,et al.Incidence of gastroentero‐pancreatic neuroendocrine tumours:a systematic review of the lit‐erature[J].Endocr Relat Cancer,2014,21(3):R153‐R163.
[5]Scherubl H,Streller B,Stabenow R,et al.Clinically detected gastro‐enteropancreatic neuroendocrine tumors are on the rise:epidemi‐ological changes in Germany[J].World J Gastroenterol,2013,19(47):9012‐9019.
[6]Fan JH,Zhang YQ,Shi SS,et al.A nation‐wide retrospective epide‐miological study of gastroenteropancreatic neuroendocrine neo‐plasms in china[J].Oncotarget,2017,8(42):71699‐71708.
[7]Hu HK,Ke NW,Li A,et al.Clinical characteristics and prognostic fac‐tors of gastroenteropancreatic neuroendocrine tumors:a single center experience in China[J].Hepatogastroenterology,2015,62(137):178‐183.
[8]Chan DT,Luk AO,So WY,et al.Natural history and outcome in Chi‐nese patients with gastroenteropancreatic neuroendocrine tu‐mours:a 17‐year retrospective analysis[J].BMC Endocr Disord,2016,16:12.
[9]Jiao X,Li Y,Wang H,et al.Clinicopathological features and survival analysis of gastroenteropancreatic neuroendocrine neoplasms:a retrospective study in a single center of China[J].Chin J Cancer Res,2015,27(3):258‐266.
[10]Guo LJ,Wang CH,Tang CW.Epidemiological features of gastroenter‐opancreatic neuroendocrine tumors in Chengdu city with a popula‐tion of 14 million based on data from a single institution[J].Asia Pac J Clin Oncol,2016,12(3):284‐288.
[11]Tang C,Gong L,Zou W,et al.Multivariate analysis of metastasisre‐lated risk factors for patients with gastroenteropancreatic neuroen‐docrine tumors based on clinicopathological and endoscopic fea‐tures[J].Oncol Rep,2016,36(6):3343‐3352.
[12]Zhang X,Ma L,Bao H,et al.Clinical,pathological and prognostic characteristics of gastroenteropancreatic neuroendocrine neoplasms in China:a retrospective study[J].BMC Endocr Disord,2014,14:54.
[13]Fang C,Wang W,Zhang Y,et al.Clinicopathologic characteristics and prognosis of gastroenteropancreatic neuroendocrine neo‐plasms:a multicenter study in South China[J].Chin J Cancer,2017,36(1):51.
[14]Wang YH,Lin Y,Xue L,et al.Relationship between clinical character‐istics and survival of gastroenteropancreatic neuroendocrine neo‐plasms:A single‐institution analysis(1995‐2012)in South China[J].BMC Endocr Disord,2012,12:30.
[15]Zhang M,Zhao P,Shi X,et al.Clinicopathological features and prog‐nosis of gastroenteropancreatic neuroendocrine neoplasms in a Chinese population:a large,retrospective single‐centre study[J].BMC Endocr Disord,2017,17(1):39.
[16]Lombard‐Bohas C,Mitry E,O'toole D,et al.Thirteen‐month registra‐tion of patients with gastroenteropancreatic endocrine tumours in France[J].Neuroendocrinology,2009,89(2):217‐222.
[17]Tsikitis VL,Wertheim BC,Guerrero MA.Trends of incidence and sur‐vival of gastrointestinal neuroendocrine tumors in the United States:a seer analysis[J].J Cancer,2012,3:292‐302.
[18]Zeng YJ,Liu L,Wu H,et al.Clinicopathological features and prognosis of gastroenteropancreatic neuroendocrine tumors:analysis from a single‐institution[J].Asian Pac J Cancer Prev,2013,14(10):5775‐5781.
[19]Garcia‐Carbonero R,Capdevila J,Crespo‐Herrero G,et al.Inci‐dence,patterns of care and prognostic factors for outcome of gas‐troenteropancreatic neuroendocrine tumors(GEP‐NETs):results from the National Cancer Registry of Spain(RGETNE)[J].Ann On‐col,2010,21(9):1794‐1803.
[20]Jin K,Luo G,Xu J,et al.Clinical outcomes and prognostic factors of resected pancreatic neuroendocrine neoplasms:A single‐center ex‐perience in China[J].Oncol Lett,2017,13(5):3163‐3168.
[21]Boninsegna L,Panzuto F,Partelli S,et al.Malignant pancreatic neu‐roendocrine tumour:lymph node ratio and Ki67 are predictors of recurrence after curative resections[J].Eur J Cancer,2012,48(11):1608‐1615.
[22]Panzuto F,Boninsegna L,Fazio N,et al.Metastatic and locally advanced pancreatic endocrine carcinomas:analysis of factors associated with disease progression[J].J Clin Oncol,2011,29(17):2372‐2377.
[23]Khan MS,Luong TV,Watkins J,et al.A comparison of Ki‐67 and mitotic count as prognostic markers for metastatic pancreatic and midgut neuroendocrine neoplasms[J].Br J Cancer,2013,108(9):1838‐1845.
[24]Rindi G,Falconi M,Klersy C,et al.TNM staging of neoplasms of the endocrine pancreas:results from a large international cohort study[J].J Natl Cancer Inst,2012,104(10):764‐777.
[25]Scarpa A,Mantovani W,Capelli P,et al.Pancreatic endocrine tumors:improved TNMstaging and histopathological grading permit a clinically efficient prognostic stratification of patients[J].Mod Pathol,2010,23(6):824‐833.
[26]Kim JY,Hong SM,Ro JY.Recent updates on grading and classification of neuroendocrine tumors[J].Ann Diagn Pathol,2017,29:11‐16.
[27]Yadav R,Kakkar A,Sharma A,et al.Study of clinicopathological fea‐tures,hormone immunoexpression,and loss of ATRX and DAXX ex‐pression in pancreatic neuroendocrine tumors[J].Scand J Gastroen‐terol,2016,51(8):994‐999.
[28]Ekeblad S,Skogseid B,Dunder K,et al.Prognostic factors and sur‐vival in 324 patients with pancreatic endocrine tumor treated at a single institution[J].Clin Cancer Res,2008,14(23):7798‐7803.
[29]Kim SJ,An S,Lee JH,et al.Loss of progesterone receptor expres‐sion Is an early tumorigenesis event associated with tumor progres‐sion and shorter survival in pancreatic neuroendocrine tumor pa‐tients[J].J Pathol Transl Med,2017,51(4):388‐395.
[30]Kourie HR,Ghorra C,Rassy M,et al.Digestive neuroendocrine tu‐mor distribution and characteristics according to the 2010 WHO classification:a single institution experience in lebanon[J].Asian Pac J Cancer Prev,2016,17(5):2679‐2681.
[31]Chagpar R,Chiang YJ,Xing Y,et al.Neuroendocrine tumors of the colon and rectum:prognostic relevance and comparative perfor‐mance of current staging systems[J].Ann Surg Oncol,2013,20(4):1170‐1178.
[32]Shafqat H,Ali S,Salhab M,et al.Survival of patients with neuroen‐docrine carcinoma of the colon and rectum:a population‐based analysis[J].Dis Colon Rectum,2015,58(3):294‐303.
[33]Kim BS,Park YS,Yook JH,et al.Differing clinical courses and progno‐ses in patients with gastric neuroendocrine tumors based on the 2010‐WHO classification scheme[J].Medicine(Baltimore),2015,94(44):e1748.
[34]Meeker A,Heaphy C.Gastroenteropancreatic endocrine tumors[J].Mol Cell Endocrinol,2014,386(1‐2):101‐120.
[35]Kim JY,Brosnan‐Cashman JA,An S,et al.Alternative lengthening of telomeres in primary pancreatic neuroendocrine tumors Is associ‐ated with aggressive clinical behavior and poor survival[J].Clin Can‐cer Res,2017,23(6):1598‐1606.
[36]Yachida S,Vakiani E,White CM,et al.Small cell and large cell neu‐roendocrine carcinomas of the pancreas are genetically similar and distinct from well‐differentiated pancreatic neuroendocrine tumors[J].Am J Surg Pathol,2012,36(2):173‐184.
[37]Rindi G,Kloppel G,Alhman H,et al.TNM staging of foregut(neuro)endocrine tumors:a consensus proposal including a grading system[J].Virchows Arch,2006,449(4):395‐401.
[38]Luo G,Javed A,Strosberg JR,et al.Modified staging classification for pancreatic neuroendocrine tumors on the basis of the Ameri‐can joint committee on cancer and european neuroendocrine tu‐mor society systems[J].J Clin Oncol,2017,35(3):274‐280.

