麦苗酵素发酵工艺的优化及其抗氧化功能
冯彦君, 张 慜*, 韩宇斌
(1.江南大学 食品学院,江苏 无锡 214122;2.海通食品集团有限公司,浙江 慈溪 315300)
大麦苗是禾本科越年生草本植物大麦的幼苗,其营养丰富,所含维生素、矿物质及蛋白质是人类与动物的必需营养,还含有叶绿素、黄酮类物质、活性酶、维生素等生物活性物质[1]。大麦苗有着悠久的食用药用历史,我国明代医药学家李时珍就在《本草纲目》中写到:“麦苗,气味辛、寒、无毒。主治消酒毒、暴热,酒疽、目黄,并捣烂绞碎滤服之,又解蛊毒;煮汁滤服,除烦闷。除时疾狂热,退胸隔热,利小肠。作苗,甚益颜色[2]”。近年来,大麦苗制作的保健食品以其独特营养价值及保健作用,在日本、美国等发达国家也倍受关注。而在我国,现在大麦苗保健食品及其相关研究还很少。
“酵素”本是酶(enzyme)的旧译,后来也被用来称呼一些发酵产品,如植物酵素、环保酵素、酵素菌肥等;而植物酵素指以新鲜蔬菜、水果等植物为原料,经多种益生菌发酵而产生的,含有丰富的酶、维生素、矿物质和次生代谢产物的微生物制剂[3-4]。按照生产过程中是否人为接种菌种,酵素可以分为天然酵素和人工酵素2类。天然酵素生产工艺简单,但生产周期较长;人工酵素生产工艺复杂,但生产周期短,且产品质量较稳定。本文中的麦苗酵素属于人工酵素。研究表明植物酵素具有消炎、抗菌、抗氧化、净化血液、促进细胞新生、增强免疫力等作用[4],有些还表现出了一定的抗肿瘤作用[5-6]。因其较好的保健功能,植物酵素在日本以及我国台湾地区大受欢迎。尽管国内市场上也出现了一些植物酵素产品,但数量仍然很少,还有广阔的发展空间。
本文作者以大麦幼苗为原料,通过匀浆、灭菌、发酵等步骤,制成麦苗酵素产品。酵母菌通过本身的代谢过程,使底物产生一系列的生物化学变化,实现营养物质之间的相互转化,为产生新的生理物质如各种酶、维生素及次级代谢产物等提供前体物。因此发酵后的产品,其营养价值远远超过了麦苗本身。对于麦苗酵素,超氧化物歧化酶(SOD)是其主要的功效酶之一。SOD是一类重要的抗氧化的酶,广泛存在与人类和各种生物中,具有很强的抗氧化的作用,清除体内的超氧离子自由基,保护机体免受自由基的伤害,所以在抗癌、抗衰老、抗炎症、抗辐射等疾病中具有不可忽视的作用[7]。尽管外源性酶的摄入与人体内源酶含量的关系比较复杂,但已有一些研究证明,虽然其机理尚不清楚,口服外源性SOD酶确实可使人体内SOD酶活性升高[8-9],且有利于治疗一些疾病[10]。
本文中以SOD酶活力为指标,对麦苗酵素的发酵工艺进行了优化,以期为麦苗酵素发酵的工业化生产提供理论依据;同时研究了其抗氧化能力,测定了包括过氧化氢酶(CAT)活力、总酚质量浓度以及羟基自由基清除率在内的抗氧化指标,为进一步探明麦苗酵素中的活性物质提供一定的数据资料,为大麦苗的多功能开发提供一个新的思路。
1 材料与方法
1.1 材料与仪器
大麦苗,海通食品集团产品;活性干酵母,安琪酵母股份公司产品;硫酸镁、氯化锌、甲硫氨酸、十二水合磷酸氢二钠、一水合磷酸二氢钠、体积分数30%过氧化氢、无水碳酸钠、水杨酸钠、硫酸亚铁、没食子酸(均为分析纯),核黄素、福林酚、氯化硝基四氮唑蓝、酵母膏(均为生化试剂),国药集团化学试剂有限公司产品;JYL-C020九阳榨汁机,九阳股份有限公司产品;GM1010光照度测试仪,深圳聚茂源科技有限公司产品。
1.2 实验方法
1.2.1工艺流程麦苗→匀浆→调配,灭菌→接种
菌→恒温发酵→麦苗酵素
1.2.2操作要点
1)大麦苗匀浆液的制备:将大麦苗挑选去杂,用无菌水洗净,称取15 g,加100 mL无菌水,用打浆机打成匀浆。
2)发酵基质的制备及灭菌:向大麦苗匀浆液中添加以下营养物质 (以大麦苗质量为1):酵母膏0.2%、硫酸镁0.1%、氯化锌0.1%,磷酸二氢钾和磷酸氢二钾各0.05%[11]。调节pH,使初始pH保持在6.0左右。蔗糖(碳源)质量按每次实验的需要(参见1.2.4,下同)添加。然后用紫外灯灭菌1 h,准备接种。
3)酵母菌接种及发酵:将活性干酵母活化后按每次实验的需要量接种到冷却后的发酵基质中,于恒温培养箱中恒温发酵一定时间,所需温度及时间按每次实验的需要设定。发酵后的上清液即为麦苗酵素产品,取样进行测定。1.2.3主要指标检测方法
1)SOD活力的测定:取干净的具塞试管若干,编号,2支为对照管,其余为测定管,按要求加入酵素液,并做3次平行。混匀后将1支对照管置于暗处,其他各管于4000lx光照下反应20 min(各管受光条件一致)。反应结束后立刻避光,不照光的对照管做空白,在560 nm处测吸光值,以抑制NBT光还原的50%为一个酶活力单位,计算活力,公式如下式(1):

式(1)中,SOD总活力以每克麦苗酵素质量的酶单位表示 (U/g);ACK为照光对照管的吸光度;AE为样品管的吸光度;Vt为测定时样品用量(mL)[12]。
2)CAT活力的测定:取10 mL试管3支,其中2支为测定管,1支为空白对照管,按下表顺序加入试剂。
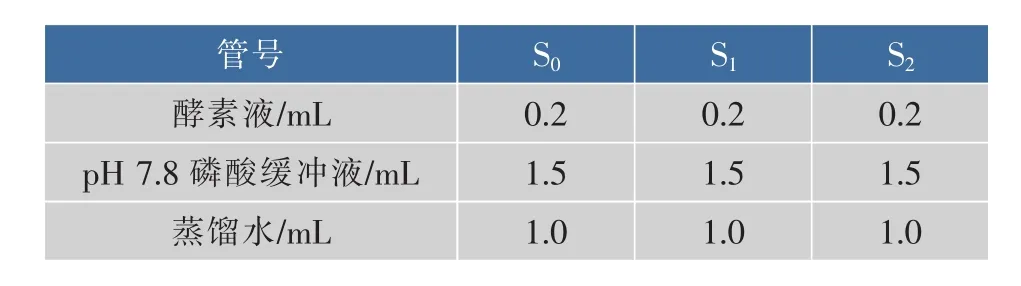
S0号管在沸水浴中煮1 min以杀死酵素液中的酶液,冷却。将所有试管在25℃下预热后,逐管加入0.3 mL 0.1 mol/L的H2O2,每加完一管立即计时,并迅速导入石英比色皿中,在240 nm下测定吸光度,每间隔1 min读数1次,共测4 min,待3支管全部测定完后,计算酶活力。做3次平行测定。
以每分钟A240减少0.1的酶量为1个酶活力单位(U):
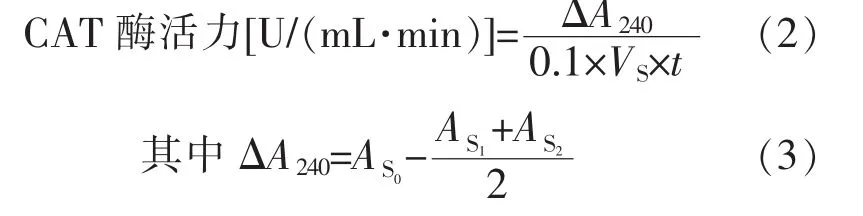
式(2)、(3)中,AS0为加入煮死酶液的对照管的吸光度;AS1
、AS2
为样品测定管的吸光度;VS为测定时所用酶液体积(mL);t为从加H2O2开始到最后一次读数的时间;0.1为A240下降0.1时的1个酶活力单位(U)[12]。
4)总酚质量浓度的测定:配制0.1 mg/mL没食子酸标准溶液,分别取该标准溶液0、0.1、0.2、……、0.5 mL于10 mL刻度试管中,加入5 mL H2O、1 mL福林酚试剂和2 mL质量分数10%Na2CO3,加水定容到刻度,在760 nm下测吸光度A760,绘制标准曲线。以0.5 mL酵素液代替标准溶液重复上述步骤,根据标准曲线计算总酚质量浓度[13-14]。
5)羟基自由基清除率的测定:向2 mL 1.5 mmol/L FeSO4、1.4 mL 6 mmol/L H2O2、0.6 mL 20 mmol/L 水杨酸钠的混合溶液中加入135 μL酵素样品,37℃恒温水浴1 h,在562 nm处测定吸光度A562(去离子水作参比溶液),以抗坏血酸为阳性对照。羟基自由基清除率的计算公式如式(4):
羟基自由基清除率(%)=100×[A0-(A1-A2)]/A0(4)式(4)中:A0为空白对照液的吸光度;A1为样品测定管的吸光度;A2为样品本底管的吸光度[15]。
1.2.4麦苗酵素酵母发酵工艺条件的优化待优化的工艺条件包括发酵温度、酵母接种体积分数、发酵时间、蔗糖(碳源)添加质量分数等。
1)发酵温度对麦苗酵素SOD及CAT活力的影响:发酵温度影响酵母菌的生长情况,进而影响其SOD等代谢产物的生成,因此对酵素液中的活力具有很大的影响;此外温度本身对于酶活的影响也很大,故在此处除SOD外,还测定了CAT的活力,来研究温度对于酵素中酶活的影响。将酵母接种体积分数固定为0.67%,分别控制温度为27、32、37℃进行发酵,发酵时间为12 h,发酵后测定酵素液SOD及CAT活力,确定最适发酵温度。
2)酵母接种体积分数对麦苗酵素SOD活力的影响:酵母接种体积分数直接影响着酵母产SOD的量及活力,需要通过实验确定最佳接种体积分数。将发酵温度控制在32℃,蔗糖(碳源)添加质量分数为6.7%,分别接种体积分数为0.33%、0.50%、0.67%、0.83%、1.0%的酵母菌进行发酵,发酵时间分别为6、12 h和18h,发酵结束后测定其SOD的活力,确定最适酵母菌接种体积分数。
3)发酵时间对麦苗酵素SOD活力的影响:发酵时间影响着酵母的生长量及SOD的活力,将发酵温度固定为32℃,接种酵母0.67%(体积分数),在蔗糖(碳源)添加质量分数分别为3.3%、5.3%和6.7%(以大麦苗质量为1)时,将发酵时间设置为6、9、12、15 h,发酵结束后取样测其SOD的活力,确定最适发酵时间。
4)蔗糖(碳源)添加质量分数对麦苗酵素SOD活力的影响:本文以蔗糖为额外的碳源,其添加质量分数将影响酵母的生长状况,进而影响其SOD活力。将发酵温度固定为32℃,酵母接种体积分数固定为0.67%,将蔗糖添加质量分数(以大麦苗质量为1)分别设置为 3.3%、5.3%、6.7%、8.0%、10.0%,分别发酵9、12 h和15 h,考察不同蔗糖添加质量分数对麦苗酵素SOD活力的影响[16]。
2 结果与讨论
2.1 酵母菌发酵工艺优化
2.1.1发酵温度的确定发酵温度为27℃时,麦苗酵素SOD及CAT活力最低,随着温度升高,SOD及CAT活力随之增高,但当发酵温度超过32℃时,麦苗酵素SOD及CAT活力反而随之降低如图1所示。分析得出32℃为酵母菌发酵生产麦苗酵素的适宜温度。故实验发酵温度确定为32℃。
2.1.2酵母接种体积分数的确定在3个发酵时长的条件下,当酵母接种体积分数小于0.67%时,麦苗酵素活力都随接种体积分数增加而增高;当酵母接种体积分数大于0.67%时,麦苗酵素SOD活力随接种体积分数增加而降低;而麦苗酵素SOD活力均在酵母接种体积分数为0.67%时达到最高;3个发酵时长相比,12 h时SOD活力最高如图2所示。分析认为当酵母接种体积分数超过0.67%时,种内斗争加剧而导致酵母菌代谢减弱,从而导致SOD酶活力下降。
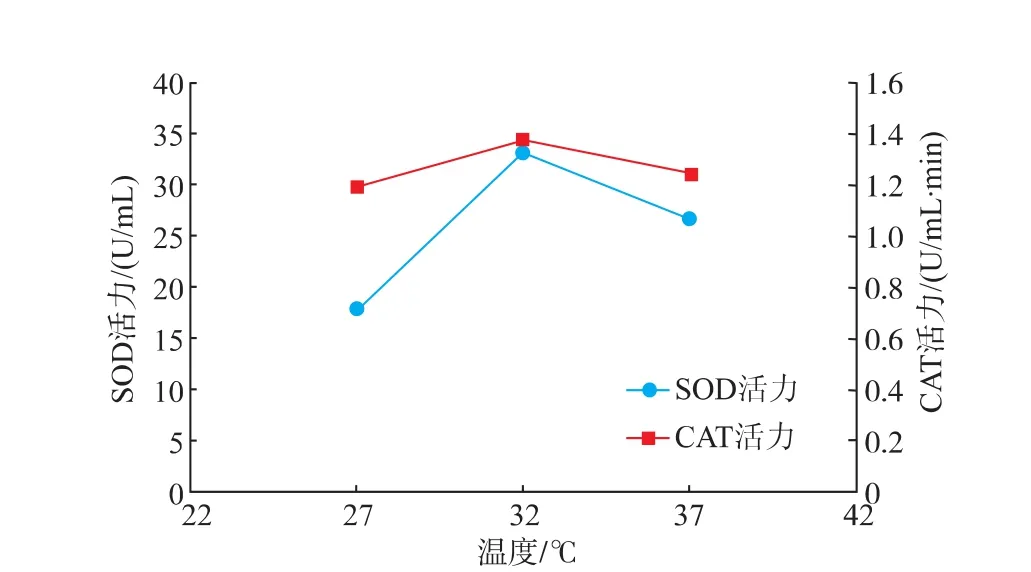
图1 发酵温度对麦苗酵素SOD及CAT活力的影响Fig.1 Effect of fermentation temperature on the activityof SOD and CAT in Barley ferment
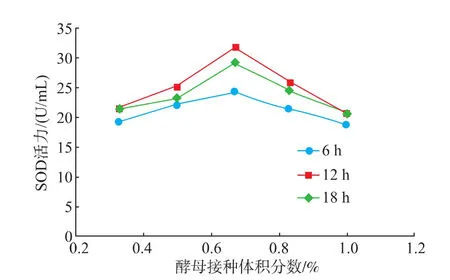
图2 酵母接种体积分数对麦苗酵素SOD活力的影响Fig.2 Effect of yeast inoculation quantity on the activity of SOD in Barley ferment
2.1.3发酵时间的确定在3种蔗糖(碳源)添加质量分数的条件下,随着发酵时间的增加,麦苗酵素SOD活力均逐渐增加,在12 h之后略有下降,而在12 h时活力达到最大;蔗糖添加质量分数为5.3%时麦苗酵素SOD活力最高。根据图3所示,可以将最佳发酵时间设定为12 h。
2.1.4蔗糖添加质量分数的确定在3个发酵时长的条件下,当蔗糖添加质量分数小于5.3%时,随着蔗糖添加质量分数的增加,麦苗酵素SOD活力均逐渐增加,在5.3%~6.7%之间保持相对稳定,之后随蔗糖添加质量分数增加而下降。分析认为当蔗糖添加质量分数超过6.7%时,酵素液的渗透压超过了酵母菌的渗透压,细胞失水导致酶活下降。根据图4所示,综合成本考虑,将蔗糖添加体积分数设为5.3%。
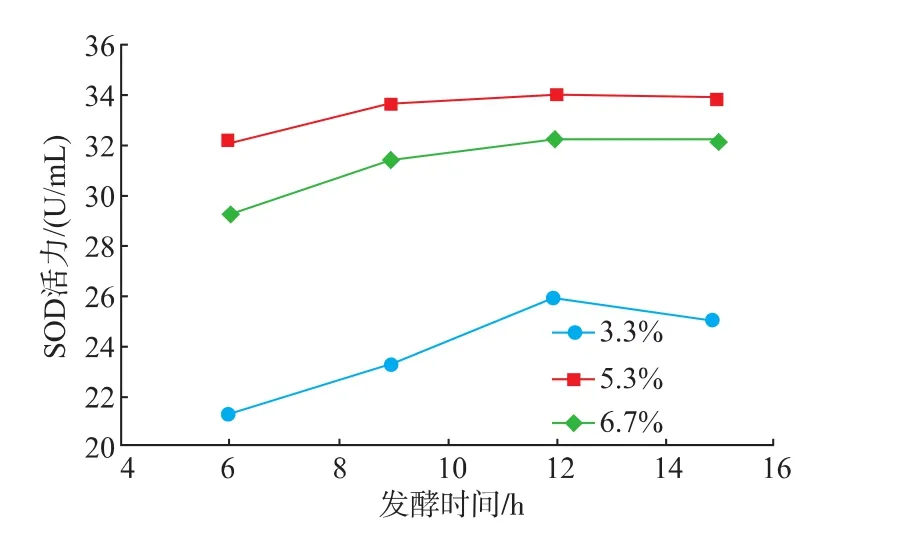
图3 发酵时间对麦苗酵素SOD活力的影响Fig.3 Effect of fermentation time on the activity of SOD in Barley ferment
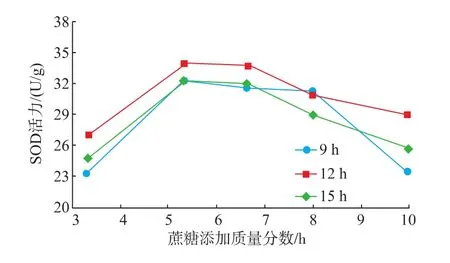
图4 蔗糖添加质量分数对麦苗酵素SOD活力的影响Fig.4 Effect of sucrose added on the activity of SOD in Barley ferment
2.1.5最终发酵工艺的确定根据以上实验数据及分析,确定酵母菌发酵生产麦苗酵素的最佳工艺条件为:发酵温度32℃,酵母接种体积分数0.67%,发酵时间12 h以及蔗糖添加质量分数5.3%。在此工艺条件下,测得麦苗酵素的SOD活力为(34.05±0.41)U/mL,实验所用大麦苗匀浆液的SOD活力为(13.16±0.51)U/mL,向其中加入灭活酵母后其活力为(19.76±0.76) U/mL,相对于原料,酵母菌发酵麦苗酵素的活力分别提高了158.74%和72.32%,这意味着其营养价值得到了很大提升。
2.2 麦苗酵素抗氧化性能的初步研究
为了研究制得的麦苗酵素的抗氧化功能,除活力外,还对其CAT活力、总酚质量浓度以及羟基自由基清除率等抗氧化指标做了测定。
2.2.1麦苗酵素CAT活力CAT可促使H2O2分解,使细胞免受H2O2的毒害,是生物防御体系的关键酶之一,也是麦苗酵素中一种重要的功效酶。对制得的麦苗酵素的CAT活力进行了测定,同时测定了实验所用大麦苗匀浆液和添加了灭活酵母菌的大麦苗匀浆液作为对照。结果如表1。
从表1可以看出,制得的麦苗酵素的CAT活力比对照组A的CAT活力提高了98.71%,比对照组B的提高了67.75%。这表明通过酵母菌发酵,实验制得的麦苗酵素的CAT活力既超过了实验所用大麦苗匀浆液的CAT活力,也超过了实验所用酵母菌(发酵前)与大麦苗匀浆液的CAT活力之和,发酵对于CAT酶活提高显著。

表1 麦苗酵素CAT活力对比Table 1 Comparation of CAT Activity in barley ferment
2.2.2麦苗酵素总酚质量浓度多酚是在植物性食物中发现的具有潜在促进健康作用的化合物,其抗氧化功能可以对氧化损伤造成的慢性病起到预防作用,是麦苗酵素中的一种生物活性物质。对制得的麦苗酵素的总酚质量浓度进行了测定,同时测定了实验所用大麦苗匀浆液和添加了灭活酵母菌的大麦苗匀浆液作为对照。结果如表2。
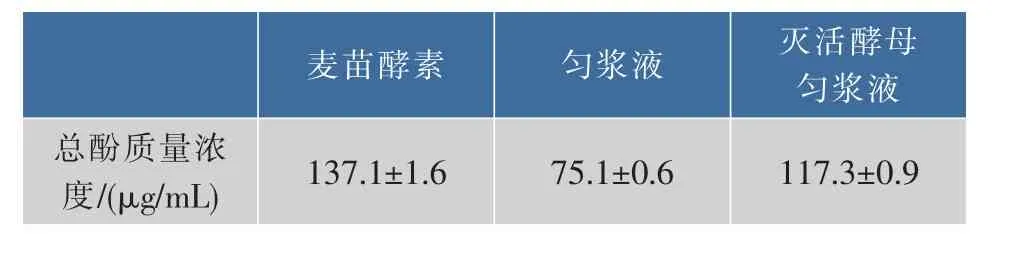
表2 麦苗酵素总酚质量浓度对比Table 2 Comparation of Total Phenol Content in barley ferment
从表2可以看出,制得的麦苗酵素的总酚质量浓度比对照组A的总酚质量浓度提高了82.57%,比对照组B的提高了16.88%。这表明通过酵母菌发酵,实验制得的麦苗酵素的总酚质量浓度既超过了实验所用大麦苗匀浆液的总酚质量浓度,也超过了实验所用酵母菌(发酵前)与大麦苗匀浆液的总酚质量浓度之和,发酵对于总酚质量浓度提高显著。
2.2.3麦苗酵素羟基自由基清除率羟基自由基(·OH)是一种重要的活性氧,从分子式上看是由氢氧根(OH-)失去一个电子形成,具有极强的氧化能力,是自然界中仅次于氟的氧化剂。羟基自由基清除率是反映物质抗氧化性能的一个重要指标。为研究麦苗酵素的抗氧化性能,对麦苗酵素的这项指标进行了测定,同时还测定了未加酵母菌且未灭菌的大麦苗匀浆液和添加了灭活酵母菌的大麦苗匀浆液作为对照。结果如表3。
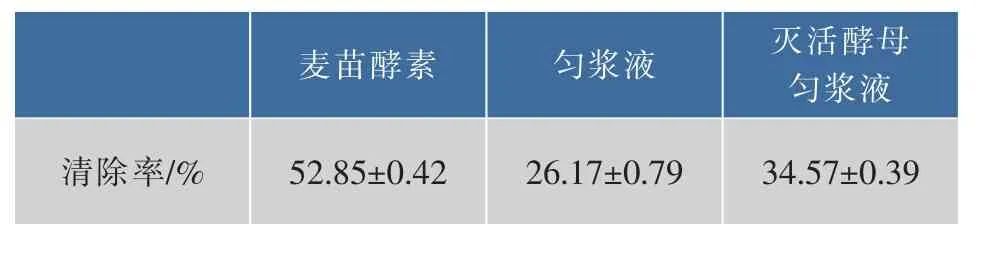
表3 麦苗酵素羟基自由基清除率对比Table 3 Comparation of Hydroxyl radical scavenged of barley ferment
从上表可以看出,制得的麦苗酵素的羟基自由基清除率比对照组A的羟基自由基清除率提高了101.95%,比对照组B的提高了52.88%;且这一清除率水平达到了天然大麦酵素羟基自由基清除率的最高水平[17];阳性对照的结果表明,该麦苗酵素的羟基自由基清楚能力介于8.0~9.0 mg/mL的抗坏血酸之间(分别为(48.27±0.35)%和(58.56±0.82)%)。这表明通过酵母菌发酵,实验制得的麦苗酵素的羟基自由基清除率既超过了实验所用大麦苗匀浆液的清除率,也超过了实验所用酵母菌(发酵前)与大麦苗匀浆液的清除率,发酵后的麦苗酵素羟基自由基清除率提高显著。
3 结 语
本文作者以大麦幼苗为原料,采用酵母菌进行发酵,得到了麦苗酵素产品。通过实验研究得到一条大麦苗发酵生产麦苗酵素的工艺,确定了发酵工艺参数为:发酵温度32℃,酵母接种体积分数0.67%,蔗糖添加质量分数5.3%,发酵12 h。此外,还对该产品的抗氧化功能进行了初步研究,其结果表明该产品的抗氧化功能较好,且较原料有了很大提升。本研究结果可为大麦的多功能开发利用以及酵素产品的研发和生产工艺的改进提供一定的支持。
参考文献:
[1]夏岩石.大麦生物活性成分的遗传分析及应用研究[D].广州:华南理工大学,2012.
[2]李时珍.金陵本本草纲目新校正[M].上海:上海科学技术出版社,2008.
[3]CHEN Fumin.Talking about ferment and enzyme[J].Chemical Enterprise Management,2014(34):70-73.(in Chinese)
[4]MAO Jianwei,WU Yuanfeng,FANG Sheng.Research Process of microbial enzyme[J].Bulletin of Fermentation Science and Technology,2010(3):42-44.(in Chinese)
[5]LU M,TOSHIMA Y,WU X L,et al.Inhibitory effects of vegetable and fruit ferment liquid on tumor growth in Hepatoma-22 inoculation model[J].Asia Pacific Journal of Clinical Nutrition,2007,16 suppl 1(3):443-446.
[6]REVILLA E,SANTA-MAR A C,MIRAMONTES E,et al.Antiproliferative and immunoactivatory ability of an enzymatic extract from rice bran[J].Food Chemistry,2013,136(2):526-531.
[7]董洁.从金丝小枣枣泥中制备金丝小枣酵素工艺的研究[D].济南:齐鲁工业大学,2014.
[8]YUAN Qinsheng,CUI Yumin,ZHANG Bingran.Study on the stability and absorption of superoxide dismutase peros in rats[J].Pharmaceutical Boteehnology,1994,1(1):24-29.(in Chinese)
[9]HE Huajun,SHI Huijuan,YUAN Qinsheng.Studies on oral delivery of exogenous bovine Cu·Zn-SOD absorption by rat erythrocytes[J].Pharmaceutical Boteehnology,1999,6(3):159-163.(in Chinese)
[10]DONG Liang,HE Yongzhi,WANG Yuanliang,et al.Research progress on application of superoxide dismutase (SOD) [J].Journal of Agricultural Science and Technology,2013,15(5):53-58.(in Chinese)
[11]JIA Lili,JI Li,SUN Shuguang,et al.Study on biological property and antioxidant activity of winter-jujube ferment during fermentation process[J].Food and Fermentation Technology,2014(4):30-33.(in Chinese)
[12]李合生.植物生理生化实验原理和技术[M].高等教育出版社,2000.
[13]中华全国供销合作总社杭州茶叶研究院.茶叶中茶多酚和儿茶素类含量的检测方法[M].国家质检总局,2008.
[14]LU Jian,FAN Wei,KONG Weibao,et al.Study on the extraction of total polyphenol in barley (Hordeum vulgare L.) and its ability on scavenging DPPH free radical[J].Journal of Food Science and Biotechnology,2008(1):57-61.(in Chinese)
[15]JIANG Zengliang,MAO Jianwei,HUANG Jun,et al.Changes in antioxidant activity of blueberry-ferment during natural fermentation process[J].Science and Technology of Food Industry,2013,34(2):194-197.(in Chinese)
[16]DONG Jie,XIA Minmin,WANG Chengzhong,et al.Study on the fermentation techniques of golen silk jujube paste leaven[J].Science and Technology of Food Industry,2014,35(2):197-200+5.(in Chinese)
[17]GUO Yanping,ZHAO Jinan.Preliminary study on antioxidant properties of barley-ferment during spontaneous fermentation process[J].Shanxi Chemical Industry,2014(4):4-6.(in Chinese)

