花椒毒酚对重症急性胰腺炎大鼠脑损伤保护作用及NF-κB/iNOS通路的影响
汤建军,李恒平,韩小乐,林晶晶
0 引言
重症急性胰腺炎(Severe acute pancreatitis,SAP)是临床常见的急性病症,是由多种病因所致的胰腺局部炎症反应,且多伴有其他器官的功能改变,其发病急且病情较为凶险,对患者生命健康造成严重威胁[1]。胰性脑病是SAP常见的并发症,患者主要表现为意识模糊、出现幻觉等精神异常症状,并发胰性脑病的SAP患者其病死率可达67%~100%,成为目前SAP临床研究关注的重点方向[2-3]。核因子-KappaB(Nuclear factor-κB,NF-κB)是目前已知的与SAP密切相关的细胞因子,且参与脑损伤的病理进程,在机体炎症相关基因转录调控中发挥重要作用[4]。本研究采用5%牛黄胆酸钠(2 mL/kg)逆行注入大鼠胰胆管建立SAP模型,拟通过观察花椒毒酚腹腔给药后大鼠脑组织损伤程度、NF-κB及其下游因子一氧化氮合酶(Inducible nitric oxide synthase,iNOS)的表达情况,探讨花椒毒酚对SAP大鼠脑损伤的保护作用及其作用机制。
1 实验材料
1.1 实验动物 雄性Wistar大鼠64只,SPF级,体重(270±20)g,鼠龄6~7周,购自河南省实验动物中心[合格证号:SCXK(豫)2013-0001],所有大鼠购回后均在本项目组动物饲养室进行3 d适应性喂养。
1.2 主要试剂 牛黄胆酸钠购自美国Sigma公司;戊巴比妥钠购自上海生化试剂公司;血浆淀粉酶检测试剂盒购自北京雷根生物技术有限公司;大鼠血清NO、NF-κB p65 ELISA检测试剂盒购自上海生工生物工程有限公司;兔抗鼠NF-κB p65、iNOS、GADPH一抗及兔抗鼠IgM二抗均购自美国Abcam公司。
1.3 主要仪器 普通天平购自上海医疗仪器总厂;TE214S型分析天平购自德国Sartorius公司;Microfuge R型离心机购自美国Beckman公司;CARY 60紫外分光光度计购自美国Agilent公司;Multiskan FC型酶标仪购自美国Thermo Scientific公司;双垂直电泳仪和电转膜仪购自北京六一仪器厂;全自动凝胶成像分析系统购自美国Bio-Rad公司。
2 实验方法
2.1 动物模型建立及分组 采用随机Z字形分组法将大鼠随机分为正常对照组(假手术组)、模型组、花椒毒酚低剂量组(5 mg/kg)、花椒毒酚高剂量组(10 mg/kg),每组又分为3 h组和12 h组2个亚组,共8组,每组8只大鼠。造模前禁食12 h,禁水4 h,采用25 g/L戊巴比妥钠(1.2 mg/kg)腹腔注射进行麻醉,将大鼠固定于手术台上,对腹部进行常规消毒后进行开腹,找出胰腺和胆胰管,从胆胰管十二指肠的开口处进4号针并逆行穿刺至胰腺,在胰腺被膜下以0.1 mL/min的速度均匀注入5%牛黄胆酸钠(2 mL/kg),注射完成后采用夹子夹住胰管30 min后去除,一次缝合腹壁。假手术组开腹后仅做翻动胰腺操作,不进行任何注射。
2.2 给药 所有大鼠进行腹壁缝合关腹后立即置入笼子中进行保暖(将白炽灯悬挂于笼子上进行加温)等待麻醉苏醒,正常对照组和模型组均在造模完成后立即给予25% DMSO的生理盐水腹腔注射(10 mL/kg),花椒毒酚低、高剂量组分别给予预先采用DMSO溶解并用生理盐水稀释至浓度为0.50、1.00 mg/mL(DMSO终浓度为25%)的花椒毒酚腹腔注射(10 mL/kg)。
2.3 血清学指标检测 于术后3、12 h,采用1.5%戊巴比妥钠对大鼠进行麻醉后,抽取腹主动脉血2 mL置于EDTA抗凝管中,3 000 r/min离心15 min,取上清进行分装后,置于-80 ℃冰箱中待测。血浆淀粉酶的检测采用碘-淀粉比色法;血浆NO、NF-κB p65 ELISA的检测采用双抗夹心ELISA法。
2.4 胰腺组织HE染色 大鼠麻醉处死后,取胰腺组织,切取部分组织快速置于10%多聚甲醛中固定24 h,进行常规制片、HE染色,并在显微镜下观察采用Schmidt评分法对胰腺组织进行评分,根据水肿、炎症、坏死程度各分为5级,得分为0~4分,出血得分为0~1分,总分为13分,得分越高说明胰腺组织损伤越严重。
2.5 脑组织相关指标检测 ①HE染色:脑组织HE病理检查方法参考胰腺组织,评分方法参考文献[5],根据神经元细胞、脑血管、胶质细胞及髓鞘4项进行评分,每项0~4分,共12分,得分越高说明脑组织损伤越严重。②神经功能评分:采用Longa评分法对大鼠神经功能进行评分[6],0分:正常,1分:提尾巴时,右前肢无法正常伸展,2分:向右侧轻度旋转,3分:向右颠倒,4分:昏迷或不能自发行走,5分:因脑损伤造成的死亡。③脑组织含水量测定:采用干-湿重法在分析天平上对原始重量进行称量即为湿重,在80 ℃条件下干燥24 h后对其进行再次称量即为干重,组织含水量=(湿重-干重)/湿重×100%。④脑组织NF-κB、iNOS蛋白水平检测:采用Western blot法进行检测,首先采用RIPA蛋白裂解法提取脑组织中的总蛋白,采用BCA法检测蛋白浓度,并调至一致后,上样进行SDS-PAGE电泳,将蛋白电转移至NC膜上,采用脱脂奶粉封闭2 h,加入预先按一定比例稀释好的一抗(NF-κB p65、iNOS、GADPH),4 ℃孵育过夜,采用TBST洗膜3次后,加入按一定比例稀释的IgG兔抗鼠二抗,室温孵育2 h,ECL显色,采用全自动凝胶成像仪进行图像采集,并使用Image J软件对条带进行灰度分析,各组均以目的蛋白表达量与GADPH的比值作为目的蛋白相对表达量进行比较。

3 结果
3.1 花椒毒酚对胰腺组织病理变化的影响 模型组大鼠术后3、12 h胰腺组织病理评分明显高于对照组(P<0.05);花椒毒酚低高剂量组胰腺组织病理评分较模型组明显降低(P<0.05),其中高剂量组明显低于低剂量组(P<0.05),但仍明显高于对照组(P<0.05)。见表1、图1。
3.2 花椒毒酚对脑组织病理变化的影响 模型组大鼠术后3、12 h脑组织病理评分明显高于对照组(P<0.05);花椒毒酚低、高剂量组脑组织病理评分较模型组明显降低(P<0.05),其中高剂量组明显低于低剂量组(P<0.05),但仍明显高于对照组(P<0.05)。见表2、图2。
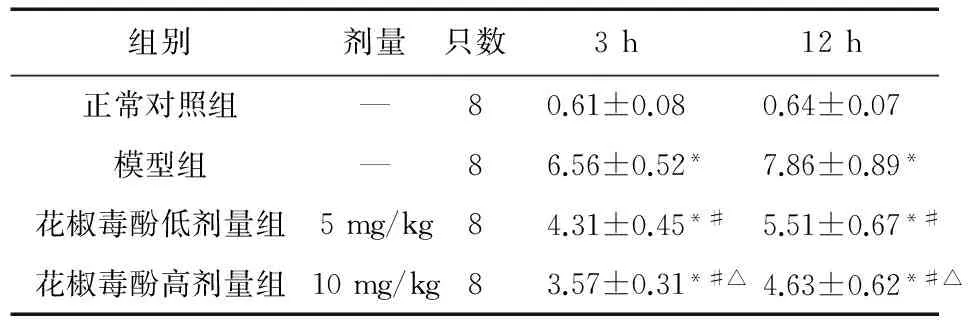
表1 各组大鼠胰腺组织评分比较(分)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量组比较,△P<0.05
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量组比较,△P<0.05
3.3 花椒毒酚对脑损伤相关指标(含水量、神经功能评分)的影响 模型组大鼠术后3、12 h脑组织含水量和神经功能评分明显高于对照组(P<0.05);花椒毒酚低、高剂量组脑组织含水量和神经功能较模型组明显降低(P<0.05),其中高剂量组脑组织含水量和神经功能评分明显低于低剂量组(P<0.05)。见表3。
3.4 花椒毒酚对血浆淀粉酶、NO、NF-κB p65的影响 模型组大鼠术后3、12 h血浆淀粉酶、NO、NF-κB p65均较对照组明显升高(P<0.05);花椒毒酚低、高剂量组血浆淀粉酶、NO、NF-κB p65水平均较模型组明显下降(P<0.05),且高剂量组各指标下降幅度均高于低剂量组(P<0.05)。见图3。

图1 术后12 h各组胰腺组织病理改变(200×)

图2 术后12 h各组脑组织病理改变(200×)
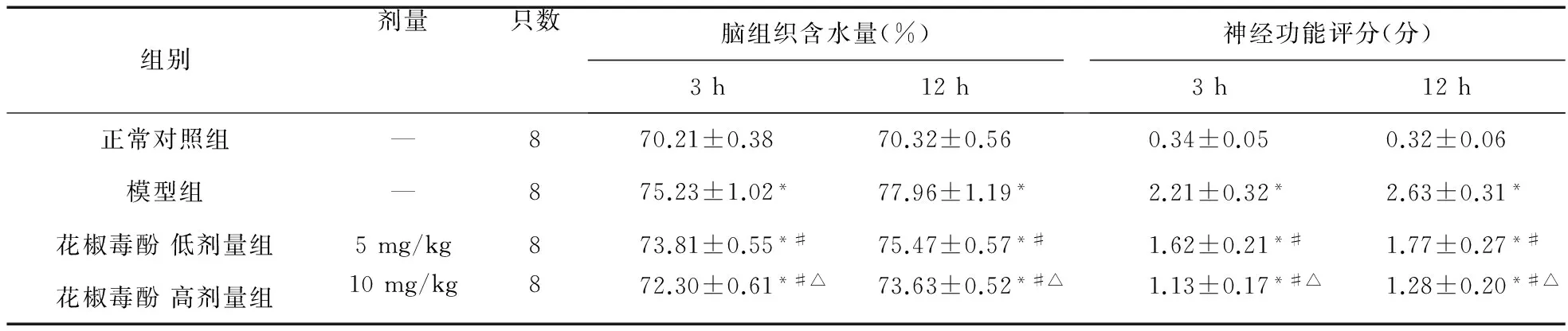
组别剂量只数脑组织含水量(%)3h12h神经功能评分(分)3h12h正常对照组—870.21±0.3870.32±0.560.34±0.050.32±0.06模型组—875.23±1.02*77.96±1.19*2.21±0.32*2.63±0.31*花椒毒酚低剂量组5mg/kg873.81±0.55*#75.47±0.57*#1.62±0.21*#1.77±0.27*#花椒毒酚高剂量组10mg/kg872.30±0.61*#△73.63±0.52*#△1.13±0.17*#△1.28±0.20*#△
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量组比较,△P<0.05
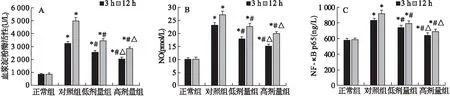
图3 各组大鼠血浆淀粉酶、NO、NF-κB p65水平比较
3.5 花椒毒酚对脑组织NF-κB、iNOS蛋白水平的影响 各组模型组大鼠术后3、12 h脑组织NF-κB、iNOS相对表达量均明显高于对照组(P<0.05);花椒毒酚低、高剂量组大鼠脑组织NF-κB、iNOS相对表达量均较模型组明显下降(P<0.05),其中高剂量组大鼠脑组织NF-κB、iNOS相对表达量明显低于低剂量组(P<0.05)。见图4。
4 讨论
目前,有关SAP所致脑损伤的具体机制尚未阐明,初步研究认为胰腺损伤后会导致机体淋巴细胞、巨噬细胞等活化,合成释放一系列炎性因子和细胞因子,进而对其他脏器造成继发损伤[7]。NF-κB是一种在真核细胞中广泛存在的核转录因子,属于早期转录因子,在机体发生应激反应时无需新的蛋白翻译即可进行调控,其在正常生理状态下以二聚体的形式与抑制因子IκB结合处于静息状态,激活后IκB磷酸化降解,NF-κB可进入核内与DNA上启动子区域对应位点结合,调控下游相关基因转录[8]。近年来大量研究表明,NF-κB在SAP疾病进展中发挥重要作用,能够诱导TNF-α、IL-6、IL-1β等炎性因子的高度表达,参与机体炎症反应的放大,进而使SAP从局部炎性病变发展为全身多器官炎症反应,加重胰腺组织及胰腺外脏器的病理损伤[9]。袁伟燕等[10]研究显示,NF-κB在SAP大鼠脑组织中的活性较其他组织高,除调控炎症反应外,与神经元细胞的增殖凋亡亦具有密切关系,能够通过刺激IL-1β、TNF-α等的表达促进神经元凋亡,加重脑损伤。黄良珍等[11]研究显示,NF-κB在颅脑损伤大鼠脑组织中的含量明显高于对照组,在损伤1 h后即开始升高,且其变化趋势与颅脑损伤的临床表现具有较强的一致性。本研究结果显示,SAP大鼠血清及脑组织中NF-κB的表达量明显高于正常对照组,且随着时间延长,损伤程度逐渐加重,与上述结果一致,证明NF-κB参与SAP恶性循环且与脑损伤存在密切联系。

图4 各组大鼠脑组织NF-κB p65、iNOS水平比较
NO是一种存在于中枢神经细胞的神经递质,具有维持长时程增强脑部记忆功能的作用,但其过表达时会介导毒性机制,通过炎症级联反应、氧化应激等促进神经元凋亡坏死[12]。iNOS是NO合成的限速酶,正常状态下,iNOS无表达或低表达,但在病理状态下,iNOS作为NF-κB的下游靶基因,可被激活,进而在机体内大量合成,导致胞浆中NO含量升高,进而产生大量自由基,对细胞产生毒性作用[13]。目前,在脑损伤中针对NF-κB/iNOS通路的研究较多,但多集中于脑缺血再灌注所致脑损伤,而对SAP继发脑损伤的研究较少[14]。方晓艳等[15]研究表明,脑缺血再灌注损伤大鼠神经元胞浆、胞核中均存在NF-κB的阳性表达,且iNOS活力和NO水平均明显升高,介导脑组织神经损伤和神经细胞的凋亡。洪焕茂等[16]研究表明,高压氧预处理能够通过抑制NF-κB的活化,降低iNOS的基因转录,减少局灶性脑缺血的炎症反应,诱发相关保护机制。本研究初次对SAP大鼠脑损伤模型进行探讨,结果显示,大鼠血浆NF-κB和NO水平均明显升高,脑组织中NF-κB、iNOS的蛋白表达亦明显升高,证明SAP能够以脑组织中NF-κB的活化参与脑损伤病理过程。
花椒毒酚是一种从伞形科植物蛇床子及白芷中提取出的线型呋喃香豆素,相关药理学研究表明,花椒毒酚具有抗肿瘤、抗炎、抗菌、抗心律失常等多种生物学活性[17]。但目前针对花椒毒酚的药理研究相对薄弱,且其发挥活性的具体机制尚待阐明,何蔚等[18]研究表明,花椒毒酚能够通过抑制脑血管内皮细胞中黏附因子(ICAM-1)的表达,减弱中性粒细胞黏附穿透血管内皮,抑制脑组织炎症反应,进而改善大鼠脑缺血后再灌注的神经功能评分,减小梗死面积,初步提出花椒毒酚对脑损伤具有一定保护作用。本研究对SAP大鼠术后急性花椒毒酚腹腔给药,结果显示,花椒毒酚干预组大鼠胰腺组织和脑组织病变程度均较模型组有不同程度减轻,脑组织水肿程度和神经功能评分亦有明显改善,与何蔚等[19]研究观点一致;同时观察到花椒毒酚能够下调大鼠脑组织中NF-κB、iNOS的表达,血清中NF-κB、NO水平亦明显降低,其中高剂量组对各指标的下调作用较低剂量组明显,说明花椒毒素对SAP大鼠所致脑损伤亦具有保护作用。
综上所述,花椒毒酚能够减缓SAP大鼠胰腺组织和脑组织病理进程,明显改善脑组织水肿及神经功能评分,其机制可能是通过抑制NF-κB的活化,进而减少iNOS的合成,降低NO对神经元细胞的毒性损伤,具体调控机制尚待进一步研究。
参考文献:
[1] Dua MM,Worhunsky DJ,Tran TB,et al.Severe acute pancreatitis in the community:confusion reigns[J].J Surg Res,2015,199(1):44-50.
[2] 刘源,李涛,党胜春,等.氯膦酸二钠脂质体对重症急性胰腺炎大鼠脑损伤的保护作用[J].江苏大学学报(医学版),2016,26(3):219-222,226.
[3] Patel K,Trivedi RN,Durgampudi C,et al.Lipolysis of visceral adipocyte triglyceride by pancreatic lipases converts mild acute pancreatitis to severe pancreatitis independent of necrosis and inflammation[J].Am J Pathol,2015,185(3):808-819.
[4] 赵靖,郑驰,刘曦,等.NF-κB与重症急性胰腺炎[J].西南军医,2013,15(3):271-274.
[5] 王小红,胡江鸿,沈云志.醒脑静联合乌司他丁对重症急性胰腺炎大鼠脑损伤的保护作用[J].天津医药,2013,41(4):349-352,后插2.
[6] 王荣亮,刘小蒙,张营,等.大鼠局灶性脑缺血后神经功能评分与脑梗死体积相关性分析[J].首都医科大学学报,2013,34(1):69-74.
[7] 杨元生,尹彪,陈垦,等.胰性脑病大鼠血脑屏障通透性改变的机制研究[J].齐齐哈尔医学院学报,2015,36(25):3747-3749.
[8] Piao X,Liu B,Guo L,et al.Picroside II shows protective functions for severe acute pancreatitis in rats by preventing NF-κB-dependent autophagy[J].Oxid Med Cell Longev,2017,2017:7085709.
[9] 王娜娜,刘庆民.TNF-α、IL-6、NF-κB及其抑制剂与急性胰腺炎研究进展[J].中华消化病与影像杂志(电子版),2015,5(5):253-255.
[10]袁伟燕,黄中伟,陈卫昌,等.还原型谷胱甘肽对重症急性胰腺炎大鼠脑损伤的作用及其机制探讨[J].南京医科大学学报(自然科学版),2016,36(3):298-301.
[11]黄良珍,陈宝智,皱文辉,等.大鼠颅脑损伤中肿瘤坏死因子-α及核转录因子-κB的变化及其意义[J].武汉大学学报(医学版),2017,38(1):15-19,69.
[12]谢承伟,张亚楠,李润平.腺苷和一氧化氮在中枢神经系统相互作用及与癫痫相关性[J].现代生物医学进展,2017,17(15):2996-3000.
[13]Simon PS,Sharman SK,Lu C,et al.The NF-κB p65 and p50 homodimer cooperate with IRF8 to activate iNOS transcription[J].BMC Cancer,2015,15:770.
[14]何蔚,周钰梅,陈伟伟,等.欧前胡素对大鼠脑缺血再灌注损伤后炎症反应的影响[J].中国药理学与毒理学杂志,2014,28(4):662-663.
[15]方晓艳,左艇,王灿,等.凌霄花总黄酮对脑缺血再灌注损伤大鼠NF-κB/iNOS-COX-2信号通路的影响[J].中华中医药杂志,2016,31(8):3321-3324.
[16]洪焕茂,虞容豪.高压氧预处理对局灶性脑缺血再灌注损伤大鼠脑组织NF-κB及下游靶基因iNOS的影响[J].广东医学,2015,36(8):1157-1160.
[17]伍冠一,李慧,黄尚尚,等.花椒毒酚生物活性与药理作用[J].中华中医药学刊,2017,35(1):62-64.
[18]何蔚,陈伟伟,叶和杨,等.花椒毒酚抑制大鼠局灶性脑缺血/再灌注损伤后中性粒细胞浸润和脑水肿[J].中国药理学通报,2009,25(5):668-672.

