耕作方式与绿肥种植对土壤微生物组成和多样性的影响
李丽娜,席运官,陈 鄂,和丽萍,王 磊,肖兴基,田 伟①
(1.云南省环境科学研究院,云南 昆明 650034;2.环境保护部南京环境科学研究所,江苏 南京 210042;3.甘肃省环境监测中心站,甘肃 兰州 730020)
过去十几年,土壤质量退化和农业环境污染问题日益加剧[1]。有机农业作为一种提高土壤肥力、控制农业面源污染、增加食品安全性的有效方式,在世界范围内得到了广泛认可。然而,我国的有机生产过程仍存在有机肥过量施用的状况。近年来,一些研究表明,连续施用有机肥,尤其是以畜禽粪便为主要来源的有机肥,可能引起土壤重金属累积、磷素淋溶风险增加、土壤微生物多样性下降等环境风险[2-4]。
免耕与绿肥种植被认为是改善土壤肥力的重要措施。多年的研究表明,长期免耕或绿肥翻压可以改善土壤团粒结构,增加土壤有机碳和氮含量,促进土壤难溶物质转化等[5-7];同时,土壤理化性质的改变能够在一定程度上影响土壤微生物数量、活性和群落结构[8]。MDER等通过长达10 a的定位试验发现免耕或者少耕能够显著增加表层(0~10 cm)土壤微生物数量和微生物活性[9],SUN等[10]认为免耕增加了土壤细菌含量,促进了真菌类微生物对土壤有机质的降解,而对土壤放线菌没有任何影响。高嵩涓等[11]以种植31 a双季稻-冬绿肥的红壤性水稻土为研究对象,发现豆科绿肥紫云英对土壤微生物生物量碳、氮的提高作用最显著。因此,在有机农业生产过程中免耕与绿肥技术可以与有机肥配合使用以培肥土壤,降低有机肥施用量,减少连续过量施用有机肥引起的环境风险。
然而,以往研究人员更多关注耕作方式的差异或者绿肥种类对土壤微生物生物量、土壤酶活性或土壤微生物呼吸作用的影响[5-11],关于同时采用免耕和绿肥种植技术对土壤微生物群落结构影响的研究则鲜有报道。笔者假设同时采用免耕和绿肥种植技术较使用单一技术更能够有效增加微生物数量,改善微生物区系特征,并通过开展田间试验的方式进行验证,以期为有机农业生产过程中土壤质量的改善提供技术指导。
1 材料与方法
1.1 试验地点
田间试验在江苏省仪征市江扬农业生态有限公司四庄基地展开。试验样地土壤基本理化性质如下:pH值为6.20,w(有机质)为9.02 g·kg-1,w(全氮)为0.36 g·kg-1,w(全磷)为0.17 g·kg-1,w(速效磷)为24.32 mg·kg-1,w(全钾)为0.72 mg·kg-1,w(速效钾)为73.27 mg·kg-1,土壤容重为1.30 g·cm-3。仪征市位于江苏省中部,长江下游沿岸,地理位置为北纬32°14′~32°36′,东经119°02′~119°22′,属于北亚热带沿江季风气候区,光能资源丰富,雨量较充沛,年均降水量为1 015 mm,年均日照时数为2 226.5 h,年均气温为15 ℃。
1.2 试验处理设置
以有机农业习惯施肥和耕作方式常规耕作+施用有机肥(CC)为参照,设计免耕+不种绿肥(ZT)、免耕+种植绿肥(ZG)、常规耕作+不种绿肥(CT)和常规耕作+种植绿肥(CG)4个处理,每个处理设置3个重复,共15个小区,小区规格为4 m×5 m,采用豆科绿肥/玉米的轮作方式。2013—2014年度种植绿肥作物为绿豆,2014—2015和2015—2016年度种植绿肥作物为箭舌豌豆。绿豆种植时间为2014年4月中旬,采收时间为2014年5月中旬,两季豌豆种植时间为每年的10月中旬,采收时间为第2年4月中旬。玉米种植时间为每年的5月上旬,收获时间为每年的9月下旬,品种为苏玉19,行株距为50 cm×40 cm,每个小区种植玉米100株。
对于ZG处理采用镰刀将绿肥齐地刈割,称重,点种玉米后覆于作物表面;对于CG处理同样用镰刀将绿肥齐地刈割,称重,然后人工翻压至土壤约20 cm深处,翻压2周后点种玉米;对于CC处理按照15.0 t·hm-2施用量撒施牛粪有机肥于土壤表面,采用与CG处理相同的方式翻压,翻压2周后点种玉米,玉米长至3~5叶期进行人工定苗。在玉米生长过程中,完全按有机农业方式进行管理,实施人工除草,施用喷洒生物源、植物源和矿物源农药进行病虫害防治。除CC处理外,其余4个处理均未施用外源有机肥或化学肥料。
1.3 样品采集与分析
1.3.1 样品采集
第3季玉米收获后进行土壤样品采集。在小区内随机选择3个样点,用采样器采集0~20 cm的土体土壤样品,均匀混合后保存于-80 ℃冰箱。
1.3.2 土壤DNA提取
土壤DNA提取采用PowerSoil DNA提取试剂盒(Mo Bio Laboratories Inc.,Carlsbad,CA,USA),提取详细步骤见试剂盒说明书(http:∥www.anbiosci.com/protocols/12888.pdf)。每个样品提取3个重复,每个重复由3份DNA混合而成。DNA质量由NanoDrop ND-1000分光光度计(NanoDrop,ND2000,ThermoScientific,111 Wilmington,DE)测定260/280和260/230 nm处比值确定。
1.3.3 土壤微生物拷贝数分析
采用荧光定量聚合酶链式反应(PCR)方法对各处理土壤中细菌、真菌和放线菌的拷贝数进行定量。引物341F(5′-TACGGGAGGCAGCAG-3′)和534R用于细菌16S rRNA基因V3区扩增,引物517F(5′-CCAGCAGCCGCGGTAAT-3′)和Act704R(5′-TCTGCGCATTTCACCGCTAC-3′)用于放线菌16S rRNA基因V3区扩增[12],具体反应体系和反应条件参照TIAN等[13]的描述。真菌定量扩增采用引物5.8s(5′-CGCTGCGTTCTTCATCG-3′)和ITS1f(5′-TCCGTAGGTGAACCTGCGG-3′),具体反应体系和反应条件参照沈宗专等[14]的描述。
1.3.4 土壤细菌多样性测定
采用引物515F(5′-GTGCCAGCMGCCGCGG-3′)和907R(5′-CCGTCAATTCMTTTRAGTTT-3′),针对样品细菌16S rDNA的V4~V5区进行PCR扩增。委托上海美吉诺生物科技有限公司采用Illumina Miseq测序平台上机测序。扩增体系、反应条件和数据处理方法参见SUN等[15]的描述。
1.4 统计与分析
采用Excel 2007进行统计并用SPSS 21.0(IBM SPSS Statistical 21,SPSS Inc. Chicago,Illinois)进行方差分析和显著性水平检验(P<0.05)。高通量数据的生物信息学分析采用Qiime(Quantitative Insights into Microbial Ecology)软件(Version 1.8.0)进行。根据序列的相似度,将序列归为多个操作分类单元(operational taxonomic unit,OTU),统计各个样品含有OTU情况及每个OTU含有序列的数量,通过寻找最近亲缘物种的方法,得到每个OTU的分类学信息[16]。采用Mothur软件(Version 1.27.1)计算丰富度指数Chao1、ACE,覆盖度(Coverage)及多样性指数(Simpson指数和Shannon指数)。用于土壤微生物与土壤理化性质相关性分析的土壤理化指标数据来源于文献[17]。
2 结果与分析
2.1 耕作方式与绿肥种植对土壤微生物基因拷贝数的影响
采用荧光定量PCR方法对不同处理土壤中细菌、真菌和放线菌的拷贝数进行分析的结果(表1)显示,ZG处理细菌、真菌和放线菌的拷贝数分别为6.03×108、2.40×105和1.21×107,显著高于ZT和CT处理,但显著低于CC处理;ZG处理细菌拷贝数/真菌拷贝数比值为2.51×103,尽管与CG和CC处理差异不显著,但显著高于ZT和CT处理。
2.2 耕作方式与绿肥种植对土壤细菌多样性的影响
5个处理15个土壤样品共获得203 090条优质序列,以优质序列条数最少的样品为基准,每个样品随机选择12 206条优质序列进行分析(表2)。不同处理的覆盖度(Coverage)在0.967~0.987之间,差异并不显著;不同处理OTU数在1 899~1 987之间,也没有显著差异;另外,耕作方式的差异与是否种植绿肥也未对土壤细菌的丰富度(ACE指数和Chao 1指数)和多样性(Shannon指数和Simpson指数)产生显著影响。

表1 不同处理土壤微生物基因拷贝数差异 Table 1 Number of gene copies of soil microbes relative to treatment
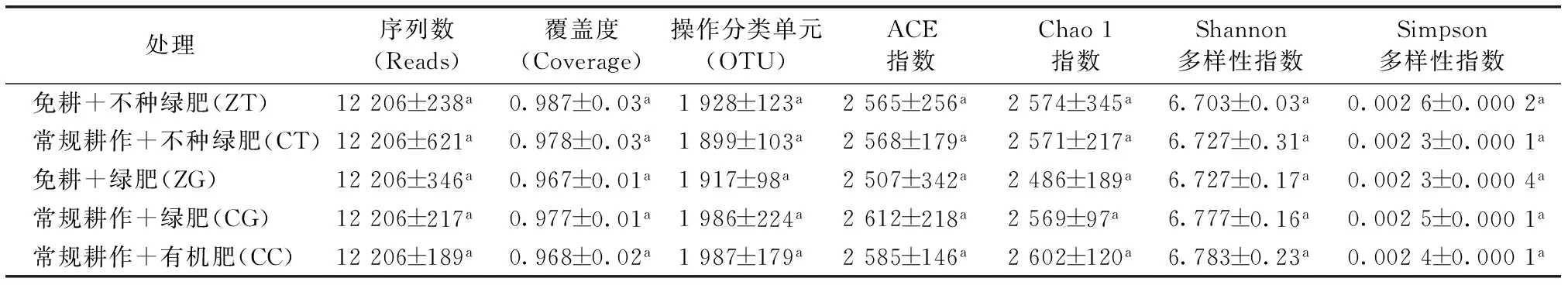
表2 不同处理土壤样品覆盖度、丰富度指数和多样性指数差异 Table 2 Comparison between treatments in estimated richness and diversity indices of the 16S rRNA gene libraries for clustering at 97% identity
2.3 耕作方式与绿肥种植对土壤门水平细菌相对含量的影响
不同处理土壤微生物在门水平的组成见图1。图1显示,82.88%~86.22%的序列可归入变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和浮霉菌门(Planctomycetes),而8.58%~10.70%的序列可归入装甲菌门(Armatimonadetes)、蓝细菌门(Cyanobacteria)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、硝化螺旋菌门(Nitrospirae)和疣微菌门(Verrucomicrobia),另外,2.55%~6.67%的序列为相对含量较少和不能归入已知门类的微生物。不同处理之间微生物门水平的组成没有明显差异,但耕作方式和绿肥种植可影响不同门类微生物的相对含量。
总体来看,耕作方式的差异对土壤微生物的组成影响并不显著。例如,ZT处理优势微生物变形菌门、绿弯菌门和酸杆菌门的相对含量分别为29.01%、19.54%和11.53%,而CT处理则分别为29.37%、18.08%和11.39%,统计分析显示并无显著差异(P<0.05)。ZT和CT处理绿弯菌门的相对含量分别为19.54%和18.08%,放线菌门的相对含量分别为9.18%和10.49%,均显著高于其他3个处理,而各处理之间酸杆菌门并无显著差异。
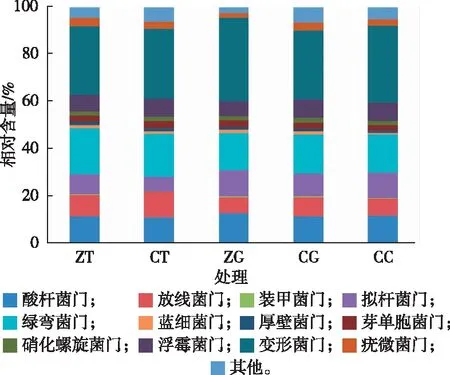
ZT—免耕+不种绿肥;CT—常规耕作+不种绿肥;ZG—免耕+绿肥;CG—常规耕作+绿肥;CC—常规耕作+有机肥。
ZG处理微生物的组成与CG处理之间明显不同。例如,ZG处理变形菌门的相对含量为34.98%,显著高于CG处理(29.13%),而CG处理疣微菌门的相对含量为3.19%,显著高于ZG处理(2.08%)。另外,CG、ZG和CC处理拟杆菌门微生物的相对含量均在一定程度上有所增加,而种植绿肥有利于蓝细菌门和硝化螺旋菌门的生长。
2.4 不同处理基于加权的UniFrac分析
各处理基于加权的UniFrac分析结果(图2)显示,5个处理形成了5个不同的聚类簇,表明5个处理均在一定程度上影响土壤微生物的组成,而同一个处理的3个不同重复聚集在同一个聚类簇,验证了该试验操作的可重复性和试验结果的可靠性。
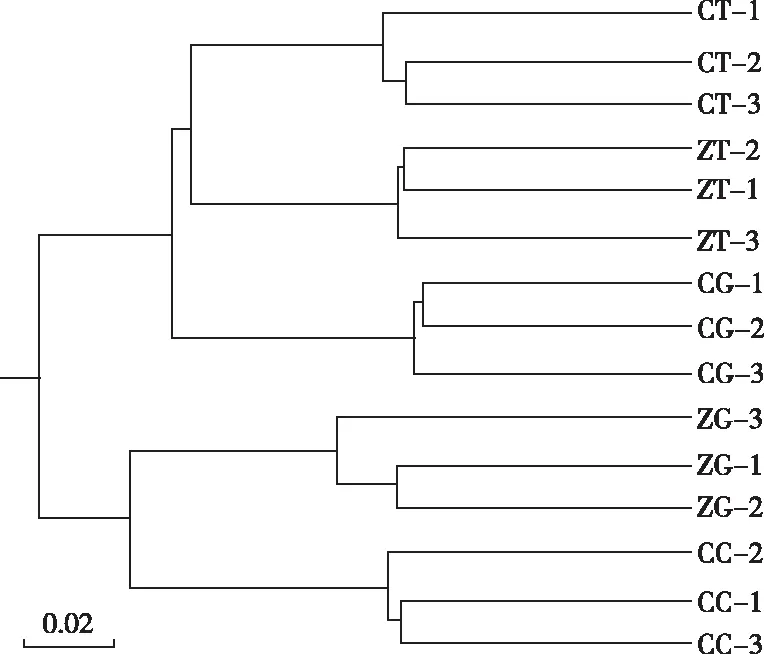
ZT—免耕+不种绿肥;CT—常规耕作+不种绿肥;ZG—免耕+绿肥;CG—常规耕作+绿肥;CC—常规耕作+有机肥。
2.5 土壤微生物与土壤理化性质的相关性分析
如表3所示,总体上看,大部分微生物类群与土壤容重、土壤pH值、有机质含量和全氮含量等理化指标均呈现或正或负的相关性,说明土壤理化性质的差异是影响土壤微生物组成的重要因素。只有放线菌门与任一理化指标间均无显著相关性。
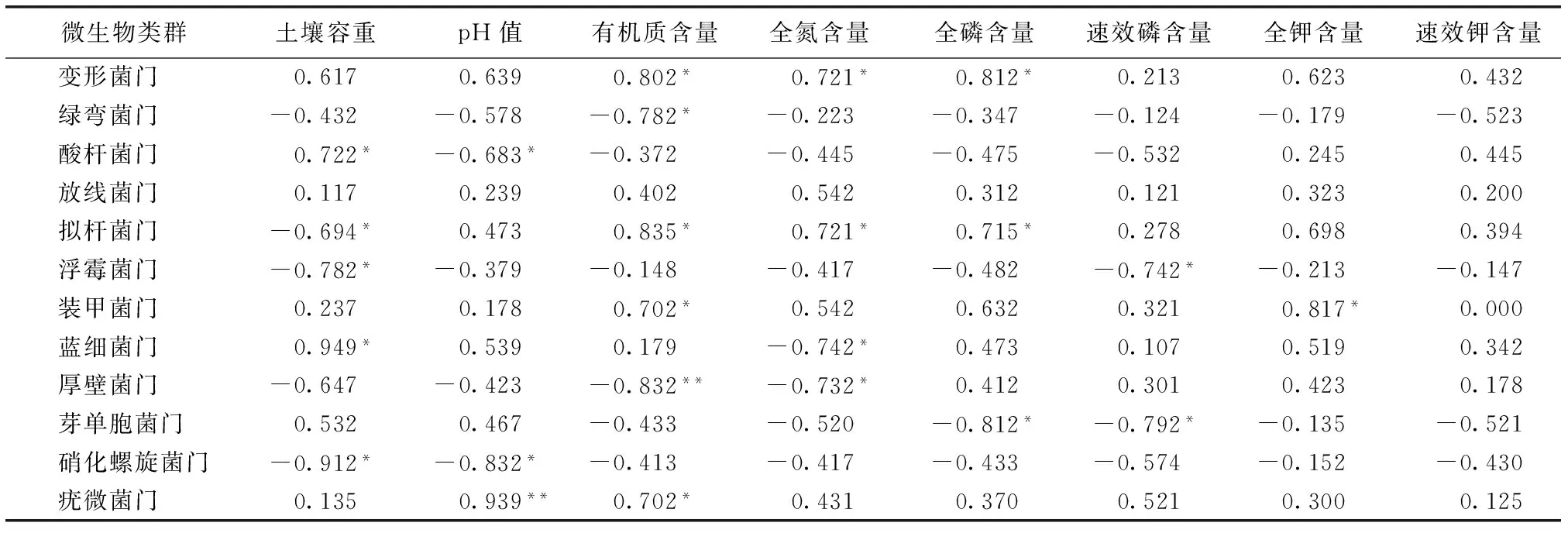
表3 土壤理化性质与主要微生物类群的相关系数 Table 3 Correlation analysis between abundances of main microbial groups and soil properties
变形菌门与土壤有机质含量、全氮含量和全磷含量均呈显著正相关,拟杆菌门与土壤有机质含量、全氮含量和全磷含量均呈显著正相关,同时与土壤容重呈显著负相关。而绿弯菌门和厚壁菌门与土壤有机质含量呈显著或极显著负相关。与氮素循环相关的微生物蓝细菌门和硝化螺旋菌门分别与土壤全氮含量和pH值呈显著负相关。另外,pH值仅与酸杆菌门、硝化螺旋菌门和疣微菌门呈显著或极显著相关性。
3 讨论
3.1 耕作方式和绿肥种植与土壤微生物多样性
土壤细菌丰富度和多样性是土壤生态功能的重要指标[18]。群落多样性和丰富度变化会影响土壤功能。WEI等[19]报道土壤微生物多样性越丰富,农作物抵御病虫害的能力就越强,反之则越弱。笔者试验发现,3 a的耕作方式和绿肥种植及有机肥施用对各处理的细菌丰富度和多样性均没有显著影响,这可能与该试验的周期较短有关。研究表明土壤微生物对环境的改变有一定的抵抗和恢复能力,尤其是土壤群落丰富度和多样性水平的变化,需要经过一定的周期[20]。INNEREBNER等[21]发现,有机肥并不能改变土壤微生物多样性,而POULSEN等[22]甚至认为是土壤的类型和颗粒组成而不是施用何种类型肥料决定了土壤微生物的多样性和丰富度。
KUNTZ等[23]通过磷脂脂肪酸分析(PLFA)技术分析了耕作方式对有机农场细菌、真菌和原生动物的影响,结果表明耕作方式只是在种的水平上改变了上述3种土壤生物的绝对数量,而对多样性没有显著影响;ELFSTRAND等[24]同样采用PLFA技术研究了绿肥种植对土壤微生物结构的影响,发现土壤细菌和真菌的数量较未添加有机物处理显著增加,且PLFA图谱表明,土壤微生物组成较其他有机物处理有明显不同,但是并未对不同处理微生物多样性的差异是否显著进行评估。近年来采用高通量技术研究耕作方式和绿肥种植对土壤微生物组成和多样性影响的报道相对较少。
3.2 耕作方式和绿肥种植与土壤微生物组成
近年来,随着测序技术的不断发展,由耕作方式或绿肥种植引起的土壤微生物群落结构的演变逐渐引起重视。TODA等[25]通过9 a的定位试验发现豆科绿肥毛苕子能够显著增加土壤中酸杆菌门、芽单胞菌门和变形菌门的相对含量;YIN等[26]比较了小麦生产系统耕作方式对土体与根际土壤微生物组成的影响,发现免耕增加了根际土壤中变形菌门的相对含量,也增加了土体土壤中酸杆菌门和芽单胞菌门的相对含量。
笔者3 a的定位试验表明,对于不种植绿肥的处理(ZT和CT),其绿弯菌门和放线菌门的相对含量明显高于其他3个处理。尽管绿弯菌门是土壤中的优势种群,但是由于大部分不可培养,因此,对此类微生物功能的了解非常有限[27]。但一些前期研究表明,绿弯菌门的微生物,例如Gp6、Gp16和Gp4等与土壤中有机碳含量呈显著负相关[28],这可能是该试验中不种植绿肥处理绿弯菌门相对含量较高的原因。同样,放线菌门在营养物质更丰富的土壤中较其他微生物类群更缺乏竞争力[29]。
ZG处理变形菌门相对含量明显高于CG处理,可能是由于绿肥的覆盖能够为此类微生物提供更好的生存环境。更深入的研究发现,α-变形菌、β-变形菌、γ-变形菌和δ-变形菌4个亚门的微生物在2个处理中均有发现,但ZG处理除对δ-变形菌没有影响外,其他3个亚门均有一定增加,这与以前的研究结果有一定的相似性。ROUSK等[30]发现α-变形菌和γ-变形菌亚门与土壤pH值呈正相关,笔者经过3 a的定位试验发现ZG处理土壤pH值与CG处理有明显差异[17]。而对于β-变形菌亚门,丰富的营养物质更有利于此类微生物的生长。绿肥的翻压、覆盖或有机肥的添加均有利于拟杆菌门的生长,此与ZHAO等[29]的研究结果一致,此类微生物与有机物质的降解密切相关。可能是由于土壤氮素的缺乏和绿肥分泌物的激发,绿肥种植处理促进了蓝细菌门和硝化螺旋菌门等与氮素循环相关微生物类群的生长。
3.3 土壤微生物组成与土壤理化性质的相关性
研究表明,相同的土壤经过长期不同施肥管理后会形成不同的土壤理化性质,不同的土壤理化性质能够引起细菌群落结构的变化[31]。GRIFFITHS等[32]通过将砂壤和黏土灭菌后交换接种2种土壤菌悬液的试验,证明在细菌群落演变过程中是土壤类型而不是接种物决定最终的群落结构,笔者试验的研究结论与其有一定的一致性。笔者通过试验发现大部分微生物类群与土壤理化指标均呈或正或负的相关性。前期研究认为,土壤pH值是决定土壤中细菌组成的重要因素,但是,笔者试验中并未发现其在决定土壤微生物组成上与土壤有机质含量、全氮含量和全磷含量等指标有明显差异,因为pH值也仅与酸杆菌门、硝化螺旋菌门和疣微菌门具有显著或极显著相关性。ROUSK等[30]同样认为土壤pH值与其他理化指标共同作用决定土壤微生物的组成。
变形菌门相对含量与土壤有机质含量、全氮含量和全磷含量均呈显著正相关,这也在一定程度上解释了ZG和CC处理此类微生物明显高于其他处理的原因。FIERER等[33]同样发现变形菌门微生物与土壤有机质含量呈显著正相关。许多研究表明,绿弯菌门相对含量随着土壤pH值的降低而增加,笔者同样发现此类微生物与土壤pH值之间呈负相关。绿弯菌门和厚壁菌门与土壤有机质含量呈显著或极显著负相关,说明此类微生物在营养物质相对丰富的土壤环境中缺乏竞争力。ZHAO等[29]同样发现放线菌门相对含量与土壤任一理化指标间均无显著相关性,笔者试验研究的结论与其一致。总体来说,土壤结构、土壤营养物质含量和土壤pH值均在一定程度上决定了土壤微生物的组成。因此,采取合理的土壤培肥措施维持土壤肥力和改善土壤结构是促进农业可持续发展的关键因素。
4 结论
3 a的定位试验表明,不同处理细菌相对含量及组成产生了一定变化,但土壤细菌群落多样性和丰富度差异不显著。相关性分析表明土壤结构、土壤营养物质含量与土壤pH值均在一定程度上决定了土壤微生物的组成。
参考文献:
[1] GE T,NIE S A,WU J S H,etal.Chemical Properties,Microbial Biomass,and Activity Differ Between Soils of Organic and Conventional Horticultural Systems Under Greenhouse and Open Field Management:A Case Study[J].Journal of Soils and Sediments,2011,11(1):25-36.
[2] TIAN W,ZHANG Z H,HU X F,etal.Short-Term Changes in Total Heavy Metal Concentration and Bacterial Community Composition After Replicated and Heavy Application of Pig Manure-Based Compost in an Organic Vegetable Production System[J].Biology and Fertility of Soils,2015,51(5):593-603.
[3] TIAN W,WANG L,LI Y,etal.Responses of Microbial Activity,Abundance,and Community in Wheat Soil After Three Years of Heavy Fertilization With Manure-Based Compost and Inorganic Nitrogen[J].Agriculture,Ecosystems & Environment,2015,213:219-227.
[4] 田伟,李刚,陈秋会,等.等氮条件下化学肥料与有机肥连续大量施用下的环境风险[J].生态与农村环境学报,2017,33(5):440-445.[TIAN Wei,LI Gang,CHEN Qiu-hui,etal.Environmental Risk Caused by Successive and Heavy Application of Mineral Fertilizer and Compost After the Same Amount of Nitrogen Applied[J].Journal of Ecology and Rural Environment,2017,33(5):440-445.]
[5] JU X T,KOU C L,CHRISTIE P,etal.Changes in the Soil Environment From Excessive Application of Fertilizers and Manures to Two Contrasting Intensive Cropping Systems on the North China Plain[J].Environmental Pollution,2007,145:497-506.
[6] BIEDERBECKA V O,ZENTNERA R P,CAMPBELL C A.Soil Microbial Populations and Activities as Influenced by Legume Green Fallow in a Semiarid Climate[J].Soil Biology and Biochemistry,2005,37(10):1775-1784.
[7] ASTIER M,MAASS J M,ETCHEVER-BARRA J D,etal.Short-Term Green Manure and Tillage Management Effects on Maize Yield and Soil Quality in an Andisol[J].Soil and Tillage Research,2006,88(1/2):153-159.
[8] 臧逸飞,郝明德,张丽琼,等.26 年长期施肥对土壤微生物量碳、氮及土壤呼吸的影响研究[J].生 态 学 报,2015,35(5):1445-1451.[ZANG Yi-fei,HAO Ming-de,ZHANG Li-qiong,etal.Effects of Wheat Cultivation and Fertilization on Soil Microbial Biomass Carbon,Soil Microbial Biomass Nitrogen and Soil Basal Respiration in 26 Years[J].Acta Ecologica Sinica,2015,35(5):1445-1451.]
[9] MADWE P,BERNER A.Development of Reduced Tillage Systems in Organic Farming in Europe[J].Renewable Agriculture and Food Systems,2012,27(1):7-11.
[10]SUN B H,HALLETT P D,CAUL S,etal.Distribution of Soil Carbon and Microbial Biomass in Arable Soils Under Different Tillage Regimes[J].Plant and Soil,2011,338(1/2):17-25.
[11]高嵩涓,曹卫东,白金顺.长期冬种绿肥改变红壤稻田土壤微生物生物量特性[J].土 壤 学 报,2015,52(4):902-910.[GAO Song-juan,CAO Wei-dong,BAI Jin-shun,etal.Long-Term Application of Winter Green Manures Changed the Soil Microbial Biomass Properties in Red Paddy Soil[J].Acta Pedologica Sinica,2015,52(4):902-910.]
[12]CHAKRAVORTY S,HELB D,BURDAY M,etal.A Detailed Analysis of 16S Ribosomal RNA Gene Segments for the Diagnosis of Pathogenic Bacteria[J].Journal of Microbiological Methods,2007,69(2):330-339.
[13]TIAN W,ZHANG Z,LIU D Y,etal.An Optimized DNA Extraction and Purification Method From Dairy Manure Compost for Genetic Diversity Analysis[J].World Journal of Microbiology and Biotechnology,2013,29(5):815-823.
[14]沈宗专,钟书堂,赵建树,等.氨水熏蒸对高发枯萎病蕉园土壤微生物区系及发病率的影响[J].生态学报,2015,35(9):2946-2953.[SHEN Zhong-zhuan,ZHONG Shu-tang,ZHAO Jian-shu,etal.Effects of Ammonia Fumigation on Soil Microflora and Banana Production in an Orchard With Serious Fusarium Wilt Disease[J].Acta Ecologica Sinica,2015,35(9):2946-2953.]
[15]SUN J,ZHANG Q,ZHOU J,etal.Pyrosequencing Technology Reveals the Impact of Different Manure Doses on the Bacterial Community in Apple Rhizosphere Soil[J].Applied Soil Ecology,2014,78:28-36.
[16]丁传雨,郑远,任学敏,等.能源植物修复土壤镉污染过程中细菌群落分析[J].环境科学学报,2016,36(8):3009-3016.[DING Chuan-yu,ZHENG Yuan,REN Xue-ming,etal.Changes in Bacterial Community Composition During the Remediation of Cd-Contaminated Soils of Bioenergy Crops[J].Acta Scientiae Circumstantiae,2016,36(8):3009-3016.]
[17]田伟,胡金霞,李刚,等.耕作方式与绿肥种植对玉米产量和土壤质量的影响[J].江苏农业学报,2017(6):1272-1277.[TIAN Wei,HU Jin-xia,LI Gang,etal.Effects of Tillage Management and Green Manure on Maize Yield and Soil Quality[J].Jiangsu Journal of Agricultural Sciences,2017(6):1272-1277.]
[18]NANNIPIERI P,ASCHER J,CECCHERINI M T,etal.Microbial Diversity and Soil Functions[J].European Journal of Soil Science,2003,54(4):655-670.
[19]WEI Z,YANG T J,FRIMAN V P,etal.Trophic Network Architecture of Root-Associated Bacterial Communities Determines Pathogen Invasion and Plant Health[J].Nature Communications,2015,6:8413.
[20]GRIFFITHS B S,PHILIPPOT L.Insights Into the Resistance and Resilience of the Soil Microbial Community[J].FEMS Microbiology Reviews,2013,37(2):112-129.
[21]INNEREBNER G,KNAPP B,VASARA T,etal.Traceability of Ammonia-Oxidizing Bacteria in Compost-Treated Soils[J].Soil Biology and Biochemistry,2006,38(5):1092-1100.
[22]POULSEN P H B,AI-SOUND W A,BERGMARK L,etal.Effects of Fertilization With Urban and Agricultural Organic Wastes in a Field Trial-Prokaryotic Diversity Investigated by Pyrosequencing[J].Soil Biology and Biochemistry,2013,57:784-793.
[23]KUNTZ M,BERNER A,GATTINGER A,etal.Influence of Reduced Tillage on Earthworm and Microbial Communities Under Organic Arable Farming[J].Pedobiologia,2013,56(4/5/6):251-260.
[24]ELFSTRAND S,HEDLUND K,MARTENSSON A.Soil Enzyme Activities,Microbial Community Composition and Function After 47 Years of Continuous Green Manuring[J].Applied Soil Ecology,2007,35(3):610-621.
[25]TODA M,UCHIDA Y.Long-Term Use of Green Manure Legume and Chemical Fertiliser Affect Soil Bacterial Community Structures but Not the Rate of Soil Nitrate Decrease When Excess Carbon and Nitrogen Are Applied[J].Soil Research,2017,55(6):524-533.
[26]YIN C T,MUETH N,HULBERT S.Bacterial Communities on Wheat Grown Under Long-Term Conventional Tillage and No-Till in the Pacific Northwest of the United States[J].Phytobiomes Journal,2017,1:83-90.
[27]YAMADA T,SEKIGUCHI Y.Cultivation of Uncultured Chloroflexi Subphyla:Significance and Ecophysiology of Formerly Uncultured Chloroflexi ‘Subphylum I’ With Natural and Biotechnological Relevance[J].Microbes and Environments,2009,24(3):205-216.
[28]JONES R T,ROBESON M S,LAUBER C L,etal.A Comprehensive Survey of Soil Acidobacterial Diversity Using Pyrosequencing and Clone Library Analyses[J].The ISME Journal,2009,3:442-453.
[29]ZHAO J,ZHANG R F,XUE C,etal.Pyrosequencing Reveals Contrasting Soil Bacterial Diversity and Community Structure of Two Main Winter Wheat Cropping Systems in China[J].Microbial Ecology,2014,67(2):443-453.
[30]ROUSK J,BAATH E,BROOKES P C,etal.Soil Bacterial and Fungal Communities Across a pH Gradient in an Arable Soil[J].The ISME Journal,2010,4:1340-1351.
[31]WERTZ S,DEGRANGE V,PROSSER J I,etal.Decline of Soil Microbial Diversity Does Not Influence the Resistance and Resilience of Key Soil Microbial Functional Groups Following a Model Disturbance[J].Environmental Microbiology,2007,9(9):2211-2219.
[32]GRIFFITHS B S,HALLETT P D,KUAN H L,etal.Functional Resilience of Soil Microbial Communities Depends on Both Soil Structure and Microbial Community Composition[J].Biology and Fertility of Soils,2008,44(5):745-754.
[33]FIERER N,BRADFORD M A,JACKSON R B,etal.Toward an Ecological Classification of Soil Bacteria[J].Ecology,2007,88(6):1354-1364.

