肺癌患者术前血清维生素D水平与免疫功能及术后合并肺炎发生率的相关性研究
王维杰 张光辉 励新健 胡文涛 谢小利
术后肺炎是最为常见的医院获得性感染,仅次于手术部位感染和尿道感染。由于其较高的发病率,病原菌常存在耐药菌乃至混合病原体感染,使得治疗的难度明显增加,同时延长了患者的住院天数。而且其致死率明显高于外科术后的其他合并症[1]。肺癌是我国高发的恶性肿瘤,其发病率位居所有男性恶性肿瘤的第一位;手术是肺癌的重要治疗手段之一,术后合并肺炎也是手术最为常见的并发症之一,发生率约占所有合并症的10%,发生时间通常为术后3d左右[2],术后肺炎同样是术后引发呼吸衰竭的常见诱因[3]。维生素D可诱导呼吸道上皮细胞产生的炎症因子提高自身免疫反应,有效地控制炎症[4]。维生素D不足或缺乏还会导致呼吸道上皮变性、角化、增生最终使抵抗力明显降低[5]。以往对维生素D与肺炎的研究主要集中在儿童、老年人相关肺炎,肺癌术后患者术后肺炎高发,其是否与维生素D水平及其免疫调节作用相关,目前仍无相关研究,本研究将弥补此空白。
1 临床资料
1.1 一般资料 选择2015年4月至2017年4月内收集于本院准备接受肺癌根治术的早期肺癌(TNM58.45±5.43Ⅰ/Ⅱ期)患者共365例,采用串联质谱法检测血清总维生素D水平、维生素D2及维生素D3水平,根据总维生素D水平将患者分为4组:维生素D严重缺乏组105例(<10ng/ml)、维生素D缺乏组124例(10~20ng/ml),维生素D不足组78例(20~30ng/ml)及维生素D充足组58例(≥30ng/ml),维生素缺乏比例高达62.57%。纳入标准:(1)肺癌确诊,于全身麻醉(简称全麻)下接受肺叶切除。(2)术前未发现严重基础性疾病,心、肝、肾、脑等脏器无明显异常。(3)术前未接受过抗癌治疗,术前30min常规给予二代抗生素(头孢替安)2g作为预防性用药。(4)术后住院期间临床确诊为合并肺炎。排除标准:(1)术前确诊合并高血压、糖尿病等基础疾病及存在关键器官功能受损。(2)术前已接受放化疗者。
1.2 血清维生素D检测 于术前3d抽取观察对象3ml血清,采用Applied Biosystems公司高效液相色谱串联质谱(HPLC-MS/MS)仪,检测血清中的维生素D2、维生素D3及其总维生素D的水平。与检测方法相比具有灵敏度高、特异性强等特点,并能对血清样品中微量的25OHD2和25OHD3分别进行定量分析,从而明确缺乏的原因。
1.3 T淋巴细胞亚群检测 于术前3d采用特制试管,添加患者抗凝全血100μl后分别加入CD4FITC /CD8PE、CD25-PE/CD4-FITC及CD3PerCP试剂及阴性对照单克隆抗体20μl,避光室温放置30min后加入溶血剂2.0ml,10min后1500r/min离心5min,去上清液,加入PBS 0.5ml,贝克曼库尔特流式细胞仪 Gallios及流式细胞技术(Flow Cytometry,FCM)分析并获取信息。
1.4 肺炎诊断 参照卫生部颁发的《医院感染诊断标准》符合以下条件即可确诊:(1)术前未检查出肺炎证据,手术结束24h后开始发病。(2)存在咳痰、咳嗽、发热等症状和(或)肺部啰音,胸部X线或CT下提示肺实质浸润性改变。(3)存在至少一个以下情况:气管吸出物、咳脓痰或血培养检出病原菌[6]。
1.5 统计学方法 采用SPSS 19.0统计软件。计量资料以(±s)表示,组内比较选择one way anova检验,组间比较采用t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组基线资料比较 见表1。
表1 各组基线资料比较(n)
2.2 各组维生素D水平比较 见表2。
表2 各组维生素D水平比较(±s)

表2 各组维生素D水平比较(±s)
注:与维生素D严重缺乏组比较,*P<0.05;与维生素D缺乏组比较,#P<0.05;与维生素D不足组比较,△P<0.05
组别 n 总维生素D 维生素D3 维生素D2维生素D严重缺乏组 105 6.57±2.62 5.87±1.49 3.65±1.39维生素D缺乏组 124 15.72±4.55* 10.37±4.4* 3.82±1.32维生素D不足组 78 28.34±8.43*# 22.80±8.47*# 3.62±1.10维生素D充足组 58 36.59±9.87*#△ 30.08±7.40*#△ 3.59±1.37 F值 388.01 260.96 2.46 P值 <0.01 <0.01 0.07
2.3 各组T淋巴细胞亚群比较 见表3。
表3 各组T淋巴细胞亚群比较[%,(±s)]
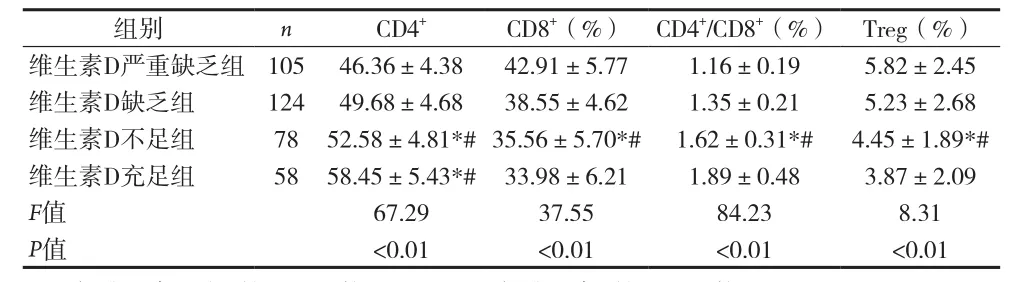
表3 各组T淋巴细胞亚群比较[%,(±s)]
注:与维生素D严重缺乏组比较,*P<0.05;与维生素D缺乏组比较,#P<0.05
组别 n CD4+ CD8+(%) CD4+/CD8+(%) Treg(%)维生素D严重缺乏组 105 46.36±4.38 42.91±5.77 1.16±0.19 5.82±2.45维生素D缺乏组 124 49.68±4.68 38.55±4.62 1.35±0.21 5.23±2.68维生素D不足组 78 52.58±4.81*#35.56±5.70*# 1.62±0.31*# 4.45±1.89*#维生素D充足组 58 58.45±5.43*# 33.98±6.21 1.89±0.48 3.87±2.09 F值 67.29 37.55 84.23 8.31 P值 <0.01 <0.01 <0.01 <0.01
2.4 各组肺炎发生率比较 见表4。

表4 各组肺炎发生率比较
3 讨论
手术至今仍是肺癌的主要治疗手段之一,然而手术所引发的并发症较多,常见的包括心律失常、肺部感染、支气管胸膜瘘、心功能不全、胸腔出血、呼吸功能衰竭以及脓胸等,以上并发症均严重威胁患者的生命并影响手术的疗效。术后合并肺炎是肺癌术后较常见的合并症,文献显示肺切除术后并发症的发生率可达52.9%,其中呼吸道并发症占34.3%,造成术后感染的原因包括吸烟和气道阻塞等。严重的肺部感染最终将导致呼吸功能衰竭等严重后果。肺癌术后合并肺炎影响患者恢复、延长住院天数、最终增加了医疗费用甚至危及生命。关于肺癌术后肺炎的发生率报道存在较大差异,从6.7%~34.3%不等[7],国内关于肺癌术后肺炎发生率的报道发生率较国外高。肺癌术后合并肺炎的患者深部痰培养高阳性率,但不同研究所报道的病原学分布具有一定的差异,有文献报道感染以革兰阴性菌为主,革兰阳性菌和真菌分别是第二和第三。前三的菌种分别为铜绿假单胞菌占35.9%、大肠埃希菌占18.0%和金黄色葡萄球菌占10.3%[8]。本研究经过2年的病例收集,最终肺癌术后合并肺炎的发生率为28.22%,与过去的研究报道接近。
体内血清维生素D的获取方式主要有两种,包括:(1)通过皮肤经受紫外线B的照射自行生成维生素D3,此渠道为人体获得维生素D主要途径。(2)部分是从食物中摄取但食物中含有的维生素D量对于个体而言是明显不够的。皮肤组织所生成的或已存在于血清中的维生素D可通过自分泌、内分泌以及旁分泌的形式,作用于维生素D受体(VDR),对人体各种不同的细胞和组织发挥正面的作用,与此同时VDR可接受细胞外刺激,引起细胞内的基因应答反应,由于各类免疫细胞中普遍存在,尤其是抗原提呈细胞(APCs),如巨噬细胞、单核细胞、树突状细胞等。维生素D激活巨噬细胞上的VDR,使其表达抗菌肽(Amps)(如抗菌肽cathelicidin和β防御素),抗菌肽位于所有多细胞生物的上皮和黏膜表面,这些因子对大多病原微生物的感染有着防御效应,同时带有抗菌活性,对病原生物及耐药、多重耐药病原菌具有较强的杀灭作用。另外抗菌肽还具有一定的免疫调节作用,维生素D可诱导Treg细胞初始化,Treg细胞在抗感染中起着双重效应;Treg细胞可抵抗病毒起到免疫保护功效,同时也控制了病毒感染后组织的损伤程度。总之,维生素D增强先天免疫系统作用,限制获得性免疫系统作用。所以,一个有效的免疫应答主要是依靠维生素D的内分泌系统,其在炎症与抗炎之间起到了平衡的作用。本研究发现维生素D水平越高CD4(%)和CD4/CD8(%)越低,而CD8(%)和Treg(%)越高,提示维生素D缺乏人群出现先天免疫及免疫功能混乱。术后住院合并肺炎的发生率也随术前维生素D水平的减少而增加,PTrend=0.0034。
综上所述,本研究发现血清维生素D水平与肺癌术后合并肺炎的发生率密切相关,通过结果推测,维生素D可能是通过免疫调节,使肺炎的发生率存在差异,本课题组将在后续的研究中尝试对患者进行术前干预,有望有效降低术后肺炎的发生。
[1] 王丽君,顾连兵,蒋大明,等.食管癌患者术后肺部感染围手术期的影响因素分析.中华医学杂志,2012,92(19):1310-1313.
[2] 韦尉东,温浙盛,苏晓东,等.899例非小细胞肺癌完全切除术后的多因素生存分析.Chinese Journal of Cancer, 2007,26(11):1231-1236.
[3] 王耿杰,马良赟,林勇龙,等.肺癌术后发生呼吸功能衰竭的高危因素分析及预防探讨.河北医学,2014,1:100-103.
[4] Leow L,Simpson T,Cursons R,et al.Vitamin D,innate immunity and outcomes in community acquired pneumonia.Respirology,2011,16(4):611.
[5] Pletz MW,Terkamp C,Schumacher U,et al.Vitamin D deficiency in community-acquired pneumonia: low levels of 1,25(OH)2 D are associated with disease severity.Respiratory Research,2014,15(1):53.
[6] 崔德健.术后肺炎及其防治.中华结核和呼吸杂志,2002,25(1):42-44.
[7] Veiga-Parga T, Sehrawat S, Rouse BT. Role of regulatory T cells during virus infection.Immunological Reviews, 2013,255(1):182-196.
[8] 周亚,封锡清,高杰,等.高龄肺癌患者肺切除手术的围术期处理.医学综述,2011,17(24):3818-3819.

