水稻土施硅对土壤-水稻系统中镉的降低效果
魏 晓, 张鹏博, 赵丹丹,Elena Bocharnikova, Vladimir Matichenkov, Demin Dmitry
1 湖南省经济地理研究所,长沙 410004 2 俄罗斯科学院土壤物理化学和生物研究所,俄罗斯普希诺 142290 3 俄罗斯科学院基础生物研究所,俄罗斯普希诺 142290
镉是毒性最强的重金属之一,农作物的抗镉能力比动物强,和动物相比,镉毒对人类影响尤甚,因为人类的寿命更长,通过食用含镉食物会在体内形成镉累积[1-2],比起其他常见的有毒物如砷、铅、汞或镍,镉具有更高的流动性,这意味着植物将从污染土壤中吸收更多的镉[3-4]。镉主要通过不同的人类活动如矿业、电池使用、油漆颜料、合金制备、以及其他活动产生的工业废料进入环境[5-6],其中磷矿开采和大气沉降被认为是最大的镉污染源[7]。据估计,耕地中发现的54%—58%的镉来源于矿质磷肥的施用,不幸的是,目前可用的磷矿石呈下降趋势,低级磷矿石的加工产生更多的镉等重金属。
研究发现,水稻吸收的镉大部分累积在根部,严重抑制根系生长,使根数减少[8],镉积累对水稻生长有直接或间接的危害,将改变许多生理功能[9- 10],镉会限制水稻种子的萌发和幼苗的生长,以及细胞中许多代谢过程的强度和方向[11],镉在一定程度上影响着稻米对有益微量元素的吸收和运输[12],受到镉污染的植物在发育中的非特性反应会加剧细胞的氧化,形成过量的活性氧化物[13],同时受到镉污染的植物的超氧化物歧化酶的活性和过氧化氢酶的活性也将显著降低[14]。在过去的几十年里,有过很多关于富硅物质能够减轻镉对植物生长不利影响的报道,硅可以减轻水稻的镉毒症状[15],降低植物叶片中镉的积累[16-17]。土壤中施用富硅物质能够增加对镉的吸附[18],加强镉在水稻幼苗根内皮层的积累,可以限制镉从幼苗根传送到芽,并将重金属大量沉积在内皮层细胞的细胞壁,从而阻断镉在质外体中的运输[19]。优化植物硅素可以增加抗氧化酶的活性,减轻植物的脂质过氧化作用和镉引起的氧化损伤。硅还能减轻镉的药害性,并显著降低镉在小白菜体内的吸收和从根到芽的传输,然而,这种缓解机理目前仍不清楚。
本研究的主要目的是研究固态和液态硅肥对土壤-作物系统中,硅和镉相互作用的影响机制。
1 材料和方法
1.1 供试材料
供试土壤土壤采自湘阴某段(112°43.514′E,28°38.449′N)长期耕作的农田,采集0—20cm耕作层土壤,经风干、粉碎、混匀后用于盆栽试验,基本理化特性见表1。水稻品种为湘晚籼12号(OryzasativaL.)。
在本次试验中,所需材料有(1)FS (Fumed Silica,煅制氧化硅,水溶性硅含量为(203±10)mg/kg,pH 7.1);(2)矿渣(娄底市某炼钢厂,水溶性硅含量为(4.6±1.5)mg/kg,pH 8.2);(3)农用硅肥(挪威,固态硅,水溶性硅含量为(91.4±8)mg/kg,pH 7.9);(4)Zumsil(美国,液态硅,含20%的单硅酸,pH 12.0),将Zumsil分别稀释700倍和1000倍。
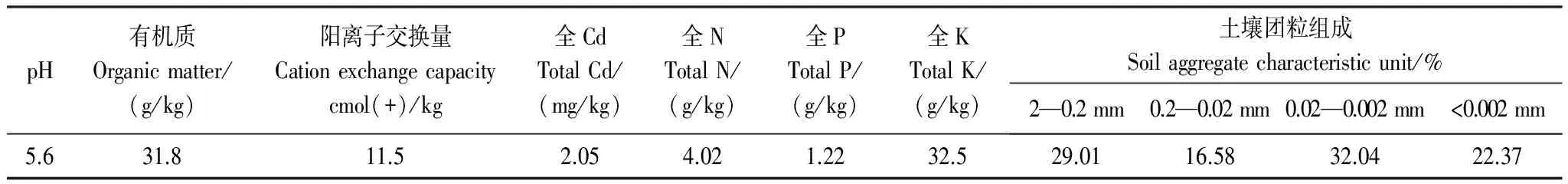
表1 供试土壤基本理化性质
1.2 试验设计
本试验所用塑料盆容积为1L,装土1kg,处理设计为:CK;FS(基施0.5gFS,追施1gFS,每天用50mL蒸馏水灌溉);矿渣(基施0.5g矿渣,追施1g矿渣,每天用50mL蒸馏水灌溉);农用硅肥(基施0.5g农用硅肥,追施1g农用硅肥,每天用50mL蒸馏水灌溉);稀释700倍Zumsil (每天用50mL灌溉);稀释1000倍Zumsil(每天用50mL灌溉)。每个处理各设置一份污染处理盆栽和未污染处理盆栽,每个处理3次重复。室温保持在白天(28±2)℃,夜间(24±2)℃,光照时间为12h,光照强度为950μmol m-2s-1,白天相对湿度为(50±5)%,夜间相对湿度为(60±5)%。2周后,用50mL 50mg/L的镉溶液处理污染组植株(CdSO4与H2O的比例为3∶8,此为模拟高度污染),未污染组植株用蒸馏水或稀释的Zumsil继续灌溉,种植3周后收获,记录每株重量(根和芽)。
1.3 样品采集及分析方法
将新鲜土样和水以1∶5的比例混合,风干土样与0.1mol/L HCl以1∶10的比例混合振荡24h后,分析硅与镉的含量[20],用4802—紫外可见分光光度计法[21]测定纯净的萃取液中的单硅酸。水稻叶子经过清洗后,以65℃烘干4h,研磨,加入HNO3和H2O2,用CEMMARS 6MS5181 (美国)微波消解,最后测量总镉含量,NaOH熔融法确定硅总量。称取0.5g烘干植株样品于4cm高的镍坩埚并置于马福炉中,在1.5h时将温度增加到550℃,持续4h,冷却后,给每个镍坩埚加入2.5g的固态NaOH,并重新将镍坩埚放置到马福炉中,再次将温度增加到550℃,持续1.5h,冷却后,用蒸馏水溶解,ICP—OES (Perkin Elmer Optima 5300 DV)分析硅和镉含量。
使用以下方法分析根和芽的质外体和共质体中可溶性镉和单硅酸含量。取鲜样0.2—0.6g,切成1—2cm的长度,称重后放入塑料瓶中,然后加入50mL的蒸馏水,混合振荡24h,以此可以使质外体溶液传送到外部溶液中[22],将混合物过滤,分析滤液中的单硅酸和镉含量。过滤后的植株样中所有细胞壁粉碎,形成匀浆,将匀浆与50mL 蒸馏水混合,搅拌1h,最后,将上述方法获得的共质体溶液中的单硅酸和可溶性镉稀释分析,根据植株水分系数,以干重计算单硅酸和可溶态硅的含量。
1.4 统计分析
本文数据结果采用SPSS 19.0统计软件完成,Duncan′s检验法进行多重比较和分析处理。
2 结果分析
2.1 不同硅处理对水稻生物量的影响
除矿渣外,其他富硅材料显著增加了19.4%—55.5%的水稻根生物量和10.4%—15.1%的芽生物量(表2)。矿渣对于无镉处理的土壤没有影响。CK通过添加镉会抑制水稻生长,根和芽的鲜重分别从0.36降低到0.31g/株(降低14%),从0.86降低到0.65g/株(降低25%)。通过施用固态或液态富硅物质(包括矿渣),可以减轻镉对于水稻的毒害,可以分别增加12.9%—41.5%根鲜重,15.4%—33.8%芽鲜重,实验证明矿渣效果较差,而稀释700倍的Zumsil溶液和农用硅肥的效果较好。
2.2 不同硅处理对水稻质外体和共质体中总硅和单硅酸的影响
未污染处理通过施用硅肥,根总硅含量从2.14%增加到2.74%,污染处理从2.35%增加到2.85%,未污染处理的芽总硅含量从1.04%增加到2.45%,污染处理从1.01%增加到2.48%(表3)。除矿渣外,其他硅肥处理的根部质外体和共质体中的单硅酸均显著增加,在水稻芽部质外体中检测到极显著的单硅酸增加,高镉污染导致了根部的总硅含量以及根部质外体和共质体中的可溶性硅含量增加。
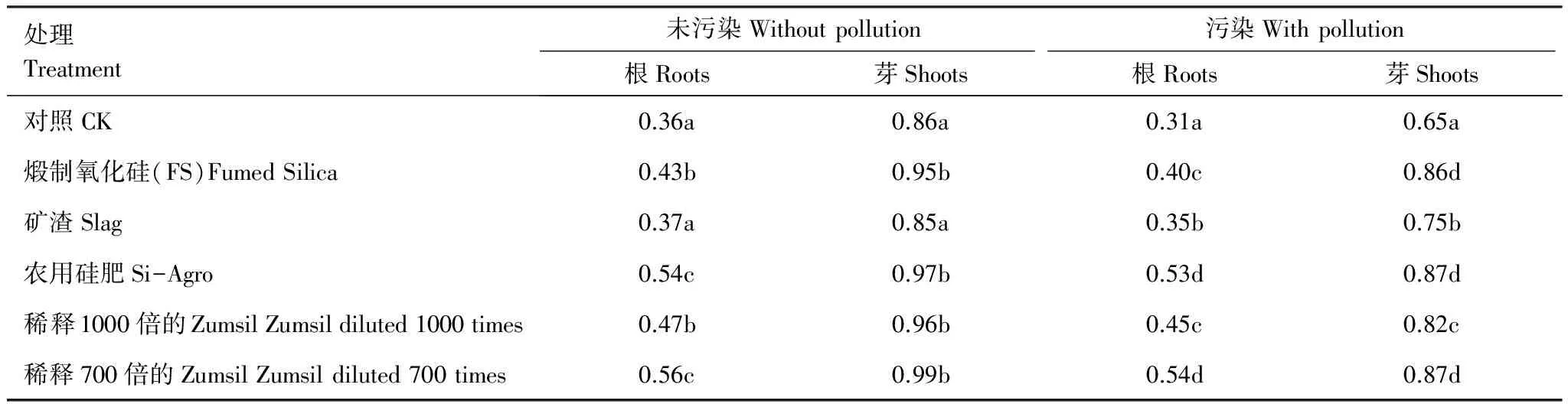
表2 水稻根、芽的鲜物质量/(g/株)
同列数字的不同字母表示处理间差异性显著(P<0.05)
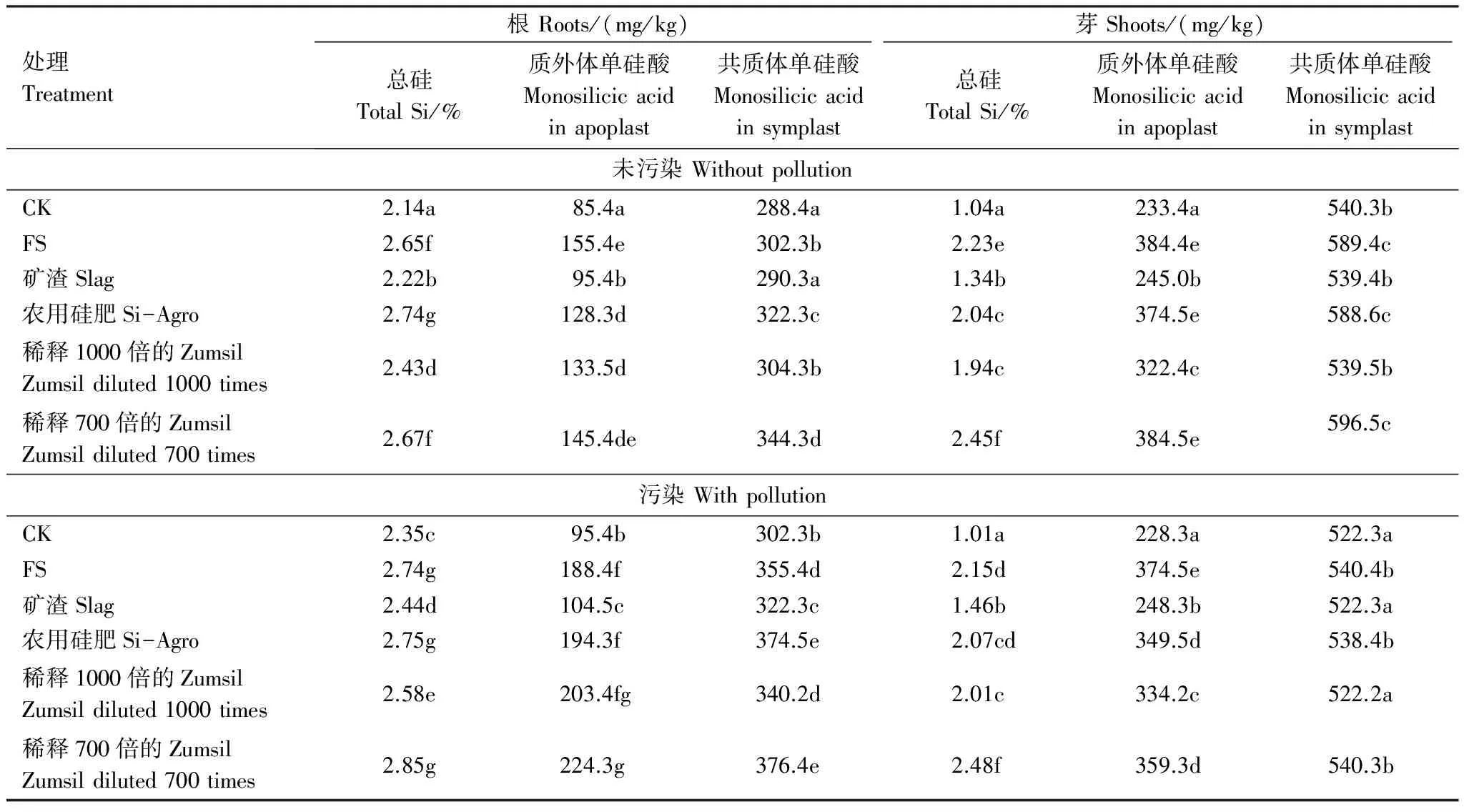
表3 水稻根、芽的质外体和共质体中总硅和单硅酸的含量
2.3 不同硅处理对水稻质外体和共质体中总镉和可溶性镉的影响
在中、高度污染水平的土壤中,根部的总镉含量远高于芽部(表4),在未污染的土壤中,根部和芽部的总镉含量分别为2.52mg/kg和0.24mg/kg,除矿渣外,富硅物质可以显著降低根部总镉含量,而硅对于芽部总镉的降低效果相对较低。
同共质体相比,镉主要累积于根部和芽部的质外体中。镉污染能显著增加植物组织中的总镉含量以及植物根部和芽部共质体和质外体中的可溶性镉含量,根部的总镉含量为125.54mg/kg,芽部总镉含量为89.53mg/kg,富硅物质能增加23.8%的根部的总镉含量以及68.7%的根部质外体的可溶性镉含量,而芽部的总镉却含量却降低了65.7%,芽部质外体中的可溶性镉含量也降低了67.5%。在共质体中,施用硅肥可以减少9.1%—39.5%的根部可溶性硅含量和6.7%—61.1%的芽部可溶性硅含量,其中,稀释700倍的Zumsil溶液最有效,而矿渣效果最差。
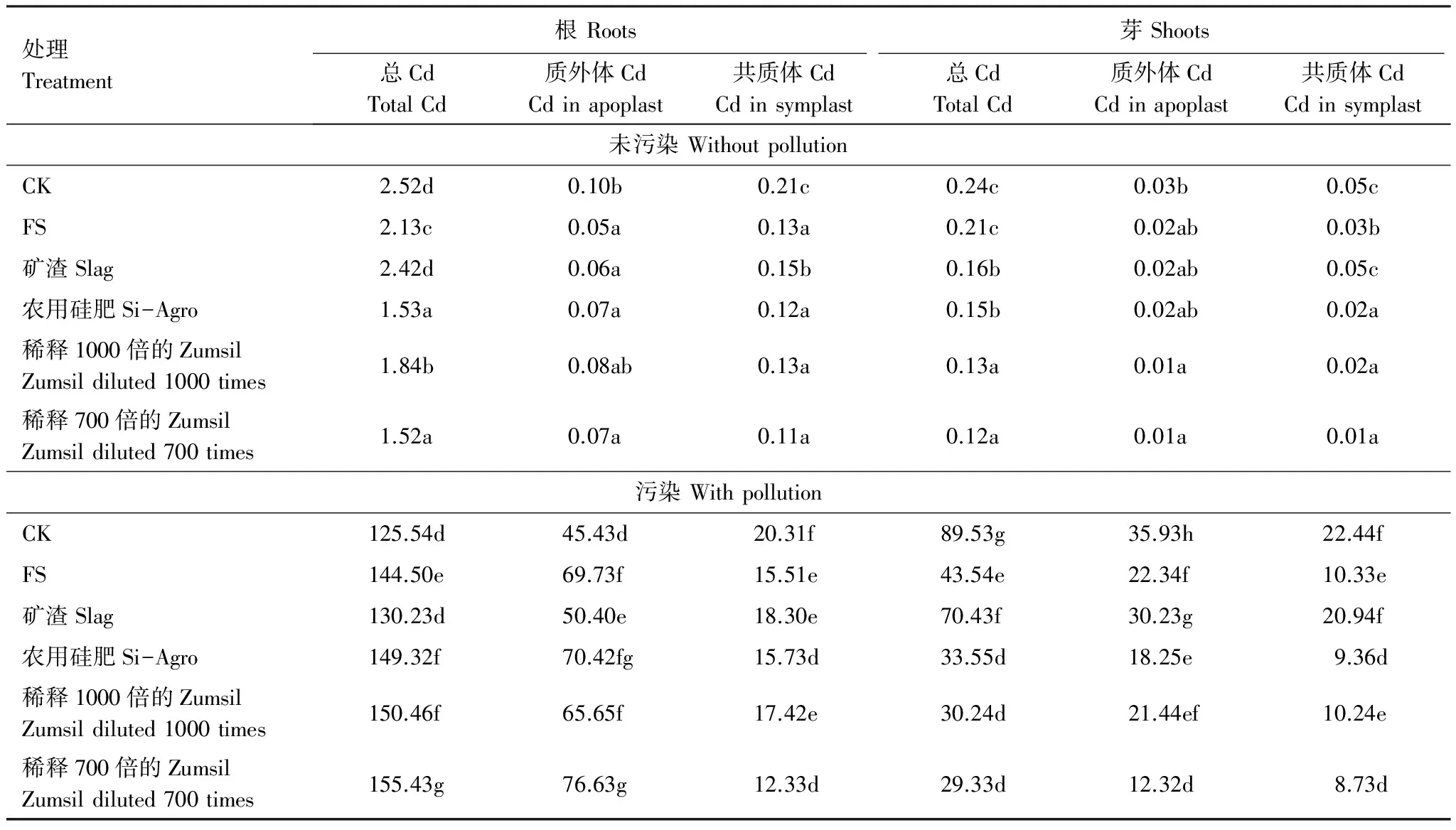
表4 水稻根、芽的质外体和共质体中总镉和可溶性镉的含量/(mg/kg)
2.4 不同硅处理对水、酸萃取态的土壤硅和镉的影响
由表5可知,土壤中的移动性(水萃取态)以及潜在移动性(酸萃取态)的硅和镉的含量。原始土壤中的移动的镉和硅(分别是0.05mg/kg和5.4mg/kg)和潜在移动的镉和硅(分别是0.25mg/kg和85.6mg/kg)都比较低,施用富硅物质分别增加了44.4%—281.4%移动性硅以及23.1%—172.5%潜在移动性硅,以稀释700倍的Zumsil溶液和FS效果最好。模拟的镉污染土壤,对移动性和潜在移动性的硅影响不大。在未添加镉的土壤中,施用富硅物质可以减少两种形态的硅,其中施用农用硅肥可以降低40%的水萃取态硅,施用FS可以降低60%的酸萃取态硅。通过添加镉,显著增加了移动性镉(从0.05mg/kg到2.52mg/kg)和潜在移动性镉(从0.25mg/kg到3.52mg/kg),而施用富硅物质可以减少土壤中移动性镉和潜在移动性镉的含量。这次实验结果再次表明Zumsil的效果最好,而矿渣效果最差。
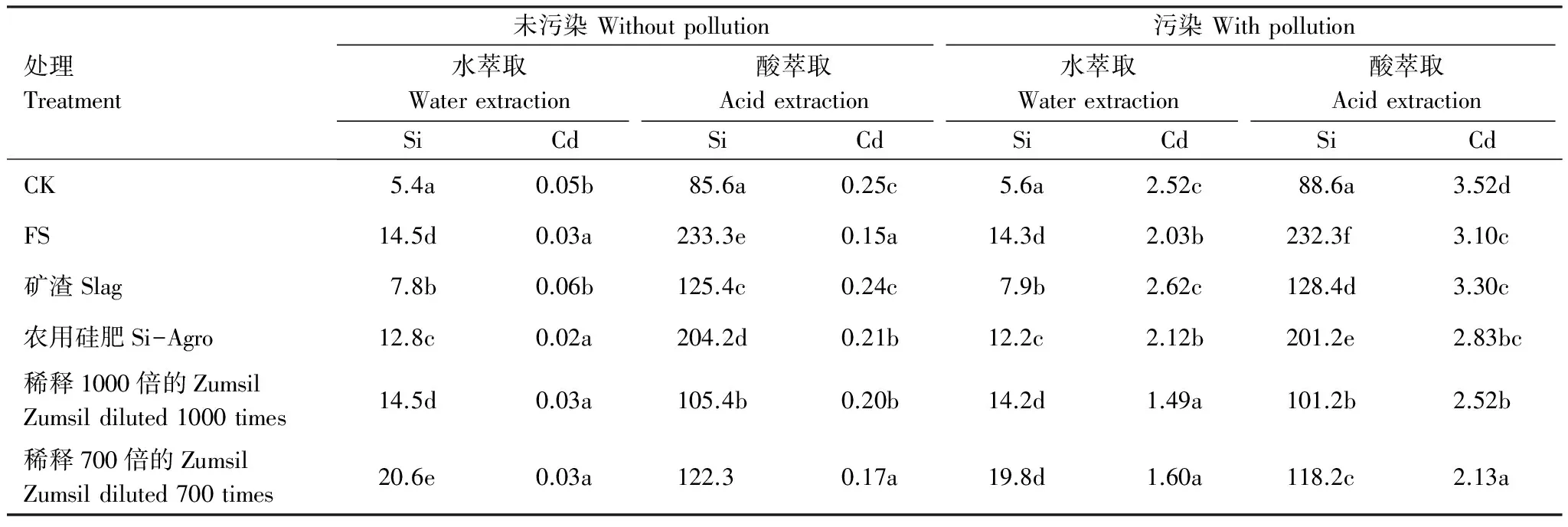
表5 水和酸萃取下的土壤硅和镉含量/(mg/kg)
3 讨论
获得的数据表明用于实验的富硅物质可以显著影响土壤-水稻系统中镉的转移和积累,但是影响程度依赖于土壤受镉污染程度,以及用于释放单硅酸的硅材料的性能。因此建议使用两种单硅酸作用机制:第一种是单硅酸能和可溶性镉直接反应产生微溶性硅酸镉,这个反应在1979年由Lindsay说明过[23];第二种是单硅酸可以大量吸附在土粒表面,然后与镉离子产生化学反应,这种机制无论对于未经硅处理的土壤还是经过硅处理的土壤都更胜一筹,因为单硅酸浓度远高于可溶性镉浓度。应用富硅物质同时也能吸附土壤溶液中的镉,从而降低镉的流动性,这种相互作用曾在科学文献中有涉及[24-25],在没有经过镉处理的土壤上生长的水稻,80.0%的镉累积在根部,75.0%的镉累积在在芽部,添加镉后使根部和芽部的镉累积分别降低到65.6%和60.5%。镉在植物中主要通过质外体途径迁移,质外体中的可溶性镉远高于共质体。我们发现增加水稻吸附态镉可以促使植物防御机制被激活,从而降低镉穿透细胞壁传递到共质体中,同时,部分镉还能与质外体和共质体中的可溶性有机分子发生反应,从而增加植物组织中镉的累积。
硅可以促使水稻根部和芽部的总镉含量降低,同时也使根部和芽部的质外体和共质体中的镉含量降低,这和土壤中镉的流动以及镉在植物中的传送降低相关联。但是,在镉处理的情况下,和没有应用硅的情况相比,硅使根部总镉含量以及根部质外体总镉含量增加,而芽部总镉含量以及根部共质体、芽部质外体和共质体中的总镉含量却都降低。试验结果证明了在几种硅应用的高镉污染情况下,水稻生长过程中硅对镉传送和积累的影响,尽管硅处理会导致根部组织和根部质外体中镉增加,但是穿透到根部共质体以及向芽部转移的镉含量却显著降低,这可能是因为植物吸收外源硅可以降低镉穿透芽部质外体和共质体间细胞壁的能力,该结果和其他研究相吻合[16-17,26]。
土壤中硅的参数能更好地反映硅对于镉在植物中的转移和积累的影响。通过分析土壤中水和酸的萃取态硅、镉,以及植物中的镉和硅的总量(表6)表明,土壤中水和酸的萃取态硅与其他参数具有最高的相关性(正面或负面的),酸萃取态硅具有低或很低的相关性,土壤的水萃取态硅表示植物的可利用的硅的比例。我们的研究还表明这些参数和水稻中镉和硅的吸收以及积累有很高的相关性,但是这些过程较为复杂,需要进行更多的研究。
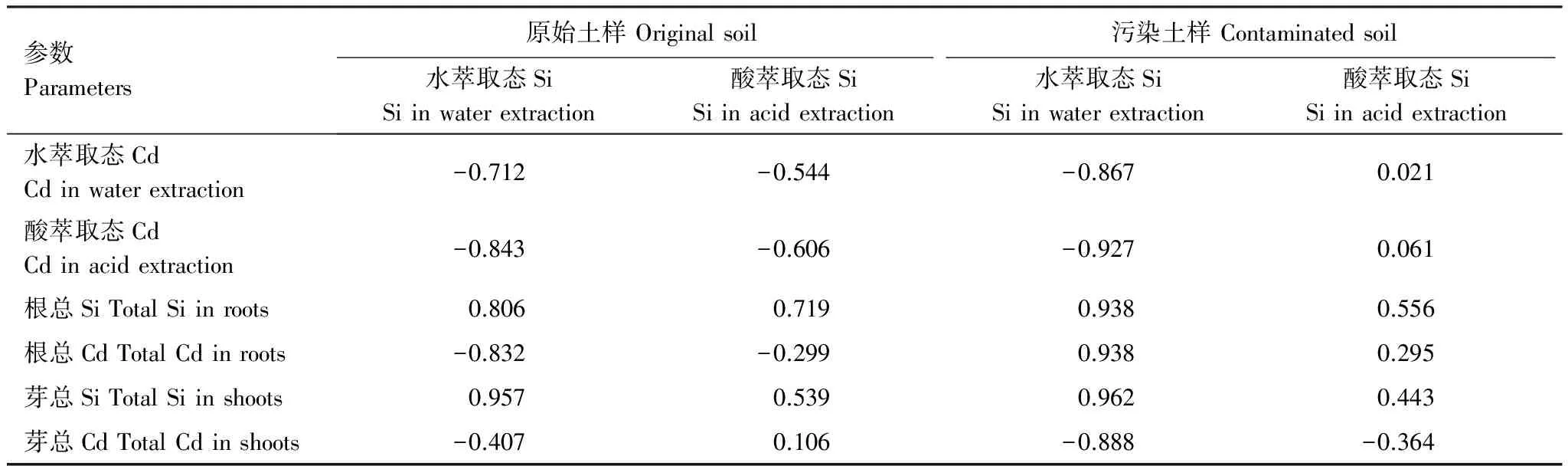
表6 萃取出的硅与其他已知参数之间的相关关系
4 结论
结果表明,土壤-水稻系统中镉转移及积累过程因污染水平而异,富硅物质能够调节这些反应的方向和强度。在中度镉污染的水平下,共质体中可溶性镉占主导,施用富硅物质可以减少土壤中镉的移动性和水稻根及幼苗中镉的积累,在高度镉污染水平下,自然机制阻断了镉穿透细胞膜激活质外体的通道以及从质外体传送到共质体、从根部传送到芽的传递。施用硅的情况下,镉主要积累在根部和根的质外体中,而芽和根部共质体中镉的运输及积累却被降低,新鲜土壤的水萃取态单硅酸含量与土壤-水稻系统中镉的移动、传送、积累密切相关。
本研究可以得到几种影响土壤-水稻系统中镉行为的作用机理:首先,固态和液态硅的应用可以减少土壤中镉的移动和潜在移动,单硅酸与镉反应形成不溶性硅酸盐;其次,土壤镉可以被富硅物质吸附,从而降低镉的移动性;此外,硅素还可以增加水稻质外体和共质体中单硅酸的浓度,从而使大部分镉积累在根部质外体中,有效降低镉在水稻组织中的迁移。
参考文献(References):
[1] 陈朗, 宋玉芳, 张薇, 李秀颖, 王磊, 吉普辉, 杨晓霞. 土壤镉污染毒性效应的多指标综合评价. 环境科学, 2008, 29(9): 2606- 2612.
[2] Tudoreanu L, Phillips C J C. Modeling cadmium uptake and accumulation in plants. Advances in Agronomy, 2004, 84(4): 121- 157.
[3] Ayodeji F B, Olorunsola O E. Transfer coefficients of some toxic and trace elements into Siam weed along highways in Ado-Ekiti, Nigeria.
[4] Journal of Research in Environmental Science and Toxicology, 2012, 1(10): 267- 274.
[5] 王慎强, 陈怀满, 司友斌. 我国土壤环境保护研究的回顾与展望. 土壤, 1999, 31(5): 255- 260.
[6] 宋文恩, 陈世宝, 唐杰伟. 稻田生态系统中镉污染及环境风险管理. 农业环境科学学报, 2014, 33(9): 1669- 1678.
[7] Cordero B, Lodeiro P, Herrero R, de Vicente M E S. Biosorption of cadmium byFucusspiralis. Environmental Chemistry, 2004, 1(3): 180- 187.
[8] Kabata-Pendias A, Mukherjee A B. Trace Elements from soil to human. Berlin: Springer, 2007.
[9] 何俊瑜, 任艳芳, 王阳阳, 李兆军. 不同耐性水稻幼苗根系对镉胁迫的形态及生理响应. 生态学报, 2011, 31(2): 522- 528.
[10] 王晓娟, 王文斌, 杨龙, 金樑, 宋瑜, 姜少俊, 秦兰兰. 重金属镉(Cd)在植物体内的转运途径及其调控机制. 生态学报, 2015, 35(23): 7921- 7929.
[11] Hasan S A, Fariduddin Q, Ali B, Hayat S, Ahmad A. Cadmium: toxicity and tolerance in plants. Journal of Environmental Biology, 2009, 30(2): 165- 174.
[12] 杨春刚, 朱智伟, 章秀福, 牟仁祥, 陈铭学. 重金属镉对水稻生长影响和矿质元素代谢的关系. 中国农学通报, 2005, 21(11): 176- 192.
[13] Gratão P L, Polle A, Lea P J, Azevedo R A. Making the life of heavy metal-stressed plants a little easier. Functional Plant Biology, 2005, 32(6): 481- 494.
[14] Song A, Li Z J, Xue G F, Fan F L, Liang Y C. Silicon-enhanced resistance to cadmium toxicity inBrassicachinensisL. is attributed to Si-suppressed cadmium uptake and transport and Si-enhanced antioxidant defense capacity. Journal of Hazardous Materials, 2009, 172(1): 74- 83.
[15] 王怡璇, 刘杰, 唐云舒, 伍婵翠, 周树林, 姚诗音. 硅对水稻镉转运的抑制效应研究. 生态环境学报, 2016, 25(11): 1822- 1827.
[16] Dresler S, Wójcik M, Bednarek W, Hanaka A, Tukiendorf A. The effect of silicon on maize growth under cadmium stress. Russian Journal of Plant Physiology, 2015, 62(1): 86- 92.
[17] 史新慧, 王贺, 张福锁. 硅提高水稻抗镉毒害机制的研究. 农业环境科学学报, 2006, 25(5): 1112- 1116.
[18] 陈喆, 张淼, 叶长城, 毛懿德, 周细红, 雷鸣, 魏祥东, 铁柏清. 富硅肥料和水分管理对稻米镉污染阻控效果研究. 环境科学学报, 2015, 35(12): 4003- 4011.
[19] Shi X H, Zhang C C, Wang H, Zhang F S. Effect of Si on the distribution of Cd in rice seedlings. Plant and Soil, 2005, 272(1): 53- 60.
[20] Bocharnikova E A, Matichenkov V V. Influence of plant associations on the silicon cycle in the soil-plant ecosystem. Applied Ecology and Environmental Research, 2012, 10(4): 547- 560.
[21] Mullin J B, Riley J P. The colorimetric determination of silicate with special reference to sea and natural waters. Analytica Chimica Acta, 1955, 12: 162- 176.
[22] Matichenkov V V, Bocharnikova E A, Kosobryukhov A A, Biel K Y. Mobile forms of silicon in plants. Doklady Biological Sciences, 2008, 418(1): 39- 40.
[23] Lindsay W L. Chemical Equilibria in Soils. New York: John Wiley & Sons, 1979.
[24] Xingu-Contreras E, García-Rosales G, García-Sosa I, Cabral-Prieto A, Solache-Ríos M. Characterization of natural zeolite clinoptilolite for sorption of contaminants. Hyperfine Interactions, 2015, 232(1/3): 7- 18.
[25] Ladonin D V. The effect of ferrous and clay minerals of sorption of cupper, zinc, lead and cadmium in concrete accumulated horizon. Eurasian Soil Science, 2003, 10: 1197- 1206.
[26] Balakhnina T I, Bulak P, Matichenkov V V, Kosobrykhov A A, Wodarczyk T M. The influence of Si-rich mineral zeolite on the growth processes and adaptive potential of barley plants under cadmium stress. Plant Growth Regulation, 2015, 75(2): 557- 565.

