兼具解磷解钾功能生防菌分离鉴定及效果评价
代 志,高俊明
(山西农业大学农学院,山西太谷 030801)
农药化肥的大量投入和使用曾对确保我国粮食生产和菜篮子工程大力发展发挥了积极重要的作用。但多年来,我国农药、化肥使用效率偏低、过量和不合理施用现象极为普遍,由此带来的副作用也越来越突出,如土壤出现板结、酸化、肥力下降,土壤微生态失衡,有害生物抗药性产生,病虫草害频发,环境污染、农产品有害物质残留超标等已严重影响到了我国农业的可持续发展[1-2]。为此,国家提出了减肥控药确保农药化肥零增长行动方案,为我国今后农业可持续发展奠定了方向。而在新形势下,如何确保粮食、蔬菜等主要农产品供给,实现农药、化肥减量提效、控害[3],就成为农业科技领域面临的重要问题。
已有研究表明,土壤中不仅存在能够降解矿物质、促进土壤中难溶性磷钾释放的有益微生物群,也存在着能够抑制和杀死有害生物的有益微生物[4-6]。充分开发利用这些有益微生物资源是实现农药、化肥减量提效的一条重要途径。但目前对这类有益微生物资源的开发利用还远远不够,菌肥工作者只注重了能够改善土壤结构、提高土壤肥力的微生物筛选;生防工作者则只注重有生防活性微生物的筛选[7],这极大地影响了有益微生物资源在生产中的广泛应用。
本研究以山西省普遍严重发生的根结线虫为靶标生物,在筛选根结线虫生防菌的过程中增加了解磷释钾活性测定环节,以期能够筛选到兼具菌肥功能的根结线虫生防菌,为今后多功能微生物生防菌和复合微生物菌肥研发及广泛应用奠定理论基础。
1 材料和方法
1.1 试验材料
本研究中分离筛选根结线虫生防菌的土样采自山西太谷县侯城乡根结线虫病连年严重发生的温室内土壤。
1.2 试验方法
1.2.1 多功能生防细菌的分离和筛选
1.2.1.1 土样采集 土样采集时首先选择根结线虫病严重发生且近期又未使用任何农药的黄瓜或番茄大棚,进入温室后随机选择10个根结线虫病发生相对较轻的采样点,每点0.25 m2,除去表层干土,采集5~20 cm根际土壤,装入塑料袋编号后带回实验室,低温(4℃)冷藏以备分离。
1.2.1.2 土壤细菌的分离 取土壤样品1.0 g,放入100 mL无菌水中,用玻璃棒搅拌均匀,静置30 min,将土样溶液分别稀释 10-1,10-2,10-3,10-4,10-5涂布于牛肉膏蛋白胨琼脂培养基平板上,倒置放入37℃培养箱中培养,待平板中长出菌落,用接菌环将不同形态和颜色的单个菌落转接到新的空白NA培养平板中纯化培养,培养后接种到试管中,于4℃冰箱保存。
1.2.1.3 解钾菌株筛选 将1.2.1.2中分离到的细菌菌株,分别先在NA培养平板活化培养48 h,然后将活化后的新鲜菌株用接菌环十字划线法接种到不含游离钾元素解钾平板中培养,若正常生长,表明该菌可利用含钾矿石。
解钾平板培养基:蔗糖 2.0 g,(NH4)2SO40.5 g,MgSO4·7H2O 0.5 g,Na2HPO41.5 g,钾长石粉 5.0 g,琼脂20.0 g,蒸馏水1 000 mL。
1.2.1.4 解磷菌株的筛选 将1.2.1.3中筛选得到的能在解钾培养平板中生长的菌株再转接到解无机磷和解有机磷培养平板中,倒置放入37℃培养箱中培养3~7 d,从中挑选菌落周围有溶解圈产生的菌株,然后转到试管中,4℃冰箱保存。
解无机磷平板培养基:(NH4)2SO40.5 g,MgSO4·7H2O 0.5 g,NaCl 0.2 g,CaCO32.5 g,葡萄糖 2.0 g,MnSO40.02 g,FeSO40.02 g,琼脂 20.0 g,蒸馏水1 000 mL。
解有机磷平板培养基:(NH4)2SO40.5 g,MgSO4·7H2O 0.5 g,NaCl 0.2 g,CaCO32.5 g,葡萄糖 2.0 g,MnSO40.02 g,FeSO40.02 g,卵磷脂 0.2 g,琼脂 20.0 g,蒸馏水1 000 mL。
1.2.2 解磷释钾菌株杀线虫能力测试
1.2.2.1 根结线虫分离 采用浅盘法分离根结线虫。称取土样200 g左右平铺在垫有双层面巾纸的筛盆中,然后将筛盆放入不锈钢托盘中,沿边缘倒入清水至没过土壤,静置48 h,移去筛盆,然后将托盘中的水缓缓倒入到0.020 mm网筛中过滤,过滤至50 mL左右倒入离心管中待用。
1.2.2.2 解磷释钾菌株杀线虫能力测试 将分离得到的解磷释钾菌株接入到NB培养基中,放入摇床中,在180 r/min,37℃条件下培养48 h。将细菌发酵液经8 000 r/min离心5 min,吸取上清液2 mL加入到贝式培养皿中,挑入经消毒过的根结线虫(0.3%次氯酸钠溶液处理3 min,无菌水冲洗3次过滤)30只,以加入未接菌的NB培养基的根结线虫平板为对照,试验重复3次,在24,48 h分别记录死亡线虫数量,并计算死亡率及校正死亡率[8]。校正死亡率=(处理某时刻线虫死亡率-对照某时刻死亡率)/(1-对照某时刻死亡率)×100%。
1.2.3 液体培养解磷解钾效果测定 采用无机磷液体培养基、有机磷液体培养基、钾细菌液体培养基分别对分离出的菌株进行液体培养,对分解磷钾活性进行进一步测定。
无机磷液体培养基:(NH4)2SO40.5 g,MgSO4·7H2O 0.5 g,NaCl 0.2 g,Ca3(PO4)210.0 g,CaCO30.5 g,葡萄糖 2.0 g,MnSO40.02 g,FeSO40.02 g,蒸馏水1 000 mL。
有机磷液体培养基:(NH4)2SO40.5 g,MgSO4·7H2O0.5 g,NaCl 0.2 g,卵磷脂 0.2 g,CaCO30.5 g,葡萄糖 2.0g,MnSO40.02g,FeSO40.02g,蒸馏水 1000mL。
钾细菌液体培养基:(NH4)2SO41.0 g,MgSO4·7H2O 0.5 g,NaCl 0.1 g,Na2HPO42.0 g,蔗糖 10 g,酵母粉0.5 g,钾长石粉10.0 g,蒸馏水1 000 mL。
接种菌株后,摇床程序设置为37℃,180 r/min培养6 d,用过氧化氢法测定菌液中可溶性钾的含量[9],采用钼锑抗比色法测定菌液中可溶性磷的含量[10-12]。
1.2.4 菌株的鉴定
1.2.4.1 形态学鉴定 对分离到的菌株进行革兰氏染色、芽孢染色(参照叶生梅等[13]的细菌芽胞染色方法改进研究)、鞭毛染色(参照顾冠彬等[14]细菌的5种鞭毛染色方法比较研究),对其不同的形态特征进行鉴别。
1.2.4.2 生理生化鉴定 参照《常见细菌系统鉴定手册》对其进行以下生理生化鉴定:糖发酵、甲基红、接触酶、V-P测定、水解淀粉、利用柠檬酸盐、利用丙酸盐、苯丙氨酸脱氨酶、卵磷脂酶、硝酸盐还原、形成吲哚、耐盐试验、氧化酶、脓青素、明胶液化、酯酶、生长温度测定、精氨酸双水解酶、葡萄糖利用[15]。
1.2.4.3 分子鉴定 将不同菌株液体发酵培养后,取1 mL加入到1.5 mLEP管中,使用细菌抽提试剂盒将分离得到的菌株全基因组抽提出后,再利用细菌促旋酶gyrB基因[16-18]将其进行PCR扩增,得到扩增产物后送公司测序,并将序列结果输入到NCBI数据库进行比对分析。
2 结果与分析
2.1 菌株的分离筛选
2.1.1 解磷释钾菌株的初筛与纯化 利用稀释涂布法从采集到的10份土壤样品中共分离得到83株细菌菌株,根据分别可生长于难溶无机磷、有机磷和解钾培养基上的菌株菌落形态及产生的溶解圈,从83株菌株中共分离纯化得到5株解有机磷解钾菌株(编号 TD-02-9,TD-04-4,TD-05-4,TD-05-7,TD-10-3)和4株解无机磷解钾菌株(编号 TD-02-7,TD-05-8,TD-09-3,TD-10-6)。
2.1.2 菌株杀线虫测定结果 筛选结果列于表1。
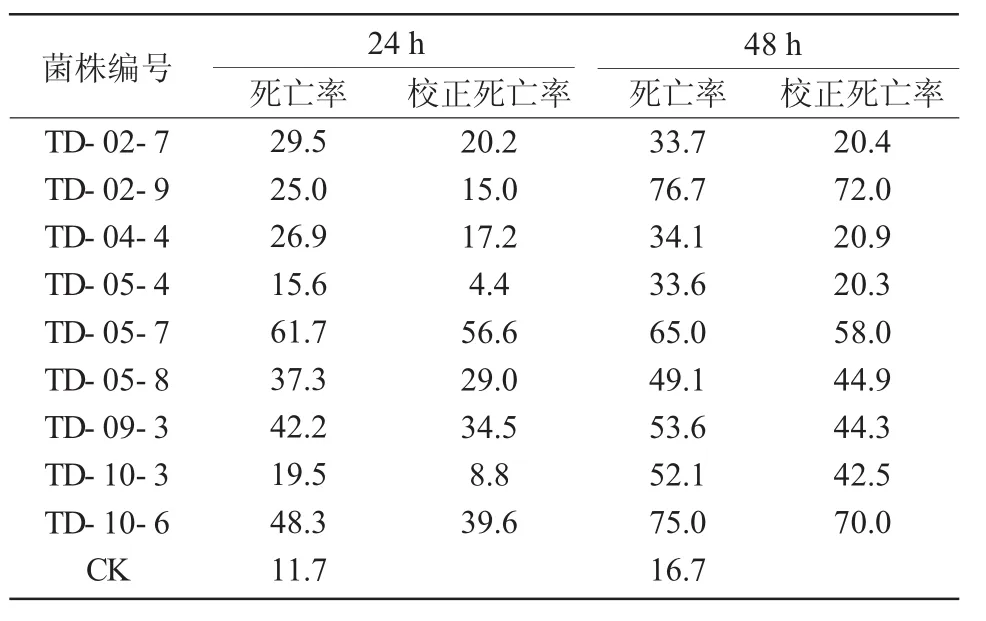
表1 3种菌株杀线虫结果 %
试验共测试了上述分离筛选得到的9株解磷释钾菌株的抑杀线虫死亡率及校正死亡率,其中在作用48 h后有3株菌株对线虫抑杀校正死亡率在50%以上,分别为 TD-02-9,TD-05-7,TD-10-6。以此3株菌株为供试菌株,测定其液体发酵解磷解钾效果及菌株鉴定。
2.1.3 液体发酵培养解磷解钾效果测定 利用过氧化氢法和钼锑抗比色法分别测定3种供试菌株发酵液中可溶性磷和可溶性钾的含量,结果如表2所示。从表2可以看出,菌株TD-10-6解有机磷和无机磷能力分别达到3.66,61.80 mg/L,明显高于菌株TD-02-9和菌株TD-05-7;在解钾效果方面,菌株TD-05-7和菌株TD-02-9解钾能力分别达到8.74,8.17 mg/L,均高于菌株TD-10-6的6.72 mg/L。

表2 液体培养解磷解钾效果测定 mg/L
2.2 3种解磷菌株的鉴定
2.2.1 菌株形态学特征
2.2.1.1 菌落形态 菌株TD-10-6在NA培养基上生长出的菌落形态为白色不透明脓状,边缘整齐,表面光滑(图1);菌株TD-05-7菌落形态为白色不透明薄膜状,边缘粗糙(图2);菌株TD-02-9菌落形态为淡黄色乳状物,表面光滑有黏性(图3)。


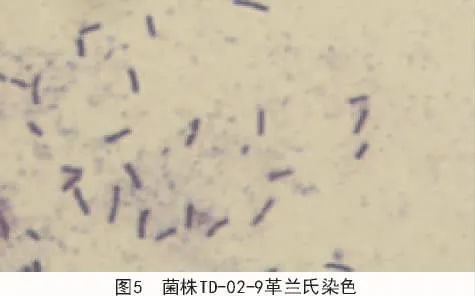
2.2.1.2 革兰氏染色 经过革兰氏染色试验表明,菌株 TD-05-7(图 4)和菌株 TD-02-9(图 5)染色结果显示蓝紫色,属革兰氏阳性菌;菌株TD-10-6(图6)染色结果为红色,属革兰氏阴性菌。

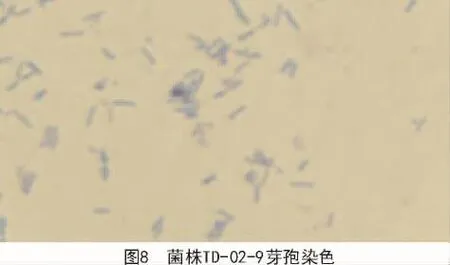
2.2.1.3 芽孢染色 从染色结果可以看出,菌株TD-05-7(图 7)和菌株 TD-02-9(图 8)芽孢端生,单菌形态为长棒状。

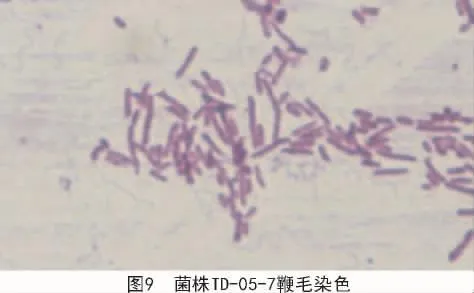
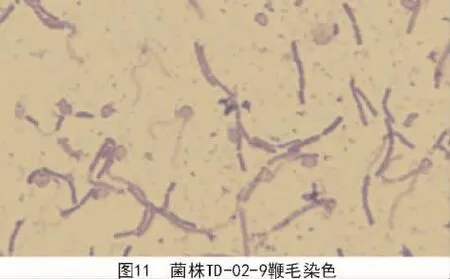
2.2.1.4 鞭毛染色 对3种菌株鞭毛染色试验结果显示,菌株TD-05-7(图9)为单鞭鞭毛,菌株TD-10-6(图 10)为周生鞭毛,菌株 TD-02-9(图11)周围有2根鞭毛。
2.2.2 菌株生理生化特征 菌株TD-02-9,TD-05-7,TD-10-6生理生化试验鉴定结果列于表3。参照《常见细菌系统鉴定手册》得出,菌株TD-02-9和菌株TD-05-7分别与芽孢杆菌属中解淀粉芽孢杆菌和地衣芽孢杆菌生理生化特征基本一致,菌株TD-10-6与假单胞菌中恶臭假单胞菌生理生化特征一致,因此,鉴定菌株TD-02-9为解淀粉芽孢杆菌,菌株TD-05-7为地衣芽孢杆菌,菌株TD-10-6为恶臭假单胞菌。
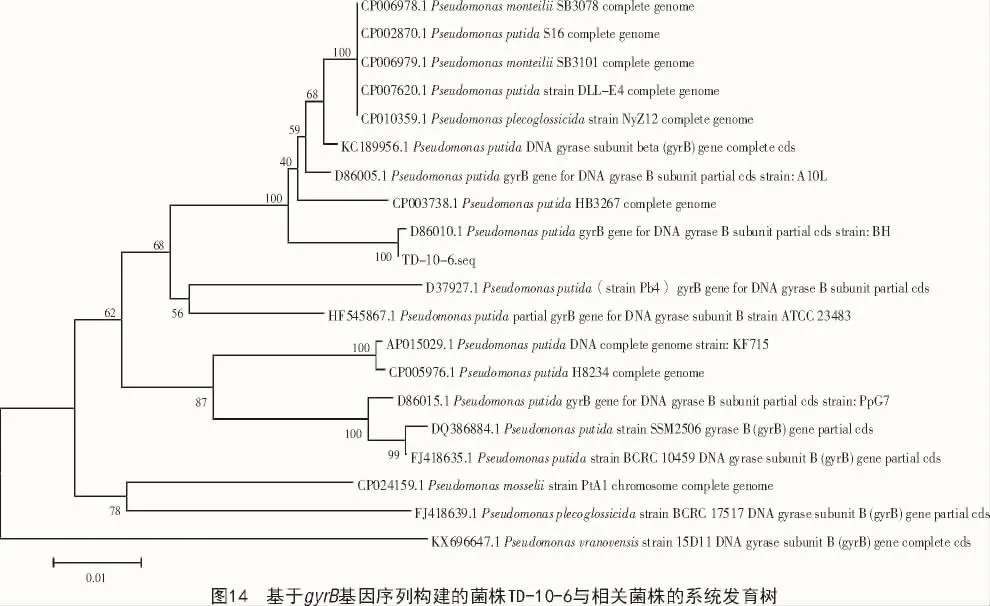
2.2.3 菌株分子鉴定结果 基于促旋酶gyrB基因扩增序列的比对分析,结果显示,菌株TD-02-9和菌株TD-05-7与Bacillus属的其他序列有较高的相似性,菌株TD-10-6与Pseudomonas属的序列有较高相似性。构建系统发育树可以看出,菌株TD-05-7亲缘关系与CP021677.1 Bacillus licheniformis最近(图12),菌株TD-02-9亲缘关系与DQ309309.1 Bacillus amyloliquefaciens最近(图13),菌株TD-10-6亲缘关系与 D86010.1 Pseudomonas putida亲缘关系最近(图14)。因此,鉴定菌株TD-05-7为地衣芽孢杆菌,菌株TD-02-9为解淀粉芽孢杆菌,菌株TD-10-6为恶臭假单胞菌。
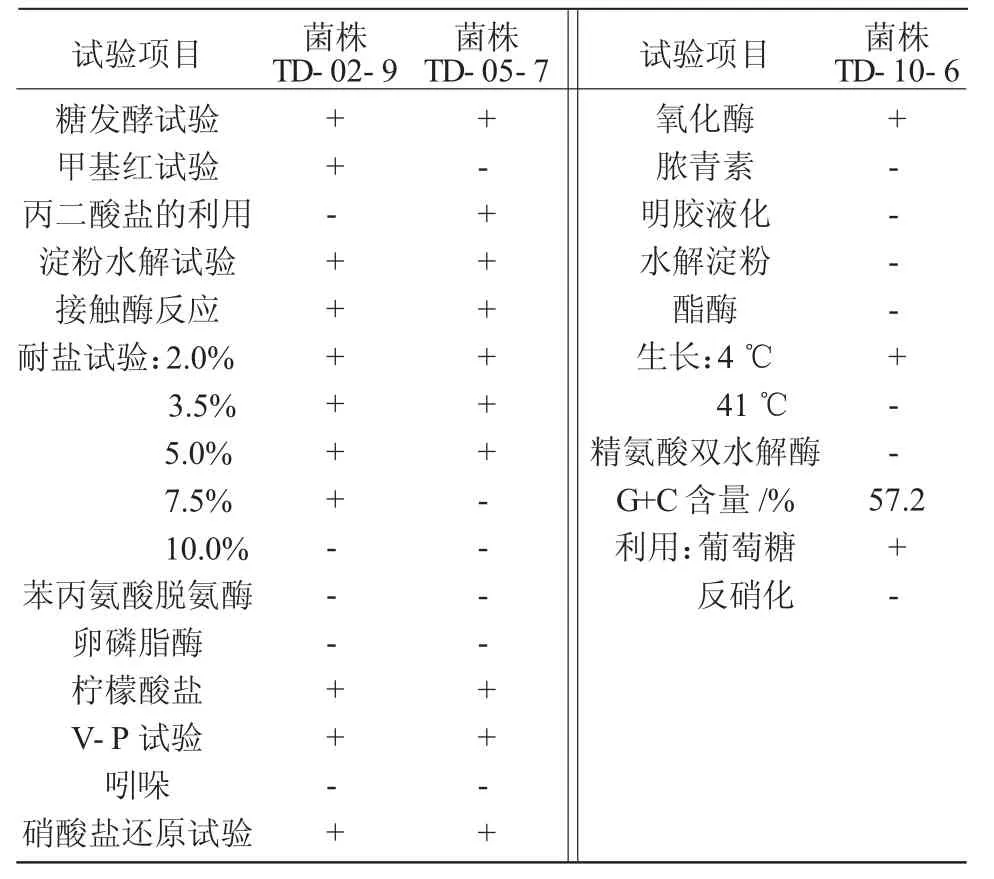
表3 3种供试生理生化试验结果


3 讨论
本研究通过从温室土壤中筛选得到3种兼具解磷释钾多功能生防菌株,通过鉴定,其中2株为芽孢杆菌,1株为假单胞菌。经液体发酵培养后进行解磷解钾效果测定,结果显示,3种菌株的解有机磷结果为0.82~3.66 mg/L,解无机磷结果为40.90~61.80 mg/L。利用火焰分光光度计测得3种菌株分解无机钾的结果为6.72~8.74 mg/L。假单胞菌解无机磷和有机磷能力明显高于2株芽孢杆菌;而在解钾能力上,2株芽孢杆菌大于假单胞菌。在进行平板筛选的过程中,只观察到菌株TD-02-9和菌株TD-05-7在有机磷平板中出现溶解圈,未在无机磷平板培养中出现溶解圈;而菌株TD-10-6恰恰相反,在无机磷平板中出现溶解圈,在有机磷平板中未出现溶解圈。但是液体发酵培养后进行解磷效果测定发现,菌株TD-10-6同样具有解有机磷的作用,而且解有机磷能力明显大于2株芽孢杆菌的能力,分析原因可能是由于菌株TD-10-6在液体培养中更容易繁殖,因而,解有机磷能力大大提高。
本研究提供了3株细菌的解磷解钾属性及对根结线虫的抑杀效果,后续试验还会对分离筛选得到的菌株进行田间作物促生及防病效果的研究。同时,本试验存在一些不足,植物生长不仅受土壤中磷钾离子的影响,微生物代谢产物中含有的生长素、生物降解酶等有机化合物同样会影响植物的生长和体内代谢平衡[19-20]。因此,还需要进一步测定菌株分泌物当中含有哪些具有植物促生作用的活性物质及含量,为今后多功能微生物生防菌肥的研发和应用奠定理论基础。
参考文献:
[1]刘贵锋,白文斌,赵建武,等.绿色有机肥料的开发与研制[J].现代农业科技,2013(1):224-225.
[2]梁绍芬,姜瑞波.解磷微生物肥料的作用和应用[J].中国土壤与肥料,1994(2):46-48.
[3]逄焕成,李玉义,严慧峻,等.微生物菌剂对盐碱土理化和生物性状影响的研究[J].农业环境科学学报,2009,28(5):951-955.
[4]林启美,王华,赵小蓉,等.一些细菌和真菌的解磷能力及其机理初探[J].微生物学通报,2001,28(2):26-30.
[5]林先贵,胡君利.土壤微生物多样性的科学内涵及其生态服务功能[J].土壤学报,2008,45(5):125-133.
[6]杨永华,姚健,华晓梅.农药污染对土壤微生物群落功能多样性的影响[J].微生物学杂志,2000(2):23-25.
[7]乔俊卿.Bacillus amyloliquefaciens B3生防促生相关基因和内生质粒pBSG3的研究及高效生防工程菌的构建[D].南京:南京农业大学,2010.
[8]路平.生防细菌X-20对根结线虫的生防机制及应用研究[D].太谷:山西农业大学,2016.
[9]王珣珏,黄巧云,蔡鹏,等.解钾菌解钾效率检测方法的比较[J].华中农业大学学报,2016(1):81-85.
[10]麻瑞阳,张爱民,惠小双,等.高效解磷解钾菌NX-11菌株的分离筛选、鉴定及最佳培养条件的确定 [J].华北农学报,2013,28(2):202-208.
[11]李必龙.磷标准曲线的绘制 [J].合成润滑材料,2006,33(2):17-19.
[12]程乐明,陈良,刘建雷,等.碳酸氢钠浸提-钼锑抗比色法测定土壤有效磷的注意事项[J].现代农业科技,2009(3):205.
[13]叶生梅,高威.细菌芽胞染色方法改进研究[J].微生物学杂志,2011,31(1):106-109.
[14]顾冠彬,房红莹,徐培君.细菌的五种鞭毛染色方法比较研究[J].中国血液流变学杂志,2005,5(3):483-485.
[15]蔡妙英,东秀珠.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[16]喻国辉,牛春艳,陈远凤,等.利用16SrDNA结合gyrA和gyrB基因对生防芽孢杆菌R31的快速鉴定[J].中国生物防治学报,2010,26(2):160-166.
[17]林玲,伍辉军,梁文伯,等.马来西亚植物根际土壤芽孢杆菌的鉴定及其对水稻白叶枯病防治效果 [J].南京农业大学学报,2016,39(3):394-401.
[18]侯晓丽,陈智.分类及鉴别细菌的新靶标——gyrB基因[J].国际流行病学传染病学杂志,2005,32(1):38-41.
[19]王贺祥.农业微生物学[M].北京:中国农业大学出版社,2003.
[20]杜春梅.芽孢杆菌在农业中的研究与应用[M].哈尔滨:黑龙江大学出版社,2013.

