淮山优良品种“桂淮”抗旱性研究
黄静
(漳州职业技术学院食品与生物工程系,福建 漳州 363000)
近年来全球气候日趋变暖,干旱灾害对植物造成的危害也随之加重,给植物的栽培和生产造成了极大的影响,使得干旱胁迫成为许多地区农业生产与发展最大的障碍[1]。为了适应并减轻干旱胁迫造成的伤害,一些植物在长期进化过程中已经演化出一套对生长环境的适应机制和策略[2],例如抗氧化防御、气孔调节以及渗透调节等途径[3]。有关干旱胁迫对作物影响的研究报道较多,其中大多集中在干旱胁迫阶段的植物形态生理等方面的变化[4],面对干旱胁迫后的水分恢复研究较少。研究表明,作物在某特定生长时期受到阈值内的水分胁迫后,及时恢复正常水分管理会对其发生生长、生理生化及产量等进行补偿[5]。本文选择淮山(Dioscorea opposita)优良品种“桂淮”进行耐旱生理的研究,通过设置不同干旱胁迫水平,及对胁迫后的复水试验,研究其对不同干旱胁迫强度的响应与调节,以探讨水分亏缺时淮山的生理反应及其适应机理,为淮山的大田耐旱栽培提供理论参考。
1 材料与方法
1.1 材料
选用淮山新品种“桂淮7号”,从广西农业科学院经济作物研究所引种,试验在漳州职业技术学院植物园大棚内进行。
1.2 试验设计
2016年7月选取生长整齐一致的淮山植株共60株,分为6组,开始干旱胁迫及复水处理,选取一组淮山进行正常肥水管理作为对照(CK),其余5组分别持续干旱处理5、10、15、20、25、30 d(分别以T1、T2、T3、T4、T5、T6表示)。达到处理要求的最后1天8∶00 a.m.随机剪取植株的上、中、下部叶片,去掉叶柄,剪碎后混合放入封口袋,立即到实验室测定各项生理生化指标,试验均设5次重复。不同干旱胁迫处理完毕后分别对其进行连续复水5 d后采样(复水后各组分别以R1、R2、R3、R4、R5、R6表示),进行各项生理生化指标的测定。
1.3 测定项目及方法
叶绿素含量的测定采用比色法,丙二醛(MAD)采用硫代巴比妥酸法,电导率测定采用电导仪测定;超氧化物酶(SOD)活性测定采用氮蓝四唑法[6]。
1.4 数据处理
采用Excel 2007、SPSS 19.0等软件对数据进行整理,绘制柱形图并对数据进行方差分析,并利用LSD法在P<0.05显著水平下进行多重比较。
2 结果与分析
2.1 干旱胁迫及复水处理对淮山叶绿素含量的影响
不同干旱胁迫程度及复水后淮山叶片叶绿素含量的变化如图1所示。可见,随着胁迫程度的增加,淮山叶片叶绿素含量呈下降后上升,在胁迫第10 d达到最低值,此时与对照相比下降了33.53%,在胁迫第25 d达到最高值,与对照相比下降了2.98%,此后呈下降趋势。从多重比较的结果可以看出干旱胁迫处理T2与对照、T5对淮山叶绿素含量的影响存在显著差异。复水后R1、R2、R3、R4、R5、R6与CK差异均性不显著,说明复水后,淮山叶片中叶绿素含量恢复到对照水平。T2与R2、T3与R3、T5与R5分别差异不显著,说明复水处理分别对已干旱胁迫10、15、25 d的淮山植株改善作用。
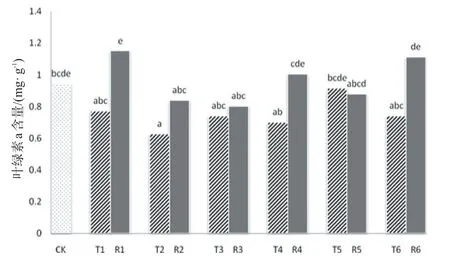
图1 干旱胁迫及复水处理下淮山叶绿素含量
2.2 干旱胁迫及复水处理对丙二醛含量的影响
不同干旱胁迫程度及复水后淮山叶片丙二醛含量的变化如图2所示。可见,随着胁迫程度的增加,淮山叶片丙二醛含量呈上升后下降再上升,在胁迫第15 d达到最低值,此时与对照相比下降了25.98%,在胁迫第25 d达到最高值,与对照相比上升了67.03%。从多重比较的结果可以看出干旱胁迫处理T4、T5、T6与CK存在显著差异。复水后R1、R2、R3、R4、R5与CK差异均不显著,说明复水后,干旱胁迫5、10、15、20、25 d的淮山叶片中丙二醛含量恢复到对照水平,R6与CK差异显著,说明干旱胁迫30 d的淮山植株复水后叶片中丙二醛含量难以恢复到对照水平。T5与R5存在显著差异,说明复水处理对干旱胁迫25 d的淮山植株产生影响。

图2 干旱胁迫及复水处理下丙二醛含量
2.3 干旱胁迫及复水处理对淮山电导率的影响
不同干旱胁迫程度及复水后淮山叶片电导率的变化如图3所示。从图3可见,当淮山受到干旱胁迫的第5 d,电导率大幅度升高,此后呈下降趋势,在胁迫第15 d达到最低值,此时与对照相比上升了1.81%,在胁迫第30 d达到最高值,与对照相比上升了48.43%。从多重比较的结果可以看出干旱胁迫处理T1、T4、T5、T6与CK存在显著差异。复水后R1、R2、R3、R4、R5、R6与CK差异均不显著,说明复水后,干旱胁迫5、10、15、20、25、30 d的淮山叶片中电导率含量恢复到对照水平。T1与R1,T4与R4,T5与R5,T6与R6存在显著差异,说明复水处理对干旱胁迫5、20、25、30 d的淮山植株产生影响。

图3 干旱胁迫及复水处理下电导率
2.4 干旱胁迫及复水处理对淮山SOD活性的影响
不同干旱胁迫程度及复水后淮山叶片SOD含量的变化如图4所示。可见,当淮山受到干旱胁迫第5 d,SOD活性大幅度上升,达到最大值,此时与对照相比上升了85.02%,此后SOD活性呈下降趋势,在胁迫第15 d达到最低值,与对照相比下降了5.06%。从多重比较的结果可以看出干旱胁迫处理T1与CK存在显著差异。复水后R1、R2、R3、R4、R5与CK差异均不显著,说明复水后,干旱胁迫5、10、15、20、25 d的淮山叶片中SOD含量恢复到对照水平,R6与CK存在显著差异,说明干旱胁迫第30 d淮山复水后叶片中的SOD含量难以恢复到对照水平。T1与R1存在显著差异,说明干旱胁迫5 d的淮山植株复水后难以恢复到原有的生理状态。

图4 干旱胁迫及复水处理下SOD活性
3 结论
植物在正常生长环境条件下,其体内的POD、SOD等通过彼此相互协调保障自身正常生长[7]。但在逆境胁迫环境中,植物体内活性物质产生与清除的平衡受到破坏且到达一定程度时,植物的正常生长就会受到影响[8]。植物体内丙二醛、电导率、超氧化物酶活性等生理活性的强弱就直接反映了植物对逆境胁迫环境的适应能力[9]。研究表明,桂淮品种在干旱胁迫下,叶绿素含量先下降后上升再下降,使得光合反应正常进行;淮山SOD、丙二醛等保护酶活性提高并协同作用,减少了活性氧对细胞的伤害,对干旱胁迫后的淮山进行一定时间的复水,可使植株生理生化指标恢复到对照水平,对淮山的生长具有补偿作用。干旱胁迫处理0—20 d植株复水后各项指标均恢复到对照组水平,而干旱处理25 d、30 d复水后难以恢复。说明桂淮品种在高温炎热的夏季能够忍受一定程度的持续干旱,在复水后能正常生长;但持续干旱过久(≥25 d)则严重阻滞植株的生长发育,造成难以挽回损失。
漳州是淮山的生产种植基地,且目前大面积种植本地淮山和铁棍淮山,品种单一,在一定程度上制约了产业的发展。近年来全球气候日趋变暖,干旱灾害对植物造成的危害也随之加重,给植物的栽培和生产造成了极大的影响,使得干旱胁迫成为许多地区农业生产与发展最大的障碍。漳州市淮山种植区普遍存在一方面水资源不足,另一方面又由于灌溉方式落后,大水漫灌等导致水资源利用率低的现象,在很大程度上限制了淮山栽培的进一步发展。因此,针对桂淮品种具有较强的耐旱性特点,在漳州地区推广种植对淮山产业的发展具有重要的意义。
参考文献:
[1] 吴敏,张文辉,周建云.干旱胁迫对栓皮栎幼苗细根的生长与生理生化指标的影响[J].生态学报,2014,10(4):67-70.
[2] 甄博,郭相平,陆红飞.旱涝交替胁迫对水稻分蘖期根解剖结构的影响[J].农业工程学报,2015,12(1):38-41.
[3] 井大炜,邢尚军,杜振宇.干旱胁迫对杨树幼苗生长、光合特性及活性氧代谢的影响[J].应用生态学报,2013,22(2):24-27.
[4] 梁宗锁,康绍忠,邵明安,等.土壤干湿交替对玉米生长速度及其耗水量的影响[J].农业工程学报,2000,16(5):38-40.
[5] 张寅媛,刘英,白龙.干旱胁迫对4种景天科植物生理生化指标的影响[J].草业科学,2014,31(4):724-731.
[6]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[7]武维华.植物生理学[M].2版.北京:科学出版社,2005.
[8] 孙景宽,张文辉,陆兆华,等.沙枣(Elaeagnus angustifolia)和孩儿拳头(Grewia bilobaG.Don var.parviflora)幼苗气体交换特征与保护酶对干旱胁迫的响应[J].生态学报,2009,29(3):1330-1340.
[9] 冯晓丽,梁宗锁,李国峰.水分对玄参地上部生长及叶片保护酶活性的影响[J].西北农林科技大学学报(自然科学版),2008,36 (8):229-234.

