小果型西瓜子叶节离体培养
徐洪国,宣 杨,仲娟娟,王英学,祁宏英
(齐齐哈尔大学生命科学与农林学院 黑龙江齐齐哈尔 161006)
中国作为西瓜的生产和消费大国,产量占世界总产量的60%以上[1]。随着人民生活水平的提高,居民家庭结构和饮食习惯的改变,人们对外观靓丽、品质优良、携带方便的小果型西瓜的需求日益增加,小果型西瓜种植面积和种植效益也在逐年增加。但是,西瓜遗传基础狭窄,种质资源缺乏,很多重要的性状无法通过常规育种方法进行改良。因此采用生物技术手段进行种质创新,培育优质、高产的抗病新品种已成为西瓜遗传育种研究的热点。植物组织培养技术作为生物技术的重要组成部分,越来越受到人们的关注。近年来西瓜离体培养技术己经被广泛用于离体快速繁殖[2]、基因的遗传转化[3-6]和诱导变异[7]等方面。高效组织培养和植株再生技术的建立是西瓜在生物技术研究领域的基础,西瓜子叶节无菌体系一般是通过种子去壳后在无菌条件下萌发而获得无菌苗,切取无菌苗子叶节诱导不定芽的方法而建立的。
前人已经在西瓜组织培养和植株再生方面进行了研究,但是,小果型西瓜自交品系K1由于种子较小,胚发育不良,在组织培养过程中存在出芽率低、污染率高、子叶节再生率低等问题,为了进一步探索小果型西瓜组织培养技术,以期建立小果型西瓜自交品系K1的组织培养和植株再生流程,笔者系统研究了小果型西瓜种子无菌萌发的条件及植物生长调节剂对子叶节再生不定芽的影响,为进一步完善西瓜再生体系提供理论基础。
1 材料与方法
1.1 材料
选用小果型西瓜自交品系‘K1’为试验材料,西瓜种子由齐齐哈尔大学生命科学与农林学院园艺试验室提供。试验于2016年7—12月在齐齐哈尔大学生命科学与农林学院园艺植物组织培养室进行。
1.2 试验方法
1.2.1 种子的处理 种子的处理方式如表1:(1)先浸种0、6、12 h 再分别用 0.1%升汞浸泡5、10、15 min;(2)3%(ω,下同)NaClO 浸种20 min后直接培养;(3)3%NaClO 浸种 20 min 后再浸种 6、12 h,然后再用3%NaClO消毒20 min。

表1 种子处理方式
1.2.2 种子的离体萌发 将西瓜种子去壳消毒后接入不同无菌苗诱导培养基上。无菌苗诱导培养基为 MS,1/2 MS、1/4 MS和 1/8 MS(含庶糖 30%,琼脂0.9%)。先进行3 d的暗培养,之后再进行光培养,观察其生长情况。
1.2.3 子叶节外植体的获取和培养 在无菌条件下选取苗龄5~7 d的西瓜无菌苗,切取子叶节,子叶节基部插入培养基。以MS为基本培养基,蔗糖30%,pH 5.8,用0.9%琼脂。设置不同培养基,诱导子叶节产生不定芽。
2 结果与分析
2.1 不同处理对西瓜种子萌发的影响
由表2可知,用不同的方式处理种子对种子的萌发率影响较大,浸种6 h有助于提高种子的萌发率,在浸种之前对西瓜种子带皮进行表面消毒处理可以显著减少污染率。本研究中,小果型西瓜种子最佳浸种及消毒灭菌方式为先用3%NaClO消毒20 min,无菌水浸种6 h,然后用70%酒精消毒60 s,再用3%NaClO消毒20 min,最后用无菌水清洗3次每次1 min。
2.2 不同培养基对西瓜种子萌发的影响
由表3可知,不同培养基对小果型西瓜种子萌发的影响很大,虽然西瓜种子在4种培养基上均能萌发,但在1/8 MS培养基上的萌发率最高,达到94.1%,而且萌发迅速,幼苗生长健壮。

表2 不同处理对种子萌发及污染的影响

表3 不同培养基对西瓜种子萌发的影响
2.3 不同质量浓度激素配比对西瓜子叶节不定芽诱导的影响
将外植体分别接种于不定芽诱导培养基中培养,比较不同生长激素对不定芽诱导的影响,其结果如表4。经过2周时间左右,绝大部分子叶的切口处都会生长出绿色的小芽。由表4可知,这些不定芽诱导培养基全部都可以诱导出不定芽,但是其诱导结果却大不相同,其中,在MS培养基中附加BA 2.0 mg·L-1、NAA 0.1 mg·L-1的激素配比的不定芽诱导率在本试验中最高;而其他的激素配比都是不如甚至相差很大。有上述的试验结果表明,西瓜子叶节诱导不定芽的最佳培养基为MS培养基中附加 BA2.0 mg·L-1、NAA0.1 mg·L-1。
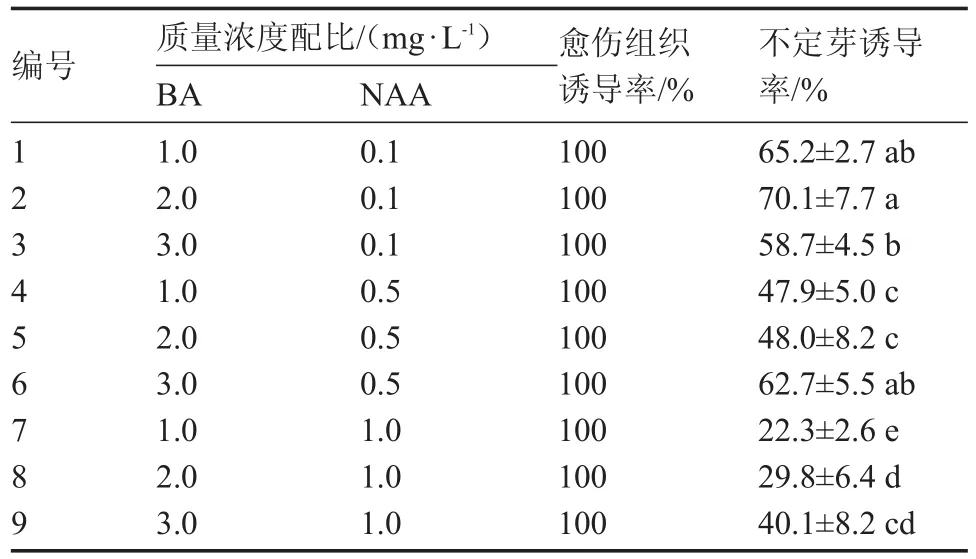
表4 不同处理对西瓜子叶节不定芽诱导的影响
3 讨论与结论
3.1 西瓜无菌苗的获得
小果型西瓜由于种子较小,胚发育不良,含内源菌[8]等原因,在组织培养过程中存在出芽率低、污染率高、种子发芽不整齐甚至丧失发芽能力等问题较为突出,本试验从多方面研究了小果型西瓜种子浸种与消毒灭菌的影响因素。因为西瓜的种皮比较坚硬[9],所以要在种子发芽之前要对种子进行浸泡处理,一般浸泡6 h左右对发芽率的提高最有利,在浸种之前对西瓜种子带皮进行表面消毒处理可以显著减少污染率,这可能是由于在浸种之前对种子进行表面消毒可以减少外部细菌的渗入。
3.2 西瓜子叶节不定芽的诱导
在进行西瓜子叶节的再生培养时,子叶节的愈伤组织诱导率达到100%,然后从愈伤组织中诱导出不定芽。因此,子叶节作为外植体可以通过愈伤组织途径,诱导愈伤组织后再进一步分化形成再生植株。激素是诱导外植体产生不定芽的重要因素之一。不同的激素类型和浓度配比对不定芽影响明显。很多学者对此也进行了研究。研究结果均为一定浓度的6-BA是诱导西瓜外植体分化所必须的激素,附加低浓度的IAA、IBA或者NAA则有利于不定芽的诱导分化,但是不同基因型的西瓜不定芽诱导率存在一定的差异[10-16]。本研究结果表明,生长素与细胞分裂素的组合在促进西瓜子叶节不定芽诱导方面起着重要的作用,从本试验的结果可以看出,通过设置不同的浓度配比最终选择出最适合诱导西瓜不定芽的激素配比。本研究中当BA 2.0 mg·L-1、NAA 0.1 mg·L-1的配比能使小果型西瓜自交品系‘K1’不定芽的诱导率达到最高达到70.1%。
[1]杨艳涛,张琳,吴敬学.2011年我国西甜瓜市场及产业发展趋势与对策分析[J].北方园艺,2012(15):183-187.
[2]COMPTON M E,GRAYD,ELMSTROM GW.Asimple protocol for micropropagating diploid and tetraploid watermelon using shoot-tip explants[J].Plant Cell,Tissue and Organ Culture,1993,33(2):211-217.
[3]LI J,TANG Y,QIN Y,et al.Agrobacterium-mediated transformation of watermelon(Citrullus lanatus)[J].African Journal of Biotechnology,2012,11(24):6450-6456.
[4]张志忠,吴菁华,吕柳新.根癌农杆菌介导的西瓜遗传转化研究[J].果树学报,2005,22(2):134-137.
[5]李娟,李万宁,唐懿,等.根癌农杆菌介导的西瓜遗传转化研究进展[J].中国蔬菜,2010(8):7-13.
[6]任俊杰,王丽霞,高洪波,等.农杆菌介导的西瓜枯萎病菌遗传转化[J].植物保护,2015,41(1):93-97.
[7]杨国志,张明方,顾掌根,等.NaN3处理条件下西瓜直接再生试验体系研究[J].长江蔬菜,2009(3):11-14.
[8]唐炎英.干热处理对西瓜种子活力及细菌性果斑病灭菌效果影响的研究[D].长沙:湖南农业大学,2014.
[9]戴思慧,孙小武,熊兴耀,等.三倍体西瓜种子萌发障碍与种皮的关系[J].湖南农业大学学报(自然科学版),2012,38(4):392-397.
[10]DONG J Z,JIA S R.High efficiency plant regeneration from cotyledons of watermelon(Citrullus vulgarisSchrad.)[J].Plant Cell Reports,1991,9(10):559-562.
[11]SRIVASTAVA D R,ANDRIANOV V M,PIRUZIAN E S.Tissue culture and plant regeneration of watermelon(Citrullus vulgarisSchrad.cv.Melitopolski)[J].Plant Cell Reports,1989,8(5):300-302.
[12]GANASAN K,HUYOP F.In vitroregeneration ofCitrullus lanatuscv.Round Dragon[J].Journal of Biological Sciences,2010,10(2):131-137.
[13]LI J,LI X M,QIN Y G,et al.Optimized system for plant regeneration of watermelon(Citrullus lanatusThumb.)[J].African Journal of Biotechnology,2013,10(48):9760-9765.
[14]张志忠,吴菁华,吕柳新.西瓜高频再生系统的研究[J].中国农学通报,2004,20(2):151-153.
[15]孙治图,许勇,张海英,等.西瓜离体再生高效基因型材料的筛选[J].中国瓜菜,2008,21(3):5-9.
[16]程永强,李喜焕,王静华,等.‘京欣一号’父本西瓜组织培养研究[J].河北农业大学学报,2009,32(2):58-60.

