大汶河-东平湖CDOM的荧光特征及与营养物质的耦合关系
吕伟伟,姚昕,,张保华
1. 聊城大学环境与规划学院,山东 聊城 252000;2. 中国科学院南京地理与湖泊研究所//湖泊与环境国家重点实验室,江苏 南京 210008
有色可溶性有机物(Chromophoric Dissolved Organic Matter,CDOM)是水体中重要的有机碳库,占DOC的60%以上(段洪涛等,2009),在全球碳循环过程中起着重要的作用;并极大地影响光在水生环境中的传播等相关过程,对紫外辐射具有强烈的吸收作用,能够减少紫外线辐射对水生生态系统的影响(Williamson et al.,1996;Laurion et al.,2000)。另外,CDOM 也可以吸收可见光部分,影响浮游植物初级生产力以及生物量,同时容易发生光降解,矿化分解为无机盐和小分子有机物,为水生植物和浮游生物提供营养物质,并释放CO2、CH4等温室气体,加剧温室效应(Doxaran et al.,2002;Odermatt et al.,2012)。
CDOM因其重要性及其化学组成、结构和来源复杂,一直是生物地球化学领域的研究热点之一,近年来在内陆湖泊中也开展了大量的研究工作。例如,Zhang et al.(2009)通过野外和实验调查研究了浮游植物降解对CDOM的贡献;Yao et al.(2011)运用三维荧光技术报道了太湖水体 CDOM 的来源特征;周永强等(2013)运用三维荧光光谱结合平行因子分析法对洪湖、东湖与梁子湖 CDOM 组成特征进行了分析。三维荧光技术可有效区分有机物的组成成分,且操作简便,不对样品造成二次污染,目前已有较多学者采用三维荧光技术对 CDOM 进行定量和定性表征。然而,关于大汶河对东平湖CDOM贡献的研究鲜见报道。
东平湖作为南水北调东线工程最后一级调水湖,同时也是山东省西水东送的水源地,其水质状况对水输入地用水安全极为重要。近年来,随着流域内特别是大汶河流域人口经济的快速发展,以及水资源不合理利用,使得东平湖和大汶河富营养化,同时有机物污染较为严重(邢友华等,2010)。因此,揭示大汶河输入对东平湖 CDOM 的贡献,对维持湖区生态系统的平衡和可持续发展有重要的理论指导意义。基于此,本研究运用三维荧光技术(Three-dimensional Excitation-Emission Matrix Fluorescence Spectra,EEMs)结合平行因子分析法(Parallel Factor Analysis,PARAFAC)对大汶河和东平湖水体 CDOM 的荧光特征及其与各水质参数之间的关系进行分析,以期为东平湖入流污染控制及治理提供依据。
1 材料与方法
1.1 样品采集与预处理
2014年8月24—26日,在大汶河和东平湖采集了共计43个表层水体样品用于CDOM三维荧光光谱的测定及分析。其中,在大汶河由汶口坝至下游河口均匀布设7个采样点,编号依次为-7到-1。在东平湖内的 36个采样点中选取沿入湖河口向北部湖区出湖口均匀分布的7个采样点,编号为1-7,入湖河口点位编号为0(图1)。采集水体表层0.5 m深处的水样5 L,置于保温箱中用冰块冰冻保存。所有采样瓶均先用10% HCl溶液浸泡、去离子水清洗及用现场水润洗,并于采样结束后直接送至实验室放入冰箱内冷藏、冷冻保存(周永强等,2013)。水体温度、水深、浊度等物理指标均在采样现场测定。CDOM三维荧光光谱分析均在采样结束后2~3 d内完成。
1.2 样品的测定
1.2.1CDOM三维荧光光谱分析
所有样点的各平行水样用0.45 µm的玻璃纤维滤膜(GF/F)(预先于450 ℃灼烧)过滤,用1020型TOC仪测定滤后水中DOC质量浓度,经GF/F膜过滤的水样再用0.22 µm孔径的微孔膜过滤后测定CDOM的三维荧光。
三维荧光光谱采用日立F-7000 FL分光光度计测定,激发和发射夹缝宽度为 5 nm,激发波长为200~450 nm,间隔为5 nm,发射波长250~600 nm,以1 nm间隔得到荧光光谱,减去加酸中和过后的NaOH三维荧光光谱以校正水的拉曼散射,同时利用0.01 mg·L-1硫酸奎宁进行荧光定标,并用吸光度校正三维荧光光谱的内滤效应(Mcknight et al.,2001)。
1.2.2CDOM 三维荧光光谱的平行因子分析法(PARAFAC)
EEM 是通过波谱形状或波峰数量进行组分个数和类别的假定,而PARAFAC法是通过数学统计的方法把OM复杂的荧光数据矩阵分离成不同的组分,将所有点位的整个三维荧光数据组分解成3个线性项和1个残留数组,它是基于三线性理论的一种方法(Yao et al.,2012)。PARAFAC法计算过程可以称为交替最小二乘(ALS)算法:

i=1, 2, …...I;j=1, 2, …..J;k=1, 2, ……K
式中,Xijk是第i个样点再激发波长为k、发射波长为j处的荧光强度;aif是第i个样点的第f次分析的含量;bjf和ckf分别是与第f次分析后激发波长为j、发射波长为k光谱的线性相关。eijk为系统残差,是不受模型控制的变量。F为模型中选择的组分因子数量。
本研究在MATLAB中使用DOMFluor工具箱运行PARAFAC法模型对样点的三维荧光数据进行分析。
1.2.3其他水质参数的测定
采用分光光度法测定Chla质量浓度,高锰酸钾法测定 COD质量浓度,碱性过硫酸钾消解紫外分光光度法测定总氮(TN)质量浓度,钼酸铵分光光度法测定总磷(TP)质量浓度。具体测定方法参考文献(金相灿等,1990)。
1.3 绘图及数据处理
采用ArcGIS 10.2软件绘制参数空间分布图与采样点分布图,均值、标准差以及相关性等采用SPSS 21.0软件进行分析。相关分析用来检测变量之间的关系;P>0.05表示未达到显著检验水平,0.01<P<0.05为显著水平,P<0.01为极显著水平。
2 结果与讨论
2.1 东平湖水体各水质参数分布特征
由图1可知,大汶河与东平湖水质参数存在一定的差异。大汶河与东平湖 TN质量浓度分别在5.22~9.41 mg·L-1和 0.79~3.73 mg·L-1之间变化,均值分别为(7.34±1.23) mg·L-1和(2.07±0.93) mg·L-1。TN质量浓度明显表现出河流值大于湖泊值(t=9.262,P=0.000),整体表现出由大汶河汶口坝向东平湖出湖口递减的趋势,表明以农业为主的土地利用方式造成了大量氮元素直接从大汶河输入东平湖;姚昕等(2016)也发现东平湖TN高值区集中在大汶河入湖区,东平湖氮元素主要受大汶河输入的影响。大汶河与东平湖TP质量浓度分别在0.05~0.19 mg·L-1和 0.06~0.12 mg·L-1之间变化,均值分别为(0.08±0.02) mg·L-1和(0.08±0.01) mg·L-1。大汶河和东平湖TP含量差异不显著,沿河流流向从汶口坝至大汶河口TP质量浓度逐渐降低,不过在东平湖内又有所回升。这可能是受到大汶河周边村镇大量生活生产废水输入的影响,导致河流中含有大量的磷元素,随着河流的稀释自净及分解作用,TP质量浓度逐渐降低;由于东平湖北部湖区围网养殖区域的磷肥施用及旅游区废水排放,TP质量浓度又有所回升。

图1 大汶河和东平湖采样点及各理化因子的空间分布Fig. 1 Distribution of the sampling sites and water quality parameters in Dongping Lake and Dawen River in summer
大汶河与东平湖 Chla质量浓度分别在 4.02~110.92 mg·L-1和 32.60~79.25 mg·L-1之间变化,均值分别为(30.94±12.20) mg·L-1和(51.87±5.80) mg·L-1。大汶河与东平湖 COD质量浓度分别在 4.80~8.50 mg·L-1和 7.00~8.50 mg·L-1之间变化,均值分别为(6.18±0.50) mg·L-1和(7.70±0.21) mg·L-1。Chla 和COD呈现和TP相似的空间分布特征,但Chla和COD均值均表现为湖泊大于河流,这应该与湖泊富营养化有关。根据Chla质量浓度对照中国湖泊富营养化评价标准,判定东平湖目前仍处于中富-富营养化水平,这与姚昕等(2016)的研究结果一致。大汶河与东平湖 DOC质量浓度分别在 3.24~3.47 mg·L-1和 3.72~4.40 mg·L-1之间变化,均值分别为(3.38±0.14) mg·L-1和(4.1±0.25) mg·L-1。DOC 质量浓度明显表现出湖泊大于河流(t=-7.025,P=0.000),整体表现出由大汶河汶口坝向东平湖出湖口递增的趋势。这可能是由于采样时间属于雨季,大量降雨导致河流水量增大,对原有河流中 DOC表现出稀释作用;除此之外,DOC组成可以分为有色和无色两部分,河流外源输入以有色 DOC为主,浮游植物降解等内源产生更多的无色 DOC(Zhang et al.,2009),当进入湖泊之后浮游植物降解等内源产生的无色DOC补充到总DOC中,从而形成了由大汶河汶口坝向东平湖出湖口递增的“异常”结果,这与调查采样的瞬时性不无关系。
2.2 东平湖及大汶河CDOM三维荧光特征
图2所示为大汶河上游、入湖区和出湖区典型站点三维荧光图谱。从图2可知,肉眼基本上可以识别的荧光峰一般有4个,其中包括2个类腐殖质荧光峰A、C峰,2个类蛋白荧光峰B、D峰,这与刘明亮等(2009)的研究结果一致(。不同站点4个荧光峰的位置和强度存在一定的差异。从3个站点的对比来看,大汶河上游荧光峰强度最强,特别是2个类蛋白荧光峰显著高于类腐殖质荧光峰,而到出湖区类腐殖质荧光则高于类蛋白荧光。从大汶河上游到出湖区,类蛋白荧光明显下降,类腐殖质荧光明显增强,反映了大汶河外源输入主要带来类蛋白物质。
将2014年8月的43个CDOM三维荧光样品全部放入PARAFAC模型中进行计算,一共得到4种荧光组分(C1~C4)(图 3)。这 4种荧光组分的光谱特征与文献报道的其他水生环境中得到的荧光组分很相似(Murphy et al.,2008;Yamashita et al.,2008;Stedmon et al.,2005a;Williams et al.,2010;Kowalczuk et al.,2010),各组分的主要特征和荧光类型见表1。由图3和表1可知,C1在最大发射波长386 nm处有两个最大激发波长,分别是<225 nm和305 nm,其峰值与类腐殖质荧光峰A峰、M峰相似,表征的是陆源短波类腐殖质和浮游植物降解产生的类腐殖质(Murphy et al.,2008;Yamashita et al.,2008)。C2最大激发波长和最大发射波长分别是240 nm和360 nm,对应的是类蛋白峰T峰,但相比传统T峰发生的红移,表征的是类蛋白荧光中生物降解的类色氨酸基团(Stedmon et al.,2005a;Williams et al.,2010)。C3最大激发波长在 260 nm,最大发射波长在432 nm,其峰值对应类腐殖质峰A峰,表征陆源类腐殖质(Kowalczuk et al.,2010;Williams et al.,2010)。C4有两个最大激发波长,分别在<225 nm和275 nm处,最大发射波长在304 nm,对应类蛋白峰B峰、D峰,代表的是生物降解来源的类酪氨酸物质(Yamashita et al.,2008;Stedmon et al.,2005b)。

图2 大汶河到东平湖典型站点的三维荧光图谱Fig. 2 3DEEMs of typical sampling sites from river to open water
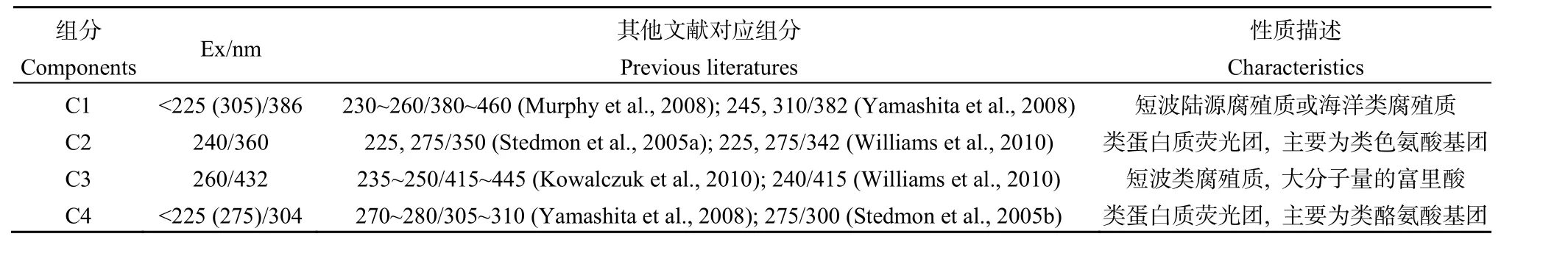
表1 有色溶解性有机物4组分荧光特征Table 1 Fluorescence Characteristics of four Components of Chromophoric Dissoived Organic Matter
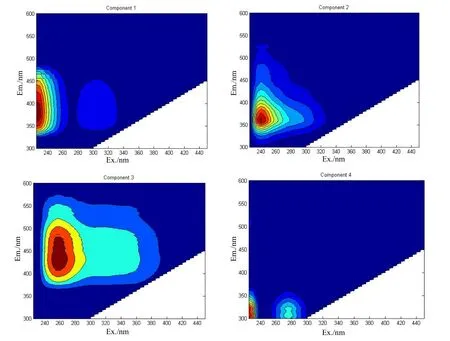
图3 大汶河和东平湖CDOM各荧光组分Fig. 3 Spectral shapes of the four components identified by PARAFAC
东平湖及大汶河 CDOM 总荧光强度差异不显著(t=0.949,P=0.360),整体取值范围在 28.62~54.43 QSU之间,均值为(36.48±1.57) QSU,沿河流流向从汶口坝至大汶河口荧光强度逐渐降低,不过在东平湖内又有所回升(图4)。这可能是受到大汶河周边村镇大量生活生产废水输入的影响,导致河流携带大量的荧光物质,随着河流的稀释自净及分解作用,荧光强度逐渐降低,由于东平湖北部湖区围网养殖以及旅游区大量废水的输入,荧光强度又有所回升。

图4 CDOM总荧光强度及各组分占比Fig. 4 Total fluorescence intensity and specific gravity of each component of CDOM
东平湖水体类腐殖质荧光强度较河流高(t=-4.405,P=0.001),表现为由大汶河汶口坝向东平湖出湖口递增的趋势(图4),与季乃云等(2006)在大沽河-胶州湾段发现的CDOM变化趋势结果较为一致;这可能是由于水体中有机物质逐渐腐殖化或土壤中腐殖质不断输入到湖水中造成的(季乃云等,2006)。大汶河类蛋白荧光强度较湖区高(t=2.408,P=0.032),呈现由大汶河汶口坝向东平湖出湖口递减的趋势(图4);方芳等(2010)在三峡水库小江回水区也获得了类似的结论。
从各组分对总荧光强度的贡献率来看,由于总荧光强度差异不显著,从大汶河到东平湖,类腐殖质组分贡献越来越大,类蛋白组分贡献率越来越小(图4)。总体而言,大汶河输入类腐殖质荧光较少,主要输入类蛋白荧光。一般而言,较洁净水体中通常类腐殖质荧光强度比较高,有时甚至只有类腐殖质荧光(McCallister et al.,2006),而受生活及工农业废水污染的河流 CDOM 的三维荧光光谱图中往往类蛋白荧光强度极强(Baker,2002)。大汶河类蛋白荧光较强应该与大汶河沿岸城镇生活与工业废水的大量输入、周边村落生活污水的直接排入有关;另外,由水体中大量微生物产生的类蛋白物质也是不容忽视的。王志刚等(2006)在巢湖CDOM来源分析研究中也得出了类似结论,认为受生活及工农业废水污染严重的河流输入会带来大量类蛋白荧光物质。
2.3 大汶河、东平湖荧光强度与营养物质的耦合关系
很多研究认为CDOM荧光强度与Chla存在显著的相关性,如江俊武等(2017)的研究表明,CDOM的荧光强度与Chla之间存在极显著相关关系;季乃云等(2006)指出,高Chla含量的水域对应着高类蛋白荧光强度。但也有不少研究发现二者并无显著相关性,如方芳等(2010)研究发现三峡水库小江回水区CDOM荧光强度和Chla相关性较差;Mayer et al.(1999)对Maine河口的研究表明,不同区域类蛋白荧光强度与 Chla的相关性既有呈正相关的,也有呈负相关的。本研究结果显示,Chla仅与大汶河CDOM类蛋白组分C2、C4存在极好的相关性(图5a),这表明浮游植物是大汶河CDOM类蛋白荧光的主要来源;而东平湖类蛋白荧光强度和类腐殖质荧光强度与Chla相关性不显著(图5a)。可能的原因有,河流中的类腐殖质物质除了其中的浮游植物外,还有另一个甚至更重要的来源就是土壤腐殖质,大汶河主要流经农村地区,土壤、农田堆肥和腐烂植物等中的腐殖质会随雨水和灌溉水等进入河流,使河流中腐殖质的含量增加(季乃云等,2006),从而导致类腐殖质荧光强度与 Chla含量相关关系不显著。相对于类腐殖质荧光物质,类蛋白荧光物质受微生物影响较大,除了水体中的浮游植物之外,排入河流的工业废水和生活污水中也携带有大量微生物,且污染物质的大量输入会加剧水体中微生物活动(方芳等,2010),大汶河沿岸生活污水和工业废水排放量较大,且大多是未经处理排入水体,从而导致类蛋白荧光强度与Chla含量相关关系不显著。

图5 荧光强度与水质参数的相关分析Fig. 5 Correlation between fluorescence intensity and water quality parameters
溶解性有机碳(DOC)是以碳含量表示水体中有机物含量的指标。CDOM荧光强度与DOC中可发射荧光的物质有关,通常天然水体 DOC中荧光物质含量在 40%~60%之间(Leenheer et al.,2003)。很多研究者致力于探讨荧光强度与DOC的相关性,并试图通过荧光特征来反演 DOC含量。其中,很多研究认为二者有显著的相关性甚至存在线性关系,如Ferrari(2000)研究表明,Rhone河流和近岸水体中类腐殖质荧光与 DOC存在一定正相关关系,相关系数r大于0.5;季乃云等(2006)指出,CDOM的荧光强度与DOC之间存在线性关系;刘学利等(2016)报道,东平湖 CDOM 的荧光强度与 DOC存在显著相关关系。但也有不少研究发现二者并没有显著相关性,如宋晓娜等(2010)指出,太湖水体溶解性有机物荧光强度与 DOC之间相关性不显著;Chen et al.(2002)的研究结果显示,海洋CDOM样品的荧光强度与DOC之间并无显著相关性;傅平青等(2007)在研究高原湖泊CDOM时也发现,同一次采样过程中垂直剖面不同深度CDOM中的DOC与其不同荧光峰强度之间相关性不显著,原因可能是样品中含有一些不能发射荧光的天然有机质或有机污染物。由图 5b可知,东平湖类腐殖质组分C1、C3与DOC具有极显著相关性,这表明类腐殖质是东平湖 DOC的重要组成部分;而大汶河CDOM各组分均与DOC相关性不显著(P>0.05),可能是因为CDOM在大汶河中受光降解、微生物降解等作用以及水体pH的影响,造成大汶河 CDOM 组分中的腐殖酸、富里酸、蛋白类物质以及一些非荧光类物质在 DOC中所占比例不同。
化学需氧量(COD)反映了水中可被氧化剂氧化的有机物含量(季乃云等,2006),由于水体被有机物污染是很普遍的现象,该指标也作为有机物相对含量的综合指标之一。由图 5c可知,大汶河CDOM组分C2和东平湖CDOM组分C1均与COD具有相关性,这表明荧光强度在一定程度上可以反映被氧化的有机物含量。季乃云等(2006)研究了从大沽河到胶州湾的DOM荧光特征变化,发现类腐殖质荧光强度与 COD之间存在较好的相关性,r=0.940;方芳等(2010)也发现,小江回水区3种荧光峰的荧光强度与COD存在较好的相关性。
3 结论
(1)通过三维荧光图谱及平行因子分析法得出所有样品点都含有4类荧光组分,即2种类蛋白组分及2种类腐殖质组分;从大汶河汶口坝到东平湖出湖口处,类腐殖质荧光强度逐渐增强,类蛋白荧光强度呈递减趋势,且大汶河类蛋白荧光较东平湖高(t=2.408,P=0.032),反映了夏季丰水期大汶河主要向东平湖输入类蛋白荧光物质。
(2)东平湖CDOM荧光组分C1、C3与DOC存在较好的相关性,表明类腐殖质物质是东平湖DOC的重要组成部分;东平湖荧光组分C1、大汶河荧光组分C2均与COD具有相关性,说明荧光强度可以间接反映水体中被氧化的有机物含量;大汶河类蛋白荧光组分C2、C4均与Chla存在相关关系,表明浮游植物是大汶河类蛋白物质的重要来源。
参考文献:
BAKER A. 2002. Fluorescence excitation-emission matrix characterization of river waters impacted by a tissue mill effluent [J]. Environmental Science & Technology, 36(7): 1377-1382.
CHEN J, GU B, LEBOEUF E J, et al. 2002. Spectroscopic characterization of the structural and functional properties of natural organic matter fractions [J]. Chemosphere, 48(1): 59-68.
DOXARAN D, FROIDEFOND J M, LAVENDER S J, et al. 2002. Spectral signature of highly turbid waters application with SPOT data to quantify suspended particulate matter concentrations [J]. Remote Sensing of Environment, 81(1): 149-161.
FERRARI G M. 2000. The relationship between chromophoric dissolved organic matter and dissolved organic carbon in the European Atlantic coastal area and in the West Mediterranean Sea [J]. Marine Chemistry,70(4): 339-359.
KOWALCZUK P, COOPER W J, DURAKO M J, et al. 2010.Characterization of dissolved organic matter fluorescence in the South Atlantic Bight with use of PARAFAC model: Relationships between fluorescence and its components, absorption coefficients and organic carbon concentrations [J]. Marine Chemistry, 118(1-2): 22-36.
LAURION I, VENTURA M, CATALAN J, et al. 2000. Attenuation of ultraviolet radiationin mountain lakes: Factors controlling the among and within-lake variability [J]. Limnology and Oceanography, 45(6):1274-1288.
LEENHEER J A, CROUE J P. 2003. Characterizing aquatic dissolved organic matter [J]. Environmetal Science & Technology, 37(1): 18-26.MAYER L M, SCHIK L L, LODER T C. 1999. Dissolved protein fluorescence in two Maine estuaries [J]. MarineChemistry, 64(3):171-179.
MCCALLISTER S L, BAUER J E, DUCKLOW H W, et al. 2006. Sources of estuarine dissolved and particulate organic matter: a multi-trace approach [J]. Organic Geochemistry, 37(4): 454-468.
MCKNIGHT D M, BOYER E W, WESTERHOFF P K, et al. 2001.Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity [J]. Limnology and Oceanography, 46(1): 38-48.
MURPHY K R, STEDMON C A, WAITE T D, et al. 2008. Distinguishing between terrestrial and autochthonous organic matter sources in marine environments using fluorescence spectroscopy [J]. Marine Chemistry,108(1-2): 40-58.
ODERMATT D, GITELSON A, BRANDO V E, et al. 2012. Review of constituent retrieval in optically deep and complex waters from satellite imagery [J]. Remote Sensing of Environment, 118: 116-126.
STEDMON C A and MARKAGER S. 2005a. Tracing the production and degradation of autochthonous fractions of dissolved organic matter by fluorescence analysis [J]. Limnology and Oceanography, 50(5):1415-1426.
STEDMON C A and MARKAGER S. 2005b. Resolving the variability in dissolved organic matter fluorescence in a temperate estuary and its catchment using PARAFAC analysis [J]. Limnology and Oceanography, 50(2): 686-697.
WILLIAMS C J, YAMASHITA Y, WILSON H F. 2010. Unraveling the role of land use and microbial activity in shaping dissolved organic matter characteristics in stream ecosystems [J]. Limnology and Oceanography,55(3): 1159-1171.
WILLIAMSON C E, STEMBERGER R S, MORRIS D P. 1996. Ultraviolet radiation in North American lakes: Attenuation estimates from DOC measurements and implications for plankton communities [J].Limnology and Oceanography, 41(5): 1024-1034.
YAMASHITA Y, JAFFE R, MAIE N, et al. 2008. Assessing the dynamics of dissolved organic matter in coastal environments by excitations emission matrix fluorescence and parallel factor analysis [J].Limnology and Oceanography, 53(5): 1900-1908.
YAO X, ZHANG Y L, ZHU G W, et al. 2011. Resolving the variability of CDOM fluorescence to differentiate the sources and fate of DOM in Lake Taihu and its tributaries [J]. Chemosphere, 82(2): 145-155.
YAO X, ZHU G W, CAI L L, et al. 2012. Geochemical characteristics of amino acids in sediments of Lake Taihu, a large, shallow, eutrophic freshwater lake of china [J]. Aquatic Geochemistry, 18: 263-280.
ZHANG Y L, VANDIJK M A, LIU M L, et al. 2009. The contribution of phytoplankton degradation to chromophoric dissolved organic matter(CDOM) in eutrophic shallow lakes: Field and experimental evidence[J]. Water Research, 43(18): 4685-4697.
段洪涛, 马荣华, 孔维娟, 等. 2009. 太湖沿岸水体 CDOM 吸收光谱特征[J]. 湖泊科学, 21(2): 242-247.
方芳, 翟端端, 郭劲松, 等. 2010. 三峡水库小江回水区溶解性有机物的三维荧光光谱特征[J]. 长江流域资源与环境, 19(3): 323-328.
傅平青, 吴丰昌, 刘丛强, 等. 2007. 高原湖泊溶解有机质的三维荧光光谱特性初步研究[J]. 海洋与湖沼, 38(6): 513-519.
季乃云, 赵卫红, 王江涛, 等. 2006. 大沽河-胶州湾段溶解有机物类腐殖质荧光特征变化[J]. 环境科学, 27(6): 1073-1077.
江俊武, 李帅东, 沈胤胤, 等. 2017. 夏季太湖 CDOM 光学特性空间差异及其来源解析[J]. 环境科学研究, 30(7): 1020-1030.
金相灿, 屠清瑛. 1990. 湖泊富营养化调查规范[M]. 第二版. 北京: 中国环境科学出版社.
刘明亮, 张运林, 秦伯强. 2009. 太湖入湖河口和开敞区CDOM吸收和三维荧光特征[J]. 湖泊科学, 21(2): 234-241.
刘学利, 姚昕, 董杰, 等. 2016. 东平湖可溶性有机物的荧光特征及环境意义[J]. 生态与农村环境学报, 32(6): 933-939.
宋晓娜, 于涛, 张远, 等. 2010. 利用三维荧光技术分析太湖水体溶解性有机质的分布特征及来源[J]. 环境科学学报, 30(11): 2321-2331.
王志刚, 刘文清, 李宏斌, 等. 2006. 三维荧光光谱法分析巢湖 CDOM的空间分布及其来源[J]. 环境科学学报, 26(2): 275-279.
邢友华, 董洁, 李晓晨, 等. 2010. 东平湖表层沉积物中磷的吸附容量及潜在释放风险分析[J]. 农业环境科学学报, 29(4): 746-751.
姚昕, 孙将凌, 董杰, 等. 2016. 东平湖 CDOM 的光谱吸收特征及环境指示意义[J]. 光谱学与光谱分析, 36(10): 3232-3236.
周永强, 张运林, 牛城, 等. 2013. 基于EEMs及PARAFAC的洪湖、东湖与梁子湖 CDOM 组成特征分析[J]. 光谱学与光谱分析, 33(12):3286-3292.
——东平湖增殖放流活动实施

