双抗原夹心时间分辨荧光免疫法检测梅毒螺旋体特异性总抗体的性能研究
谭玉华,雷泽洪,郑 丹,刘 灿,赵凡一
(1.广州市丰华生物工程有限公司体外诊断试剂研发中心,广州 510730; 2.江门市中心医院检验科,中山大学附属江门医院,广东江门 529000; 3.中山大学附属第一医院东院检验科,广州 510700)
梅毒是由梅毒螺旋体(treponema pallidum,TP)感染引起的传染性强、危害较大的人类性传播疾病。梅毒可引起神经、心血管等多系统损害,甚至威胁生命,梅毒可通过胎盘传染胎儿,导致自发性流产、死产或先天梅毒等,并且感染梅毒可促进艾滋病的传播。90年代末以来,中国梅毒报告病例数明显增加,流行呈现快速上升趋势。2009年梅毒报告病例数在我国甲乙类传染病报告中居第三位。感染TP后及早地发现并进行规范治疗可以达到临床治愈,加强对梅毒的普查,已成为防止该疾病蔓延的重要手段。TP的体外培养技术迄今仍未解决,因此微生物检查和血清学筛查成为目前筛选和确诊梅毒感染的主要途径。随着TP全基因序列的破译以及基因工程技术的进步,当前TP重组抗原的基因研究已由单基因发展到多表位嵌合基因,部分基因研究已通过原核生物表达成功,解决了TP血清学研究的抗原瓶颈问题。有研究[1]报道TP基因重组抗原在梅毒筛查中具有相当高的灵敏度和特异度。笔者对应用多表位嵌合重组抗原的双抗原夹心时间分辨荧光免疫法(time-resolved fluoroimmunoassay,TRFIA)检测TP特异性总抗体的性能进行了研究,现报道如下。
1 材料和方法
1.1标本来源按《梅毒诊断标准》[2]诊断,选择具有TP感染症状/体征、相似症状或与传染源有密切接触史的就诊病人血清样本458例用于临床比对试验研究。
1.2主要试剂梅毒甲苯胺红不加热血清试验(TRUST)诊断试剂(北京万泰生物药业股份有限公司),TP抗体检测试剂盒(胶体金法,CGT)[英科新创(厦门)科技有限公司],TP抗体检测试剂盒(凝集法,TPPA)(日本富士瑞必欧株式会社),TP抗体诊断试剂盒(酶联免疫法,ELISA)(上海科华生物工程股份有限公司),TP抗体测定试剂盒(TRFIA)(广州市丰华生物工程有限公司);TP,心磷脂IgG抗体检测试剂盒(欧蒙印迹法-免疫印迹法,WB)(德国欧蒙医学诊断有限公司);第二套TP抗体国家参考品(中国食品药品检定研究院);TP IgG和IgM抗体血清(冻干)标准物质GBW09158,TP抗体临床科研血清盘(中国卫生部临床检验中心);TP抗体血清(液体)标准物质GBW(E)090157,GBW(E)090081,GBW(E)090082,GBW(E)090083(北京康彻思坦生物技术有限公司)。
1.3主要仪器AutoTRFIA-8型自动荧光免疫分析仪(广州市丰华生物工程有限公司),RT-2100C型酶标分析仪(深圳雷杜生命科学股份有限公司)。
1.4方法检测方法严格按照试剂盒和仪器说明书操作,并按试剂盒说明书对结果进行判读。TRFIA试剂的参考值采用2.50 mIU/ml。TP抗体临床科研血清盘样本40份经TRUST,CGT,ELISA,TPPA和WB 5种方法标化,以WB检测结果为标准,然后再用TRFIA法对比检测。TRFIA试剂与TPPA试剂进行临床样本比对试验研究,比对不符的样本再经CGT和ELISA 2种方法进行复测。
1.5性能评价参考文献[3,4]的方法对TP抗体测定试剂盒(TRFIA)的精密度、检测低限、准确度、线性、参考品符合率等分析性能指标进行评价。
1.6统计学分析TRFIA测量所得荧光计数采用TRFIA仪上随机配备的分析软件进行数据分析。其它统计结果数据采用SPSS13.0和Microsoft Excel软件进行统计分析。2种试剂间结果比较采用χ2检验,P<0.05为差异具有统计学意义;等效性采用Kappa检验,κ>0.75,为高度一致,认为两系统等效;0.4≤κ≤0.75认为一致,但需进一步进行相关统计学分析;κ<0.4则认为两系统不一致,两系统不等效。
2 结果
2.1精密度见表1。TRFIA试剂检测GBW(E)090157,GBW(E)090081,GBW(E)090082,GBW(E)090083四个血清标准物质,分别进行批内和批间检测20次,批内和批间变异系数(coefficient of variation,CV)均小于10%。
表1

TRFIA试剂检测质量控制品的精密度结果
2.2检测低限TRFIA试剂对0 mIU/ml的校准品平行检测20次,检测荧光值为1 541.94±592.15,采用95%的可信限计算检测低限为2 726.23,代入标准曲线计算浓度为0.05 mIU/ml。
2.3准确度与线性将浓度为1.27 IU/ml的血清(冻干)标准物质GBW09158复溶后,用含50 g/L BSA的50 mmol/L,pH7.8的Tris-HCl稀释液准确稀释成1.50,4.50,13.50,65.00和155.00 mIU/ml,TRFIA试剂的实测均值与理论值的相对偏倚分别为-4.00%,-3.33%,-5.11%,2.63%和0.14%,实测均值与理论值的线性回归方程为Y=1.005X-0.035 1,r=0.999 9。
2.4国家参考品检测见表2。TRFIA试剂检测第二套TP抗体国家参考品,20份阴性参考品(N1~N20)的符合率为20/20;10份阳性参考品(P1~P10)的符合率为10/10;1份精密度参考品的CV为4.88% (n=10);4份灵敏度样品的结果符合L1,L2,L3为阳性,L4为阴性。
表2

TRFIA试剂检测第二套TP抗体国家参考品的结果
2.5血清盘比对试验见表3。40例TP抗体临床科研血清盘样本经5种方法标化后,共17例TP抗体阴性,23例TP抗体阳性。以标化结果为标准,TRFIA试剂检测的阴性符合率为17/17,阳性符合率为23/23。
表3

临床科研血清盘40份样本的比对结果
2.6临床比对试验TRFIA试剂与TPPA试剂平行比对检测458例临床样本,以TPPA试剂结果为参考标准,阳性符合率为100%(170/170);阴性符合率为99.31%(286/288),总符合率为99.56%(456/458),两种方法结果间差异无统计学意义(χ2=0,P>0.05);Kappa指数为0.990 6,表明两种方法检测结果间具有高度一致性,见表4。2种方法检测不符合的2例样本,TRFIA试剂检测浓度分别为6.35,3.46 mIU/ml,经CGT试剂复测均为阴性,经ELISA试剂复测浓度6.35 mIU/ml的样本为弱阳性,3.46 mIU/ml的样本为阴性。
表4
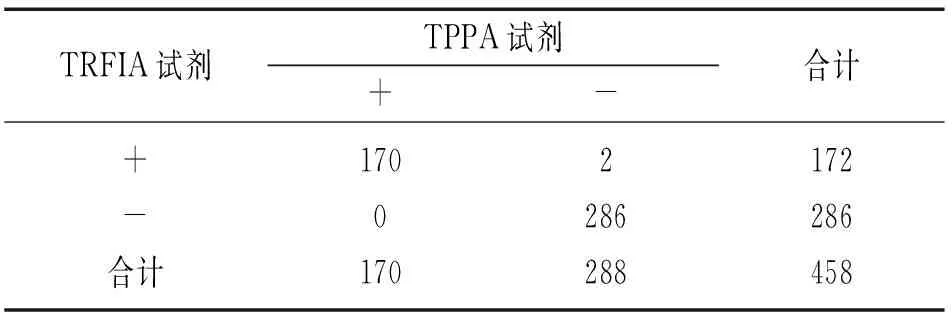
458份临床样本的比对试验评价结果
3讨论目前TP抗体的非特异性反应素抗体试验有性病研究实验室试验(VDRL)、快速血浆反应素试验(RPR)和TRUST;特异性抗体试验常用TP血凝试验(TPHA)、荧光密螺旋体抗体吸收试验(FTA-ABS),TPPA,CGT,ELISA和WB。VDRL法为微量玻片法,是以心磷脂为抗原,加入了适量胆固醇和卵磷脂以提高敏感度,对神经梅毒的诊断具有重要的价值,但对一期梅毒的敏感度不高;RPR和TRUST等非TP试验操作简便、费用较低,目前仍为许多实验室用于梅毒血清学筛查试验,但假阳性率较高,阳性结果需用特异性TP试验确认。TPHA法、TPPA法、FTA-ABS法的特点是方法特异、假阳性率低等,三者检测试剂成本高、操作较繁琐、耗时较长,因此不适合大量标本的筛查。CGT法快速、简便、敏感、特异,且无需特殊的仪器设备,适用于性病门诊的快速检测、献血者的筛查及紧急用血的筛检,但灵敏度需进一步提高。ELISA法有敏感度高、特异度好、自动化程度高、结果客观准确、易于推广等优点,是目前检验科常用的免疫学检测方法,适合梅毒的大规模筛查,但灵敏度和特异度不及TPHA,TPPA,FTA-ABS法,且存在一定的假阳性[5,6],WB法操作简便快捷,结果易于判断,但检测成本较高。铕(Eu)标记TRFIA法是一种非放射标记超微量免疫检测技术,降低了非特异性信号,达到了极高的信噪比,具有敏感度高、重复性好、特异度强、定量范围宽、标记物稳定等突出优点。
本研究的TRFIA试剂应用了含TPN15,TPN17和TPN47重组TP优势表位的嵌合抗原,采用双抗原夹心法原理检测TP特异性总抗体,在一定程度上解决了以往临床上应用间接法检测TP抗体的许多缺点,如间接法采用二抗作标记抗体,血清中IgG含量高,故少量的非特异吸附即可造成假阳性结果,血清中类风湿因子等也可能干扰检测结果,并且间接法只能检测抗体中的IgG组分,对其他抗体类型尤其是IgM无法检出,延长了窗口期;嵌合抗原的应用也解决了目前国内市面上绝大部分产品检测TP抗体以单一TP重组抗原的缺点,这种单一基因重组TP抗原对潜伏晚期、并发HIV感染或经过治疗的梅毒病人反应性差,常出现假阴性结果。
本研究TRFIA试剂批内与批间的CV均不高于10%;检测低限可达0.05 mIU/ml;检测国家标准物质的相对偏差不超过10%;在1.50~155.00 mIU/ml内,线性相关系数可达0.999 9;检测国家参考品能符合检定要求[7];在与标化的血清盘比对试验中,TRFIA法试剂结果与标化的血清盘结果的总符合率为100%;在临床样本比对试验中,本方法与TPPA法结果的总符合率为99.56%,2种方法结果间差异无统计学意义(χ2=0,P>0.05),Kappa指数为0.990 6,表明TRFIA试剂检测TP抗体与TPPA试剂具有等效性,能满足临床检测需要。
参考文献:
[1]许美蓉,韦善求.梅毒螺旋体基因重组抗原研究及其临床应用[J].右江民族医学院学报,2013,35(1):90-92.
Xu MR,Wei SQ.Treponemapallidumgene recombinant antigen research and clinical application[J].Journal of Youjiang Medical University for Nationalities,2013,35(1):90-92.
[2]中华人民共和国卫生部.中华人民共和国卫生行业标准WS 273-2007梅毒诊断标准[S].北京:人民卫生出版社,2007:1-16.
People’s Republic of China Ministry of Health.He-alth Industry Standards of the People’s Republic of China WS 273-2007 Syphilis diagnostic criteria[S].Beijing:People’s Health Publishing House,2007:1-16.
[3]徐伟文.体外诊断试剂研制常用技术指标之分析性能评估[J].分子诊断与治疗杂志,2010,2(2):140-144.
Xu WW.Evaluation index for in vitro diagnostic pro-ducts(IVD) during R&D[J].Journal of Molecular Diagnosis and Therapy,2010,2(2):140-144.
[4]罗立梅,张彬,陈刚.化学发光微粒子免疫分析法检测性激素6项的性能验证[J].国际检验医学杂志,2017,38(9):1214-1216,1219.
Luo LM,Zhang B,Chen G.Performance verification of chemiluminesent micropaticle immunoassay for 6-indicator sex hormones[J].International Journal of Laboratory Medicine,2017,38(9):1214-1216,1219.
[5]田庆华,李天君,李延伟,等.梅毒螺旋体实验室检测技术概述[J].中国性科学,2013,22(4):37-40.
Tian QH,Li TJ,Li YW,et al.An overview of laboratory detection technology ofTreponemapallidum[J].The Chinese Journal of Human Sexuality,2013,22(4):37-40.
[6]赵花,李军民,张红.TP-ELISA法检测梅毒抗体假阳性结果的影响因素[J].武警医学,2014,25(10):1003-1005,1007.
Zhao H,Li JM,Zhang H.Uncertain factors of detectingTreponemapallidumantibody by enzyme linked immunosorbent assay[J].Med J Chin PAPF,2014,25(10):1003-1005,1007.
[7]曾明,王薇,幺山山,等.第二套梅毒螺旋体抗体诊断试剂国家参考品的研制[J].中国生物制品学杂志,2006,19(4):397-399.
Zeng M,Wang W,Yao SS,et al.Development of a second set of national reference materials forTreponemapallidumantibody diagnostic reagents[J].Chin J Biologicals,2006,19(4):397-399.

