大豆种子老化的转录组学分析
秦雯婷,杨才琼,邓俊才,Nasir Iqbal ,杨 峰,3,王小春,3,杨文钰,3,刘 江,3*
(1.农业部西南作物生理生态与耕作重点实验室,成都 611130;2.四川农业大学生态农业研究所,成都 611130;3.四川省作物带状复合种植工程技术研究中心,成都 611130)
大豆是我国重要粮油作物,含多种生理活性成分。种子质量直接影响大豆生产[1-2]。种子在适宜条件下可保持活力,随储存时间延长,种子劣变老化不可避免[3]。种子老化涉及众多复杂生理生化过程,包括膜质过氧化、蛋白质结构改变、核酸降解及基因表达紊乱等[4];老化种子发芽率、发芽指数、活力指数降低,质膜完整性下降,活性氧大量积累[5-6]。
种子老化机理存在多种假说:质膜过氧化假说,即种子氧化产生自由基对细胞脂类氧化攻击,破坏质膜完整性,老化加剧[7];衰老线粒体学说,活性氧积累导致线粒体大分子物质氧化损伤,衰老进程加速[8]。目前关于种子老化研究多集中于生理特性[9-10],基于转录层面的种子老化机理研究鲜有报道。
转录组是某个物种或特定细胞类型产生的所有转录本集合,反映不同生理状态及不同环境条件下基因表达差异[11]。近年来,转录组测序技术广泛应用于作物生物学研究[12-13]。本研究基于转录组测序分析,比较储存过程中大豆种子基因转录表达差异,验证重点基因,分析生物学功能,探讨大豆种子响应老化分子机制,为提高大豆种子耐储性能奠定基础。
1 材料与方法
1.1 试验设计
以耐储型大豆品种“JP6”(储存3年发芽率>60%)和易老化大豆品种“JP16”(储存3年发芽率=0)为材料;“JP6”分别收获于 2012、2013年,“JP16”分别收获于2012、2014年,将自然风干后大豆种子储存于种子储藏柜(相对湿度60%,温度10℃)中,于2016年作转录组测序分析,4个处理分 别 为“JP16”(2012),“JP16”(2014),“JP6”(2012),“JP6”(2013)。
1.2 RNA提取和检验
采用植物RNA提取试剂盒(购自天根生化科技有限公司),根据生产厂商提供标准操作流程提取样品总RNA,经Agilent Bioanalyzer 2100(Agilent technologies,Santa Clara,CA,US)精确检测RNA完整性,检测指标包括RIN值、28S/18S、图谱基线有无上扬、5S峰。样品检测合格作后续测序试验。
1.3 文库构建
样品检测合格后构建文库,主要流程如下:用带有Oligo(dT)的磁珠富集所提mRNA,加入Frag⁃mentation Buffer将mRNA随机打断;以mRNA为模板,六碱基随机引物(random hexamers)合成第1条cDNA链,加入缓冲液、dNTPs、RNase H和DNA polymerase I合成第2条cDNA链,利用AMPure XP beads纯化cDNA;纯化双链cDNA再作末端修复、加A尾并连接测序接头,用AMPure XPbeads选择片段大小;通过PCR富集获得cDNA文库。
文库构建完成后,检测文库质量:Qubit 2.0初步定量,使用Agilent 2100检测文库insert size,insert size符合预期后采用Q-PCR方法准确定量文库有效浓度(文库有效浓度>2 nmol·L-1),完成库检。检测结果达到要求后上机测序。
1.4 RNA-Seq序列分析
基于边合成边测序(Sequencing By Synthesis,SBS)技术,采用IlluminaHiSeq™2500高通量测序平台,对4个样本(储存不同时间的“JP6”和“JP16”)cDNA测序,通过Fastx过滤去除测序过程中低质量序列和不确定序列。通过Tophat与大豆参考基因组(Glycine max Wm82.a2.v1(Soybean))作基因比对。采用Fold Change(表达差异倍数)及FDR(错误发现率)筛选差异基因差异程度,筛选条件为Fold Change≥2且FDR<0.01。
所选差异表达基因向Gene Ontology数据库各条目(term)映射,作Gene Ontology[14]。
1.5 实时定量PCR检测
随机挑选12个差异表达基因验证其4个处理表达情况,各基因扩增引物见表1,Actin4为内参基因。优化后PCR反应程序为:95℃预变性30 s、95℃变性5 s、58℃退火30 s、72℃延伸20 s,40循环;PCR反应后缓慢升至95℃,绘制溶解曲线。引物均由生工生物工程(上海)有限公司合成,每个基因设3次重复。

表1 实时荧光定量PCR基因及其引物Table1 Genesand primersfor qRT-PCR
2 结果与分析
2.1 序列整体评估及差异转录基因筛选
通过4个样本cDNA测序获得191.5~328.5万条原始序列(见表2),Fastx过滤得159.7~232.6万条有效序列,Q30碱基百分比在86.97%以上,比对效率为81.94%~89.87%。
由表2可知,序列整体评估优良,结果合格可用。通过不同处理下FPKM值作样本差异表达分析,采用Fold Change(表达差异倍数)及FDR(错误发现率)筛选差异基因差异程度,筛选条件为Fold Change≥2且FDR<0.01。经筛选,储存后JP16差异表达基因数量为1 683个,上、下调分别为528个和1 155个;JP6差异转录基因数量为832个,上、下调转录基因数量分别为345和487个;JP16和JP6共有差异转录基因数目为140个(见图1)。

表2 Illumina测定序列与大豆基因组比对结果Table 2 Statistics of Illumina readsand comparison with soybean genome
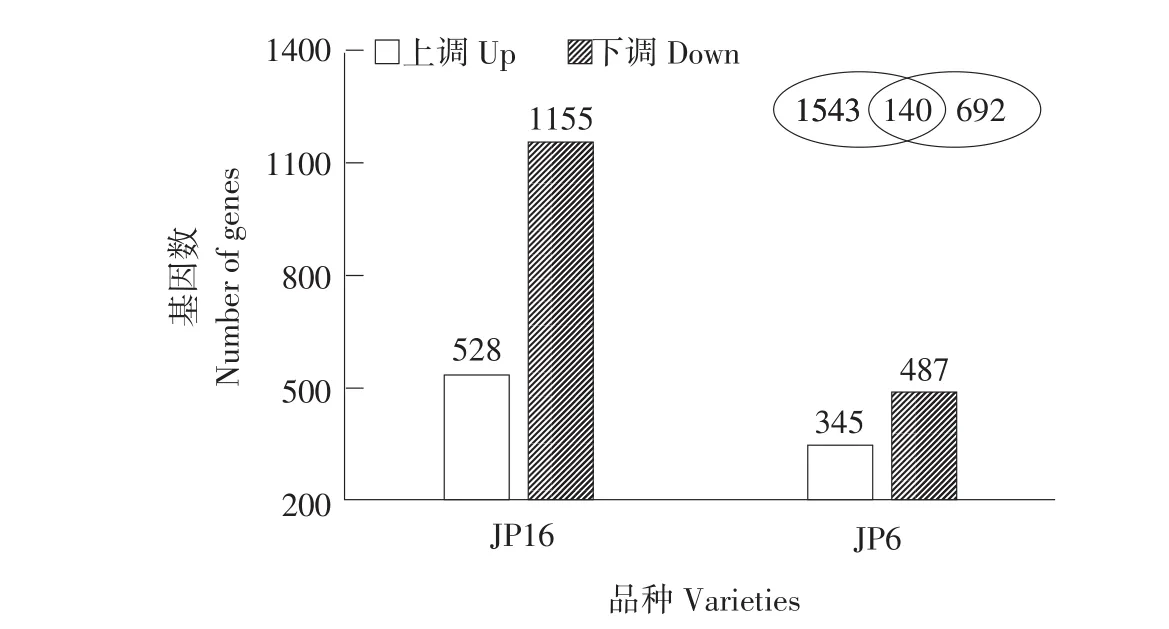
图1 储存后大豆种子中差异转录基因筛选Fig.1 Screening of differential transcription genes in soybean seed after storage
2.2 差异转录基因GO分类
GO(Gene Ontology)分类用于全面描述不同生物基因生物学特征,包含3个主要分支。即生物学过程(Biological Process)、分子功能(Molecular Function)和细胞组分(Cellular Component)。差异表达基因GO分类统计结果如图2所示,其中,“JP16”特有显著性GO富集条目的生物学过程、分子功能和细胞组分分别有513、373和120个,所占比例为51.0%、37.1%和11.9%;“JP6”特有显著性GO富集条目的3个过程分别有174、152和23个,占比为49.9%、43.5%和6.6%。另外,在“JP16”和“JP6”共有的1 460个显著性GO富集条目中,其生物学过程、分子功能和细胞组分所占比例分别为68.6%、22.3%和9.1%。

图2 储存后大豆种子中差异转录基因显著条目Fig.2 Significant entry of differential transcription genes in soybean seed after storage
2.3 GO功能的显著性富集分析
为进一步分析大豆种子对老化基因响应情况,在“JP16”和“JP6”共有显著性GO富集条目中,通过FDR<0.01筛选出极显著GO条目,主要涉及细胞中各类成分分解与代谢。其中,“JP16”和“JP6”分别有45和23个差异基因富集于碳水化合物生物合成过程(GO:0016051),43和40个差异基因富集于水分损失(GO:0009414),25和18个差异基因富集于蛋白质寡聚化(GO:0051259),34和15个差异基因富集于线粒体机能改变(GO:0006120),13和9个差异基因富集于蛋白质磷酸化过程(GO:0006468)等。这些差异基因在储存后呈不同变化趋势,除与碳水化合物生物合成过程、线粒体机能相关基因均呈下调趋势外,其余皆上调,且“JP6”变化基因数相对较少(见表3)。
“JP16”特有极显著富集条目中,主要涉及蛋白质泛素化、脂肪酸氧化及花青素、木质素等化合物代谢调控。其中,1个差异转录基因富集于蛋白质泛素化过程(GO:0006513),5个差异转录基因富集于脂肪酸氧化(GO:0010430),7个差异转录基因富集于花青素代谢过程(GO:0031538),8个差异转录基因富集于木质素代谢(GO:0009808)。在21个差异转录基因中,编码蛋白质泛素化及脂肪酸氧化相关基因均表现上调趋势,花青素、木质素代谢关键基因均下调(见表4)。
“JP6”特有极显著富集条目中,主要涉及细胞壁相关多糖合成,尤其是蜡质(GO:0010166)、原花青素(GO:0010023)合成,还涉及对活性氧水平调控(GO:0036293)及异黄酮合成(GO:0009717)等过程。其中,12个差异转录基因富集于蜡质代谢过程,5个差异转录基因富集于原花青素合成,7个差异转录基因富集于活性氧水平调控,1个差异转录基因富集于异黄酮合成。这25个差异转录基因中,除编码蜡质代谢过程关键基因呈下调趋势,其余编码原花青素合成、活性氧水平调控及异黄酮合成相关基因均上调(见表5)。

表3 储存后“JP16”和“JP6”共有极显著GO富集条目Table 3 Highly significant GO terms in both JP16 and JP6 under storage

表4 储存后JP16特有极显著GO富集条目Table 4 Highly significant GO termsin JP16 under storage
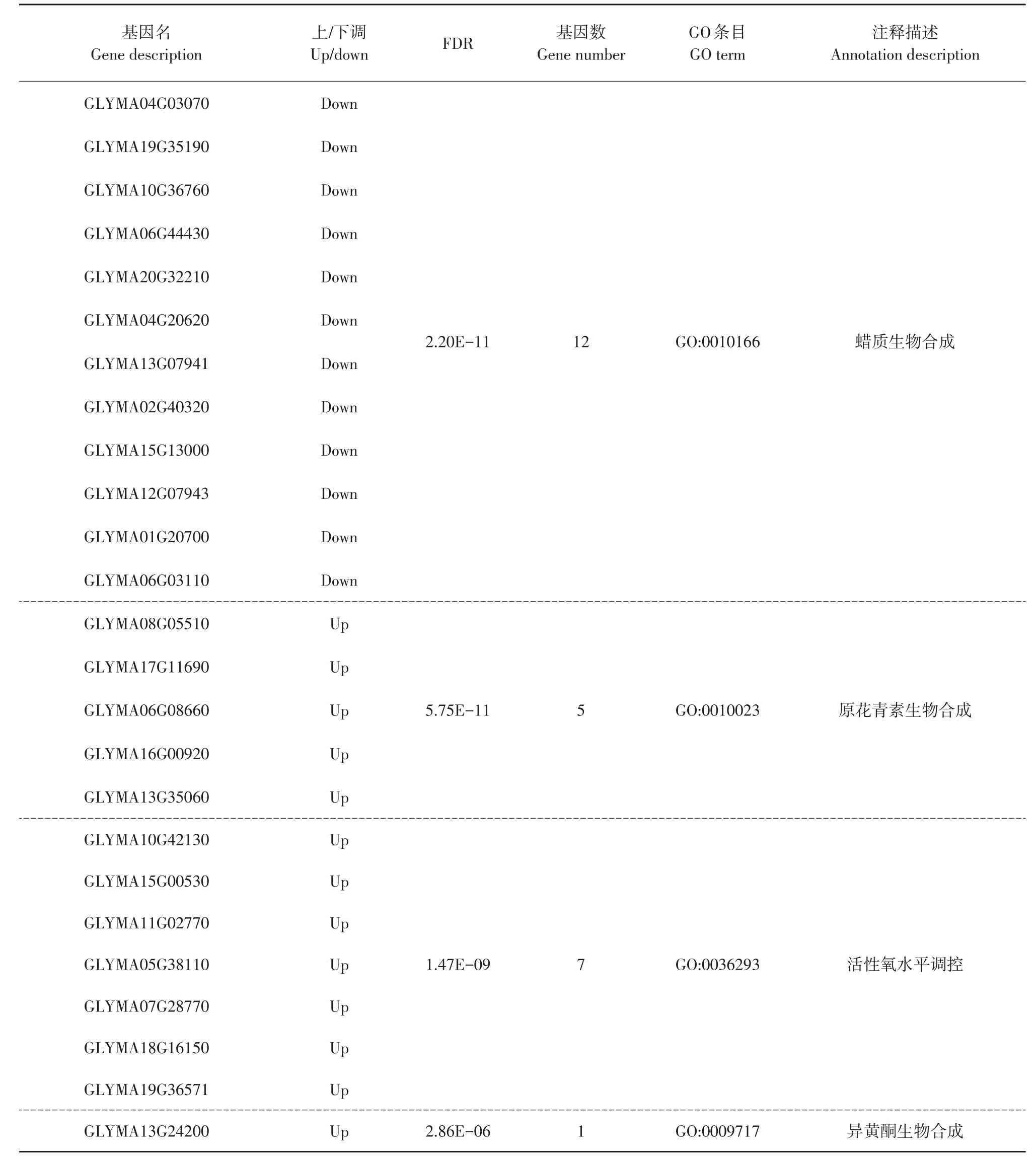
表5 储存后JP6特有极显著GO富集条目Table 5 Highly significant GO terms in JP6 under storage
2.4 实时荧光定量PCR验证
为验证RNA-seq转录组测序可靠性,随机挑选12个差异表达基因作实时荧光定量PCR检验(见表1)。由图3可知,实时荧光定量PCR结果与RNA-seq在数值上基本一致,相关分析实时荧光定量PCR和RNA-seq数据显示相关系数为0.989(P<0.001),说明转录组测序结果获差异基因表达信息具较高可重复性和准确性。
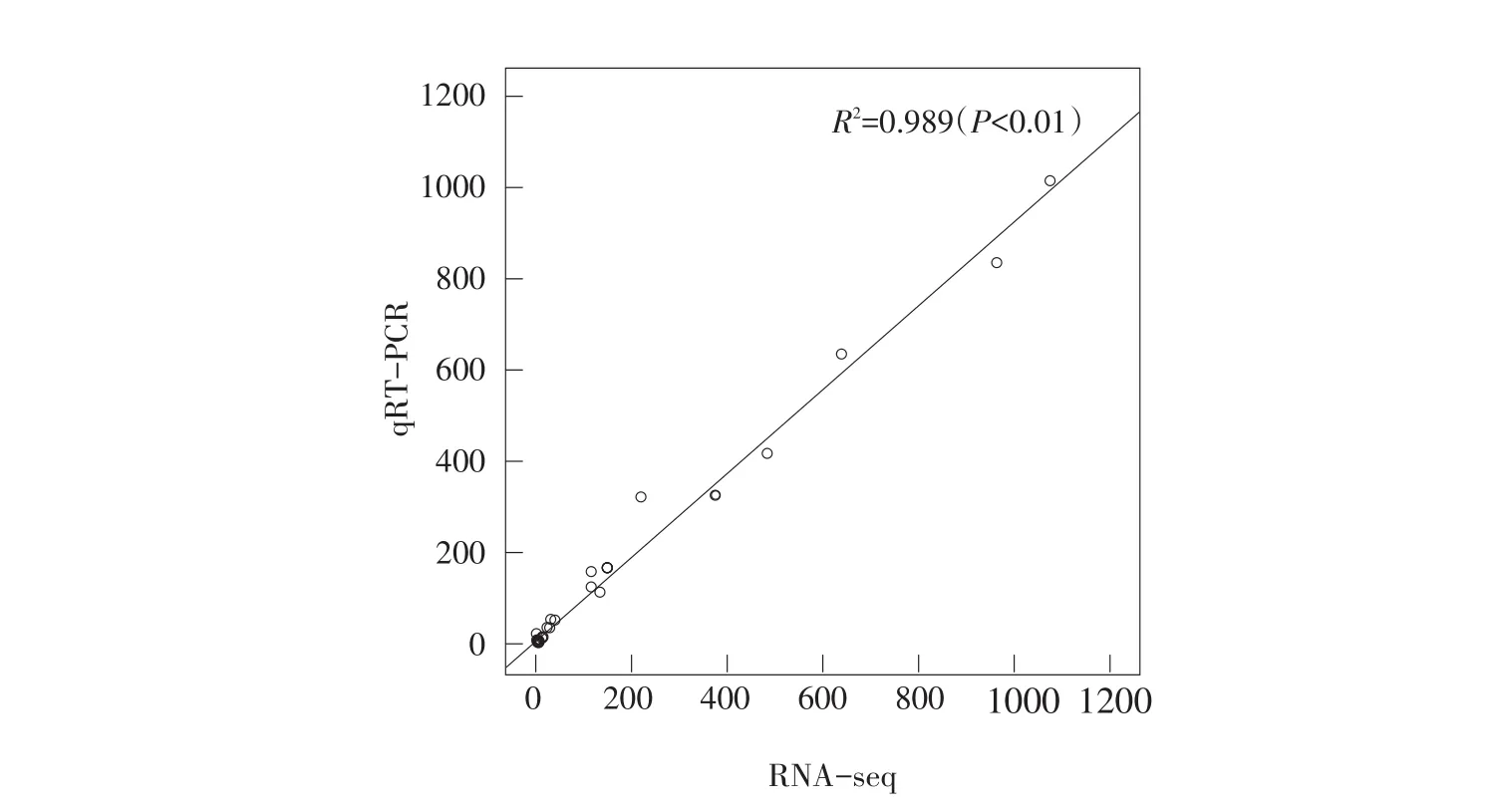
图3 实时荧光定量PCR和RNA-seq相关性分析Fig.3 Analysis of the correlation between qRT-PCR and RNA-seq
3 讨论与结论
大豆种子老化受多基因控制,主要涉及能量代谢、信号转换、质膜过氧化等生理生化反应,由于大豆基因型多样性,种子对老化适应性存在差异[15-16]。本研究对不同抗老化大豆品种作转录组测序分析发现,储存过程中大豆种子转录本差异显著,以上调为主。易老化品种“JP16”较耐储藏品种“JP6”表现更多差异转录基因,耐储藏品种“JP6”适应性更强。
碳水化合物在植物抗老化方面发挥重要作用,参与糖酵解过程,为植物提供生存必需能量[17];调控细胞代谢,使植物适应缺氧等不利环境胁迫[18]。种子在老化或储存过程中,糖基化代谢物积累量随老化程度增强而增加[19-20]。本研究储存大豆差异表达基因多集中于碳水化合物合成通路,且皆下调;大量减少游离糖类启动非酶促“阿尔多瑞-美德拉反应”[21],细胞毒素破坏胞内保护酶系统平衡,扰乱胞内水分正常代谢,活性氧大量积累,种子老化加剧[22-23]。另外,胞内水分损失种子内部分子流动性受玻璃体(含水量<5%)结构限制而降低,细胞清除活性氧能力下降,膜脂过氧化程度加剧[20],甚至改变DNA双链结构修饰,生化功能发生变化,最终导致生化代谢停止,种子老化死亡加速[24]。Kalemba等研究显示,老化过程还涉及蛋白质结构修饰改变[25],拟南芥老化种子活力降低由蛋白质改变或萌发时无法表现正常蛋白质组特性引起[26],与本研究结果一致。此外,老化细胞内信号转导刺激线粒体功能改变,具体表现为线粒体内氧化还原电位改变,细胞内部代谢紊乱[27],种子活力丧失,在老化燕麦与大豆种子内均发现线粒体功能衰竭[28-29]。易老化大豆“JP16”特有极显著富集条目中,蛋白质泛素化与脂肪酸氧化加剧,加速质膜过氧化,增加质膜透性,促使种子老化。类似研究结果在甜辣椒、山藜豆种子中均有发现[6,30]。
此外,种子次生代谢物积累也对抗老化起关键作用,花青素是极佳抗氧化分子,可清除植物体内自由基和活性氧,对DNA、蛋白质及细胞膜氧化损伤等具较强抑制作用,保护植物免受环境胁迫引起氧化损伤[31]。木质素是保护细胞天然屏障,质地坚硬,赋予植物细胞硬度和强度;木质素由疏水芳香族木质素单体聚合而成,防止细胞内水分流失,保持植物胞内水分[32]。本研究中,易老化大豆“JP16”种子中花青素和木质素合成基因下调,抗逆能力降低,种子易老化。此外,大豆种子表面覆有蜡质,是植物抵御外界胁迫第一道保护屏障[33]。在耐储型大豆“JP6”特有的极显著富集条目中,蜡质代谢减弱,原花青素、异黄酮合成加强,三类代谢物在植物细胞中大量积累,植物抗逆能力增强。欧洲山毛榉老化种子内部活性氧含量显著升高,超氧阴离子、过氧化氢及羟基自由基等大量积累,胞内电化学势平衡遭破坏[34];JP6对活性氧调控在一定程度上保护质膜完整性,稳定胞内电化学势,减缓种子老化。
综上所述,大豆种子储藏过程中,易老化品种基因转录表达水平敏感性更强,主要表现在碳水化合物合成、水分损失、蛋白质结构及线粒体机能改变等生物过程。耐储型大豆品种通过增加蜡质、原花青素、异黄酮等保护性成分含量,增强对活性氧调控减缓老化对细胞损伤,维持各项功能稳定性,适应能力更强。
[参考文献]
[1] Ziegler V,Marini L J,Ferreira CD,et al.Effects of temperature and moisture during semi-hermetic storage on the quality evalua⁃tion parameters of soybean grain and oil[J].Semina Ciências Agrárias,2016,37:131-144.
[2] Álvarez-Espino R,Godínez- Álvarez H,Torre-Almaráz R D.Seed banking in the columnar cactus Stenocereus stellatus:Distri⁃bution,density and longevity of seeds[J].Seed Science Research,2014,24(4):315-320.
[3]Murthy U M,Kumar PP,Sun W Q.Mechanisms of seed ageing under different storage conditions for Vigna radiata(L.)Wilczek:Lipid peroxidation,sugar hydrolysis,Maillard reactions and their relationship to glass state transition[J].Journal of Experimental Botany,2003,54(384):1057-1067.
[4] Walters C.Understanding the mechanisms and kinetics of seed aging[J].Seed Science Research,1998,6(8):223-244.
[5] Demirkaya M.Relationships between antioxidant enzymes and physiological variations occur during ageing of pepper seeds[J].Horticulture Environment and Biotechnology,2013,54(2):97-102.
[6] Kaewnaree P,Vichitphan S,Klanrit P,et al.Effect of accelerated aging process on seed quality and biochemical changes in sweet pepper(Capsicum annuum Linn.)seeds[J].Biotechnology,2011,10(2):175-182.
[7] Mcdonald M B.Seed deterioration:Physiology,repair and assess⁃ment[J].Seed Scienceand Technology,1999,27(1):177-237.
[8] Miquel J,Economos A C,Fleming J,et al.Mitochondrial role in cell aging[J].Experimental Gerontology,1980,15(6):575-591.
[9] Groot SP C,Surki A A,Vos R C,et al.Seed storage at elevated partial pressure of oxygen,a fast method for analysing seed ageing under dry conditions[J].Annals of Botany,2012,110(6):1149-1157.
[10] Tunes L M,Tavares L C,Rufino CD,et al.Accelerated aging of broccoli seeds(Brassica oleracea L.Var.Italica plenk)[J].Biosci⁃ence Journal,2012,28(2):173-179.
[11] Wei W,Qi X,Wang L,et al.Characterization of the sesame(Sesamumindicum L.)global transcriptomeusing Illuminapairedend sequencing and development of EST-SSR markers[J].Bmc Genomics,2011,12:451-451.
[12] Umezawa T,Fujita M,Fujita Y,et al.Engineering drought toler⁃ance in plants:Discovering and tailoring genes to unlock the fu⁃ture[J].Current Opinion in Biotechnology,2006,17(2):113-122.
[13] Valliyodan B,Nguyen H T.Understanding regulatory networks and engineering for enhanced drought tolerance in plants[J].Current Opinion in Plant Biology,2006,9(2):189-196.
[14] 任梦露,刘卫国,刘婷,等.荫蔽胁迫下大豆茎秆形态建成的转录组分析[J].作物学报2016,42(9):1319-1331.
[15] Lazar SL,Mira S,Pamfil D,et al.Germination and electrical con⁃ductivity testson artificially aged seed lotsof 2 Wall-Rocket spe⁃cies[J].Turkish Journal of Agriculture and Forestry,2014,38(6):854-864.
[16] Tammela P,Nygren M,Laakso I,et al.Volatile Compound analy⁃sis of ageing Pinus sylvestris L.(Scots pine)seeds[J].Flavour&Fragrance Journal,2003,18(4):290-295.
[17] White JA,Todd J,Newman T,et al.A new set of arabidopsis ex⁃pressed sequence tagsfromdeveloping seeds.The metabolic path⁃way fromcarbohydratesto seed oil[J].Plant Physiology,2000,124(4):1582-1591.
[18] Gorecki RJ,Piotrowiczclesiak A I,Lahuta L B,et al.Soluble car⁃bohydrates in desiccation tolerance of yellow lupin seeds during maturation and germination[J].Seed Science Research,1997,7(2):107-116.
[19] Parkhey S,Naithani S C,Keshavkant S.Protein metabolism during natural ageing in desiccating recalcitrant seeds of Shorea robusta[J].Acta Physiologiae Plantarum,2014,36(7):1649-1659.[20] Murthy U M,Liang Y,Kumar P P,et al.Non-enzymatic protein modification by the Maillard reaction reduces the activities of scavenging enzymes in Vigna radiata[J].Physiologia Plantarum,2002,115(2):213-219.
[21] Murthy UM,Sun WQ.Protein modification by Amadoriand Mail⁃lard reactions during seed storage:Roles of sugar hydrolysis and lipid peroxidation[J].Journal of Experimental Botany,2000,51(348):1221-1227.
[22] Ugaroio-Hardi Z,Hlevnjak M.Accumulation of Amadori and Maillard productsin wheat seeds aged under different storage con⁃ditions[J].Croatica Chemica Acta,2008,81(1):131-137.
[23] Kibinza S,Vinel D,Côme D,et al.Sunflower seed deterioration as related to moisture content during ageing,energy metabolism and active oxygen species scavenging[J].Physiologia Plantarum,2006,128(3):496-506.
[24] Tittel C.Seed Aging.Implications for Seed Storage and Persis⁃tence in the Soil,D.A.Priestley(Ed.).Cornell University Press,Ithaca-London(1986)[J].Biochemie Und Physiologie Der Pflan⁃zen,1987,182(2):187-195.
[25] Kalemba E M,Pukacka S.Carbonylated proteins accumulated as vitality decreases duringlong-term storageof beech(Fagussylvat⁃ica L.)seeds[J].Trees,2014,28(2):503-515.
[26] Rajjou L,Lovigny Y,Groot SP C,et al.Proteome-Wide charac⁃terization of seed agingin arabidopsis:A comparison between arti⁃ficial and natural aging protocols[J].Plant Physiology,2008,148(1):620-641.
[27] Kranner I,Chen H,Pritchard H W,et al.Inter-nucleosomal DNA fragmentation and loss of RNA integrity during seed ageing[J].Plant Growth Regulation,2011,63(1):63-72.
[28] Kong Q,Mao P S,Yu X D,et al.Physiological changes in oat seeds aged at different moisture contents[J].Seed Science and Technology,2014,42(12):190-201.
[29] Xin X,Tian Q,Yin G,et al.Reduced mitochondrial and ascor⁃bate-glutathione activity after artificial ageing in soybean seed[J].Journal of Plant Physiology,2014,171(2):140-147.
[30] Louise C,Bradley E L,Lloyd A S,et al.Volatile fingerprints of seeds of four speciesindicate theinvolvement of alcoholic fermen⁃tation,lipid peroxidation,and Maillard reactionsin seed deteriora⁃tion duringageing and desiccation stress[J].Journal of Experimen⁃tal Botany,2012,63(18):6519-6526.
[31] Holton TA,Cornish EC.Geneticsand biochemistry of anthocyan⁃in biosynthesis[J].The Plant cell,1995,7:1071-1083.
[32] Kitin P,Voelker S L,Meinzer F C,et al.Tyloses and phenolic deposits in xylem vessels impede water transport in low-lignin transgenic poplars:A study by cryo-fluorescence microscopy[J].Plant physiology,2010,154(2):887-898.
[33] Dai S,Guo J,Wen X U,et al.Biosynthesisand regulation of cutic⁃ular wax and its effects on drought resistance of wheat[J].Plant Physiology Journal,2016,52(7):979-988.
[34] Ratajczak E,Małecka A,Bagniewskazadworna A,et al.The pro⁃duction,localization and spreading of reactive oxygen species con⁃tributes to the low vitality of long-term stored common beech(Fagus sylvatica L.)seeds[J].Journal of Plant Physiology,2015,174(18):147-156.

