人脐带间充质干细胞对巨噬细胞表型调节的机制探讨
薛 婧,高杰清,尹雅琪,张 琪,于松岩,邹俊彦,郝好杰,母义明
解放军总医院,北京 100853 1内分泌科;2基础医学所
间充质干细胞是具有多向分化潜能的成体干细胞。近年来,间充质干细胞的免疫调节能力越来越受重视。间充质干细胞能控制炎症进展,促进组织修复,治疗多种与免疫及炎症相关的疾病[1]。巨噬细胞是体内重要的吞噬和抗原提呈细胞,在机体稳态维持和炎症的发生发展中有着关键作用[2]。巨噬细胞具有高度的可塑性和明显的异质性,可大致可分为两种表型:经典活化的M1型巨噬细胞和选择性活化的M2型巨噬细胞[3]。M1型巨噬细胞主要分泌高浓度的IL-1β、TNF-α、干扰素γ(interferonγ,IFN-γ)等促炎因子,引发机体炎症反应,发挥宿主免疫功能,但过度的炎症会导致机体正常组织的损伤。M2型巨噬细胞主要分泌IL10、IL-4、TGF-β等抑炎因子,可控制炎症发展,促进组织修复[3]。巨噬细胞表型转变与组织的炎症和修复密切相关,如机体脂肪组织中M1型巨噬细胞向M2型极化有利于减轻胰岛素抵抗,改善2型糖尿病[4-5]。研究发现,在糖尿病、动脉粥样硬化、败血症等代谢性和炎性疾病中[6-8],间充质干细胞输注后受损组织局部巨噬细胞功能和表型发生改变,但间充质干细胞(特别是人脐带来源的间充质干细胞)对巨噬细胞表型的调节及其机制仍有不明确之处。因此,本研究旨在探究人脐带来源的间充质干细胞对巨噬细胞表型的影响及其潜在的机制,为干细胞的应用提供新的思路。
材料和方法
1 细胞 小鼠骨髓巨噬细胞(bone marrow derived macrophages,BMDMs)、小鼠腹腔巨噬细胞均提取自6周龄的C57BL/6J小鼠,人脐带间充质干细胞提取自人新鲜脐带。
2 主要试剂与仪器 RMPI1640培养基,0.25%胰蛋白酶,胎牛血清(美国Gibco公司);M-CSF、流式抗体F4/80-PE(德国Becton Dickinson公司);TrizolRNA提取试剂(美国Invitrogen公司);PCR引物由华大基因合成;iNOS抗体、Arg1抗体(美国Abcam公司);P-AKT、PI3K抗体(美国CST公司)、β-tubulin抗体、Western blot二抗 (中山金桥 );LPS、IFN-γ(美国 Sigma公司 )、7-AAD(美国 Tonbobio公 司 )、IL-1β、TNF-α、IL-4、AIMPLEX流式检测试剂盒(中国旷博生物公司)、流式细胞仪(德国Becton Dickinson公司),Q-PCR仪器(美国Bio-Rad公司)、激光共聚焦显微镜(Leica,德国 )。
3 小鼠巨噬细胞培养及分组 骨髓巨噬细胞提取:将6周龄C57BL/6J小鼠断颈处死,分离小鼠双下肢,剥除皮肤后于75%乙醇中浸泡5 min,在超净台中剥离下肢肌肉组织,完整分离出双侧胫骨和腓骨。分别将胫骨和腓骨两端剪开,用1 ml注射器吸取含有10%胎牛血清和100 ng/ml M-CSF的1640培养基,反复冲洗骨髓腔至变白。收集骨髓腔冲洗液,1 000 r/min离心5 min,弃上清后重悬细胞,接种于六孔版内,置于37℃、5%CO2的培养箱中培养,3 d换液1次。腹腔巨噬细胞提取:断颈处死6周龄C57BL/6J小鼠,75%乙醇浸泡5 min,于超净台中分离腹部皮肤暴露腹腔,用2 ml含有10%胎牛血清的1640培养基灌洗腹腔。将腹腔灌洗液1 000 r/min离心5 min,重悬接种于放置无菌盖玻片的六孔板中。将细胞分为对照组、LPS和IFN-γ诱导组、干细胞共培养组,对照组更换为1640完全培养基,LPS和IFN-γ诱导组、干细胞共培养组换为含100 ng/ml LPS和50 ng/ml IFN-γ的培养基。24 h后再次换液,各组均更换为完全培养基,干细胞共培养组与3×104人脐带间充质干细胞通过Transwell共培养24 h。收集各组细胞检测各项指标。
4 人脐带间充质干细胞的分离和培养 人脐带间充质干细胞的分离、培养及鉴定见参考文献[9]。
5 Western blot检测巨噬细胞蛋白表达 各组巨噬细胞经相应处理后,提取细胞总蛋白,取等量的细胞蛋白进行10% SDS-PAGE凝胶电泳,再转移至PVDF膜上,BSA封闭后,加入iNOS(1/1 000)、Arg1(1/1 000)、P-AKT(1/1 000)、PI3K(1/1 000)、Tubulin(1:2 000)、GAPDH(1:2 000)一抗,4℃孵育过夜。用TBST充分洗膜3次,并予以对应的辣根过氧化物酶标记的二抗孵育1 h后曝光。使用Image J软件进行灰度分析。
6 流式细胞术鉴定巨噬细胞及测定上清细胞因子表达 选取生长至80%融合的细胞,收集细胞,PBS洗涤3次,100μl PBS重悬细胞,加入F4/80-PE抗体和相应的小鼠IgG作为同型对照,避光孵育15 min。PBS洗涤2次后重悬,再加入7-AAD,利用流式细胞仪检测BMDMs免疫表型。收集经过相应处理的各组细胞的培养液,1 000 r/min离心5 min,吸取上清加样,分别加入小鼠IL-1β、TNF-α、IL-4流式抗体孵育,利用流式细胞仪检测细胞因子表达。
7 qRT-PCR检测巨噬细胞标记物和炎症相关因子mRNA表达 Trizol法提取各组细胞的总RNA,逆转录合成cDNA,选取β-actin作为内参照,利用2-ΔΔCt计算基因表达相对倍数变化。
8 免疫荧光检测巨噬细胞表型变化 将腹腔巨噬细胞接种于已放置无菌盖玻片的六孔板中,按前述步骤处理各组细胞,之后使用4%多聚甲醛固定15 min,0.5% TritonX-100/PBS通透液破膜15 min,10%山羊血清封闭20 min,加iNOS(1∶100)、Arg1(1∶100)抗体4℃孵育过夜。PBS洗涤3次后加入对应荧光二抗避光孵育2 h,最后DAPI(1∶2 000)染核7 min。使用激光共聚焦显微镜观察并拍照,计算细胞阳性比率。
9 统计学分析 采用SPSS19.0软件进行分析,计量数据结果以-x±s表示,多组样本均数比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
结 果
1 巨噬细胞的鉴定及其形态学特点 小鼠BMDMs经过流式细胞术测定,巨噬细胞特异性表面标记物F4/80阳性率99%以上,提示骨髓单核细胞成功诱导为成熟巨噬细胞(图1A);腹腔巨噬细胞免疫荧光显示,F4/80阳性率达到95%以上,达到实验要求(图1B)。光镜下观察发现各组巨噬细胞形态上存在差异:对照组BMDMs大小和形态均一,呈现类圆形,生长状态良好;LPS+IFN-γ诱导组细胞形态多变,部分细胞出现伪足,呈长梭形细胞比例明显升高;经过与干细胞共培养,巨噬细胞触角减少,长梭形细胞减少(图2)。
2 UC-MSCs对巨噬细胞炎症相关因子表达的影响qRT-PCR结果显示,与LPS和IFN-γ诱导组
相比,干细胞共培养组炎性因子IL-1β、TNF-α、IFN-γ、IL6表达明显下调(P均<0.05,图3A),抑炎因子IL-4、IL10表达上调(P<0.05,图3A)。利用流式细胞术测定细胞上清蛋白含量,与PCR结果类似,与LPS+IFN-γ诱导组相比,UC-MSCs共培养后巨噬细胞分泌的IL-1β、TNF-α分别下调79.5%、41.1%(P均<0.05,图3B),抑炎因子IL-4表达上调91.4%(P<0.05,图3B),提示UCMSCs能明显抑制M1型巨噬细胞引发的炎性反应。
3 UC-MSCs促使巨噬细胞向M2表型极化 免疫荧光显示,干细胞共培养组与LPS+IFN-γ诱导组相比,M1型巨噬细胞标记物iNOS阳性细胞比例下降32.48%(P<0.01,图4A),M2型巨噬细胞标记物Arg1阳性细胞比例升高32.25%(P<0.01,图4A)。Western blot结果同样显示,经过UC-MSCs共培养后,巨噬细胞iNOS蛋白表达下降(P<0.01,图4B),Arg1蛋白表达显著提高(P<0.01,图4B)。以上结果提示UC-MSCs促进巨噬细胞由M1型向M2型极化。
4 PI3K/AKT通路参与UC-MSCs促进巨噬细胞向M2型极化的过程 为了进一步探讨UC-MSCs对巨噬细胞表型调节的机制,我们检测了参与巨噬细胞极化的PI3K/AKT通路。Western blot分析显示,与UC-MSCs共培养后,巨噬细胞PI3K、p-AKT蛋白表达上调(P<0.01,图5A,图5B)。给予巨噬细胞PI3K通路抑制剂LY294002处理后,被UC-MSCs抑制的巨噬细胞iNOS表达上调,而Arg1表达有所下调(P均<0.01,图5A,图5B),提示UC-MSCs的作用被该抑制剂阻断,说明PI3K/AKT通路参与了UC-MSCs促进M1型巨噬细胞向M2型极化的过程。
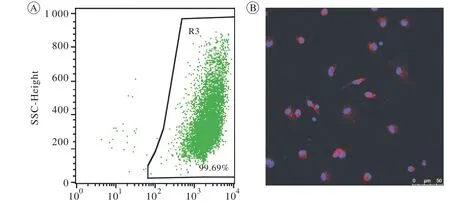
图1 巨噬细胞的鉴定 A: 流式细胞术检测骨髓来源巨噬细胞F4/80表达; B: 免疫荧光检测腹腔巨噬细胞F4/80的表达(红色)Fig. 1 Identification of macrophages A: Expression of F4/80 in bone marrow derived macrophages(BMDMs) was detected by flow cytometry; B: Expression of F4/80 (red) in peritoneal macrophages was evaluated by immunofluorescence
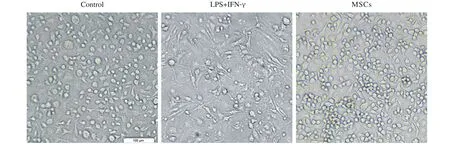
图2 光镜下骨髓来源巨噬细胞的形态学特点(40×)Fig. 2 Morphological characteristics of BMDMs (40×)
讨 论
间充质干细胞是具有多向分化潜能和自我更新能力的一类成体干细胞,在机体中分布广泛。近年来研究发现,间充质干细胞具有显著的免疫调控能力[10],在炎性微环境中能调节如T细胞[11]、NK细胞[12]、DC细胞[13]等免疫细胞的表型和功能,从而抑制炎症反应,促进组织修复,在自身免疫性疾病和炎症性疾病治疗上显示出了良好的前景。目前关于UC-MSCs对巨噬细胞表型的调节及其机制的报道较少,因此本研究主要探讨了UC-MSCs对巨噬细胞表型的影响及其相关的信号通路。
巨噬细胞是固有免疫系统的重要组成部分,根据其功能、表面标记物、分泌谱等,大致可分为经典活化的M1型巨噬细胞和选择性活化的M2型巨噬细胞[1]。IFN-γ和TLR配体如LPS可诱导巨噬细胞向M1表型极化。M1型巨噬细胞主要分泌 IL-6、IL-1β、TNF-α、IL-12、IL-23、诱导型一氧化氮合酶等,具有抗原提呈和活化T细胞的能力,是炎症反应重要的效应细胞。M2型包括M2a、M2b、M2c等多个亚型,总体而言,M2型巨噬细胞IL10高表达,并分泌大量的IL10、TGF-β、VEGF等细胞因子,促进Th2细胞免疫反应,具有缓解炎症、促进血管生成和组织修复的作用[14]。M1型巨噬细胞的大量浸润与代谢性疾病的进展密切相关[15]。如2型糖尿病的进展伴随着胰岛中巨噬细胞表型的改变。正常状态下,胰岛中固有巨噬细胞多呈CD11b+Ly-6C-的M2表型。随着糖尿病进程,胰岛中分泌IL-1β、TNF-α的CD11b+Ly-6C+促炎型巨噬细胞显著增多,参与了β细胞的损伤和凋亡[16]。而促进巨噬细胞向M2型极化可抑制炎症,延缓疾病进展。
本研究利用LPS和IFN-γ处理巨噬细胞24 h来诱导形成M1型巨噬细胞。LPS和IFN-γ处理后,巨噬细胞形态发生明显改变,长梭形细胞数目显著增加,IL-1β、TNF-α的mRNA和蛋白水平的表达量明显上调(P均<0.05),免疫荧光和Western blot结果显示iNOS表达明显上升(P<0.01),提示M1型巨噬细胞诱导成功。而经过与干细胞共培养后,长梭形细胞减少,细胞黏附性增强,胞内颗粒增多。免疫荧光和Western blot均显示,与LPS和IFN-γ的诱导组相比,干细胞共培养组巨噬细胞iNOS表达下调,Arg1表达明显上调,提示UCMSCs共培养后,M1型巨噬细胞表型向M2转变。同时,巨噬细胞分泌的IL-1β、TNF-α、IFN-γ等炎性因子下降,其中IL-1β下降显著。TNF-α可诱发级联反应,导致及组织损伤和局部炎症的迁移扩散。IL-1β是促炎型巨噬细胞分泌的主要效应因子之一,IL-1β前体经过NLRP3炎性小体激活,成为成熟的IL-1β后分泌,引发局部组织炎症[17]。值得注意的是,胰岛β细胞表面具有大量的IL-1β受体,高浓度的IL-1β是导致糖尿病前期以及糖尿病阶段β细胞损伤的关键因素[18]。因此,UC-MSCs通过显著抑制巨噬细胞IL-1β的分泌,可能具有改善胰岛功能的作用。
PI3K/AKT通路是参与巨噬细胞激活与极化的重要通路之一[19-21]。PI3K能激活其下游的AKT和mTOR,从而抑制NF-κB的激活、促进C/EBP的活化,进而抑制巨噬细胞炎性因子分泌,促进巨噬细胞向M2表型活化[20]。我们发现,经过与UC-MSCs共培养,巨噬细胞PI3K、p-AKT表达增强(P均<0.01),在加入该通路抑制剂Ly294002后,Western blot结果显示巨噬细胞iNOS表达升高,Arg1表达下降(P均<0.01),说明M1型巨噬细胞向M2表型极化减弱,提示PI3K/AKT通路参与了UC-MSCs促进巨噬细胞极化的过程。UC-MSCs具有强大的分泌功能,UC-MSCs分泌了哪些细胞因子促进巨噬细胞极化还需要进一步探索。
通过以上研究,我们发现UC-MSCs能通过PI3K/AKT通路促进M1型巨噬细胞向M2型极化,降低炎性因子分泌,从而抑制炎症。鉴于巨噬细胞广泛参与了机体稳态维持和多种生理病理过程,UC-MSCs对巨噬细胞表型的调节可能参与了UCMSCs对多种免疫和炎症性疾病的治疗过程,特别是肥胖相关的代谢性疾病。因此,本研究进一步揭示了UC-MSCs的免疫调控特性,为UC-MSCs的应用提供了新的前景。
1 Ma S, Xie N, Li W, et al. Immunobiology of mesenchymal stem cells[J]. Cell Death Differ, 2014, 21(2): 216-225.
2 Epelman S, Lavine KJ, Randolph GJ. Origin and functions of tissue macrophages[J]. Immunity, 2014, 41(1): 21-35.
3 Martinez FO, Sica A, Mantovani A, et al. Macrophage activation and polarization[J]. Front Biosci, 2008, 13 : 453-461.
4 Ji Y, Sun S, Xu A, et al. Activation of natural killer T cells promotes M2 Macrophage polarization in adipose tissue and improves systemic glucose tolerance via interleukin-4 (IL-4)/STAT6 protein signaling axis in obesity[J]. J Biol Chem, 2012, 287(17): 13561-13571.
5 Mauer J, Chaurasia B, Goldau J, et al. Signaling by IL-6 promotes alternative activation of macrophages to limit endotoxemia and obesity-associated resistance to insulin[J]. Nat Immunol, 2014,15(5): 423-430.
6 Nemeth K, Leelahavanichkul A, Yuen PS, et al. Bone marrow stromal cells attenuate sepsis via prostaglandin E(2)-dependent reprogramming of host macrophages to increase their interleukin-10 production[J]. Nat Med, 2009, 15(1): 42-49.
7 Cao X, Han ZB, Zhao H, et al. Transplantation of mesenchymal stem cells recruits trophic macrophages to induce pancreatic beta cell regeneration in diabetic mice[J]. Int J Biochem Cell Biol, 2014,53: 372-379.
8 Li Q, Sun W, Wang X, et al. Skin-Derived Mesenchymal Stem Cells Alleviate Atherosclerosis via Modulating Macrophage Function[J].Stem Cells Transl Med, 2015, 4(11): 1294-1301.
9 Bieback K, Kern S, Klüter H, et al. Critical parameters for the isolation of mesenchymal stem cells from umbilical cord blood[J].Stem Cells, 2004, 22(4): 625-634.
10 Bernardo ME, Fibbe WE. Mesenchymal stromal cells: sensors and switchers of inflammation[J]. Cell Stem Cell, 2013, 13(4):392-402.
11 Luz-Crawford P, Kurte M, Bravo-Alegría J, et al. Mesenchymal stem cells generate a CD4+CD25+Foxp3+ regulatory T cell population during the differentiation process of Th1 and Th17 cells[J]. Stem Cell Research & Therapy, 2013, 4(3): 65.
12 Noone C, Kihm A, English K, et al. IFN-γ stimulated human umbilical-tissue-derived cells potently suppress NK activation and resist NK-mediated cytotoxicity in vitro[J]. Stem Cells Dev, 2013,22(22): 3003-3014.
13 English K, Barry FP, Mahon BP. Murine mesenchymal stem cells suppress dendritic cell migration, maturation and antigen presentation[J]. Immunol Lett, 2008, 115(1): 50-58.
14 Martinez FO, Gordon S. The M1 and M2 paradigm of macrophage activation : time for reassessment[J]. F1000Prime Rep, 2014, 6 :13.
15 McNelis JC, Olefsky JM. Macrophages, immunity, and metabolic disease[J]. Immunity, 2014, 41(1): 36-48.
16 Eguchi K, Manabe I. Macrophages and islet inflammation in type 2 diabetes[J]. Diabetes Obes Metab, 2013, 15(Suppl 3): 152-158.
17 Latz E, Xiao TS, Stutz A. Activation and regulation of the inflammasomes[J]. Nat Rev Immunol, 2013, 13(6): 397-411.
18 Morris DL. Minireview: Emerging Concepts in Islet Macrophage Biology in Type 2 Diabetes[J]. Mol Endocrinol, 2015, 29(7):946-962.
19 Zhou D, Huang C, Lin Z, et al. Macrophage polarization and function with emphasis on the evolving roles of coordinated regulation of cellular signaling pathways[J]. Cell Signal, 2014, 26(2): 192-197.
20 Kaneda MM, Messer KS, Ralainirina N, et al. PI3Kγ is a molecular switch that controls immune suppression[J]. Nature, 2016, 539(7629): 437-442.
21 Lu J, Xie L, Liu C, et al. PTEN/PI3k/AKT Regulates Macrophage Polarization in Emphysematous mice[J]. Scand J Immunol, 2017,85(6): 395-405.

