连续水旱轮作对水稻冷浸田土壤细菌群落结构的影响*
方 宇 王 飞 李清华 林 诚 何春梅
(福建省农业科学院土壤肥料研究所,福州 350013)
冷浸田是指山丘谷地受冷水、冷泉浸渍或湖区滩地受地下水浸渍而形成的一种强育性低产水稻田[1]。据统计,我国有冷浸田约400万hm2,已成为我国粮食增产的主要障碍之一[2]。冷浸田由于长期受冷水浸泡,具有水冷土温低、还原性强和产量低等特征[3]。然而冷浸田不同于其他的中低产田,其有机质含量丰富,潜在肥力较高,增产潜力巨大。若对冷浸田进行针对性的改良措施,提高农田的生产能力,对保障粮食生产与促进农民增收具有重要的现实意义。
水旱轮作是冷浸田土壤获得水稻高产的一项有效措施[4]。在水旱轮作条件下,由于季节性的干湿交替使得土壤中的物理和化学性质发生了一系列的变化,这势必会影响土壤中的微生物。植物根际的土壤微生物群落对不同作物的根系分泌物反应不同[5]。而根际土壤的微生物群落又会对非根际土壤的微生物群系产生影响[6]。微生物群落多样性与土壤生态系统的结构和功能密切相关,在维持土壤肥力和生态平衡中发挥着重要作用[7],对外界环境较敏感,是土壤变化的重要指示因子之一[8]。各学者关于作物轮作对土壤微生物多样性影响的研究分歧较大[9-11]。上述轮作研究多集中于障碍特征不明显的土壤类型,而针对以潜育化为主要特征的冷浸田土壤的报道尚少。水旱轮作下冷浸田土壤的研究主要集中在轮作对冷浸田土壤的理化性状和微生物数量[12]、活性碳氮磷[13]以及土壤亚铁的影响[14]。然而,冷浸田土壤细菌群落结构对水旱轮作的响应规律尚未有系统研究。
为了寻求适合冷浸田的轮作体系,提高冷浸田的生产能力,本研究通过冷浸田水旱轮作改制试验,采用高通量测序技术探讨冷浸田由单季稻改为水旱轮作制后对土壤细菌群落结构的影响,旨在为冷浸田治理利用提供理论依据。
1 材料与方法
1.1 研究区概况
试验设于农业部福建耕地保育科学野外观测实验站(闽侯县白沙镇溪头村,119°04'10″E、26°13'31″N)。所处地形为山前倾斜平原交接洼地,土壤类型为浅脚烂泥田,属潜育化程度较低的冷浸田。成土母质为低丘坡积物。试验前为单季稻-冬闲。供试土壤基本性状:有机质34.0 g kg-1、全氮2.01 g kg-1、全磷 0.32 g kg-1、全钾 13.0 g kg-1、速效氮 173.4 mg kg-1、有效磷 5.5 mg kg-1、速效钾49.5 mg kg-1,pH 5.3。
1.2 试验设计
轮作试验共设5个处理:(1)单季稻-冬闲(CK);(2)油菜-水稻(R-R);(3)春玉米-水稻(C-R);(4)紫云英-水稻(M-R);(5)蚕豆-水稻(B-R)。每处理设3次重复,采用随机区组排列。每小区面积10 m2(长4 m,宽2.5 m)。各作物品种、种植时间、种植密度、播种量及施肥方式详见王飞等[12]所述。
试验自2011年10月上旬单季稻收割后开始,连续种植4茬旱作与4茬单季稻(其中CK处理分别于2012~2015年连续4年种植单季稻,冬季空闲),2015年10月上旬结束。由于冷浸田冬季地下水位高,旱作试验前,小区内四周开环沟(30 cm×30 cm),以适当降低地下水位。旱作期结合起畦栽培,畦高20 cm。紫云英于盛花期(4月上旬)翻压,各旱作作物收获后秸秆全部粉碎回田并翻压入土,田间保持湿润状态,自然腐熟。水稻生育期各处理以浅水灌溉为主。
2015年10月份水稻收获期采用五点法采集各小区耕层土样(0~20 cm)约1 kg,部分土样风干,测定土壤理化性状;部分土样-80℃保存,用于高通量测序分析。
1.3 测定方法
土壤理化性质按常规分析方法[15]测定:土壤pH用蒸馏水浸提(土水比1∶2.5)pH计测定,有机质OM采用重铬酸钾外加热法,全氮TN用半微量凯氏定氮法,全磷TP用碱熔-钼锑抗比色法,全钾TK用NaOH熔融―火焰光度法,速效氮AN用碱解扩散法,有效磷AP用0.5 mol L-1NaHCO3浸提-钼锑抗比色法,速效钾AK用1.0 mol L-1NH4OAc 浸提―火焰光度法测定。
土壤基因组DNA的提取:利用试剂盒提取土壤基因组DNA,采用FastDNA SPIN Kit for Soil(MP Biomedicals公司,美国)试剂盒,使用超微量分光光度计(NanoDrop 2000,美国)检测DNA的浓度和纯度。DNA样品保存于-20℃冰箱待用。
16S rRNA基因的高通量测序:采用通用引物519F(CAGCMGCCGCGGTAATWC)和907R(CCGTCAATTCMTTTRAGTTT)扩增细菌16S rRNA基因的V4~V5区。正向引物序列包含5 bp的barcode序列以区分样品。 PCR反应体系为50 μl,包括25 μl的Taq DNA聚合酶(Takara),2 μl的正反向引物(10 μmol L-1),1 μl的DNA模板(约50 ng基因组),20 μl的 ddH2O。扩增条件为95 ℃预变性3 min,95 ℃变性45 s,56 ℃ 退火45 s,72 ℃ 延伸60 s,35个循环。最后72 ℃ 扩增7 min。PCR产物纯化后,等物质的量混合后,通过Illumina Miseq平台(Illumina公司,美国)进行高通量测序(中国科学院南京土壤研究所)。
1.4 数据处理
基于QIIME分析平台对原始FASTQ文件进行过滤、拼接、去除嵌合体[16]。序列比对后按照97%相似性水平划分操作分类单元(operational taxonomic unit,OTU)。每个OTU的最优势序列选作代表性序列,通过RDP提供的参考序列和分类系统[17]进行分类。采用Mothur软件计算多样性指数(Chao1、Ace、香农指数和辛普森指数)[18]。使用R软件基于Bray-Curits距离算法进行聚类分析。采用Canoco 5.0 软件对环境因子与细菌群落结构进行冗余分析(Redundancy analysis,RDA)。采用SPSS 18.0进行统计分析,单因素方差分析(One-way ANOVA)检验多处理间均值差异的显著性。
2 结 果
2.1 水旱轮作模式对冷浸田水稻产量的影响
不同水旱轮作模式对2015年冷浸田水稻产量产生了明显的影响(图1)。单季稻-冬闲(CK)处理产量最低,仅为5 737 kg hm-2;春玉米-水稻轮作(C-R)产量最高,为8 266 kg hm-2,其次为蚕豆-水稻轮作(B-R)、油菜-水稻轮作(R-R)和紫云英-水稻轮作(M-R),产量依次为7 737 kg hm-2、7 493 kg hm-2和6 783 kg hm-2。C-R、B-R、R-R和M-R轮作模式的产量分别是CK产量的1.44倍、1.35倍、1.31倍和1.18倍。
2.2 水旱轮作模式对冷浸田土壤理化性质的影响
由表1可知,水旱轮作模式对土壤有机质、全钾和速效氮含量无显著影响。B-R处理的土壤全氮含量最高,但是仅显著高于R-R处理,与其他轮作模式无显著差异。与CK相比,M-R处理的全磷含量与之无显著差异;其他轮作模式的全磷含量均得到明显提升(p< 0.05)。CK处理的有效磷含量最低,仅为14.92±0.72 mg kg-1,水旱轮作后土壤有效磷含量明显增加(p< 0.05),R-R、C-R、M-R和B-R增幅分别为80.36%、89.48%、25.80%和79.83%。CK和M-R处理的速效钾含量最低,R-R、C-R和B-R处理的速效钾含量分别是CK的1.04倍、1.12倍和1.29倍。与CK处理相比,水旱轮作模式的土壤pH值显著增加,一定程度上缓解了土壤酸化程度。
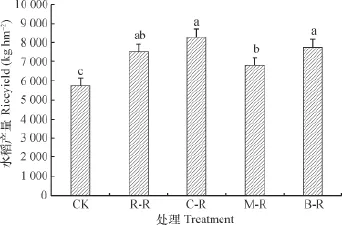
图1 不同水旱轮作模式对水稻产量的影响Fig. 1 Effect of paddy-upland rotation on rice yield relative to mode of the rotation
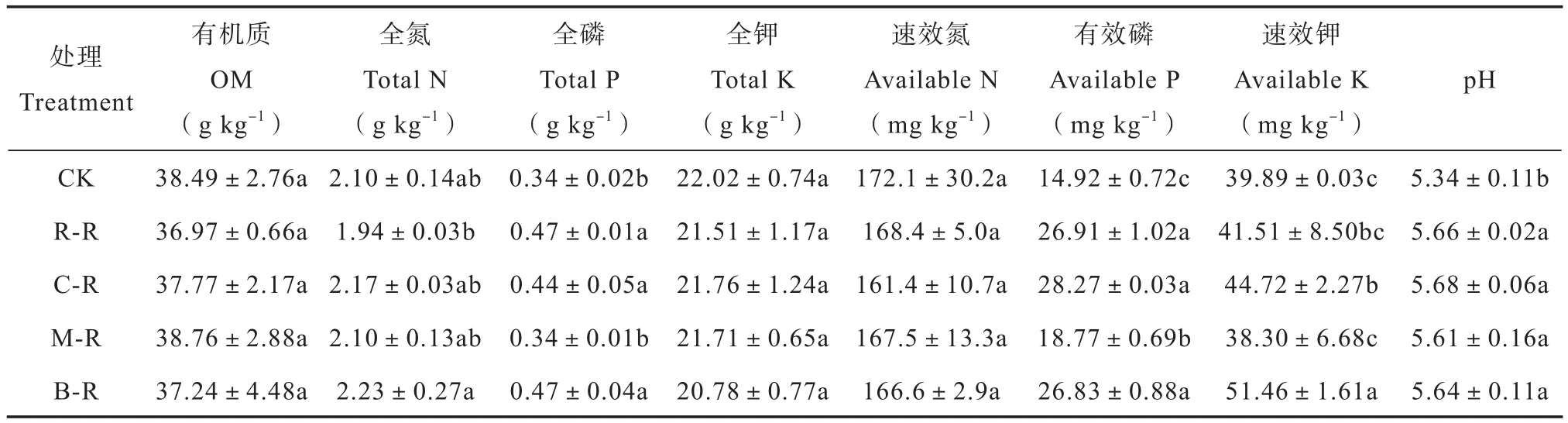
表1 不同水旱轮作模式对冷浸田土壤理化性质的影响Table 1 Effect of paddy-upland rotation on soil physico-chemical properties relative to mode of the rotation
2.3 水旱轮作模式对冷浸田土壤细菌群落丰富度和多样性的影响
Illumina高通量测序结果显示,15个土壤样品共获得有效序列283 774条,每个样品序列数为10 782~23 786条,为保证后续α和β多样性的可比性,对所有样品随机抽取10 000条序列。Chao 1指数和OTU数目反映物种丰富度。由表2可知,CK处理土壤细菌Chao 1指数最高,达3 016±135,水旱轮作模式降低了土壤细菌的丰富度,R-R、C-R、M-R和B-R处理Chao1指数较冬闲对照分别降低13.65%、13.68%、4.21%和13.99%。OTU数目与Chao 1指数显示相同的变化趋势,即水旱轮作降低了土壤细菌OTU数目。香农和辛普森指数可反映土壤细菌群落的多样性,表2显示单季稻-冬闲和水旱轮作模式土壤细菌多样性无显著性差异(p> 0.05)。
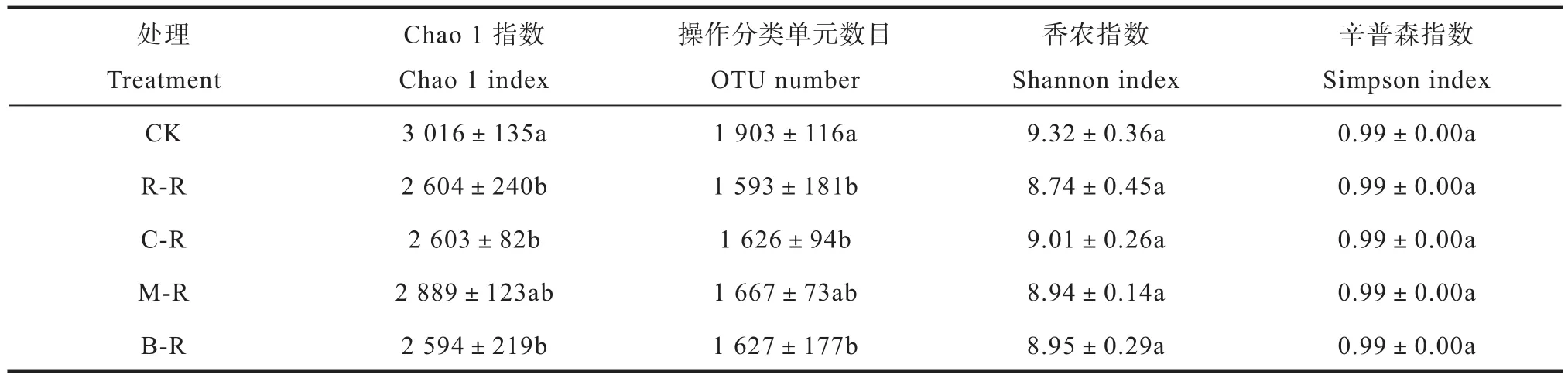
表2 不同轮作模式下土壤细菌丰富度指数与多样性指数Table 2 Diversity and richness of the soil bacteria in the soil relative to mode of the rotation
2.4 水旱轮作模式对冷浸田土壤细菌群落结构的影响
在门分类水平,各轮作处理的土壤细菌群落组成相似(相对丰度 >1%)(图2)。主要包含变形菌门(P r o t e o b a c t e r i a)、酸杆菌门(A c i d o b a c t e r i a)、 拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、放线菌门(A c t i n o b a c t e r i a)、厚壁菌门(Firmicutes)、浮霉菌门(Planctomycetes),约占全部细菌丰度的71.88%~80.09%。此外,还含有装甲菌门(Armatimonadetes)、蓝藻门(Cyanobacteria)、迷踪菌门(Elusimicrobia)、芽单胞菌门(Gemmatimonadetes)、硝化螺旋菌门(Nitrospirae)和疣微菌门(Verrucomicrobia)等相对丰度较低(<1%)的细菌群落。各样品中还有14.92%~22.89%的菌,属于目前分类学无法划分的细菌种类。
变形菌门是土壤中最为优势的菌群,占41.61%~44.82%。变形菌门的4个亚群的分布在各轮作处理间发生了变化(图3)。与C K相比,水旱轮作土壤α-变形菌和γ-变形菌相对含量呈增加趋势(p< 0.05),分别增加了49.42%~82.58%和38.92%~61.48%。而δ-变形菌相对丰度从CK处理的14.95%下降至水旱轮作处理的8.95%~11.29%。属于α-变形菌的根瘤菌目(Rhizobiales)轮作后丰度显著增加(p<0.05)。酸杆菌门(Acidobacteria)是冷浸田土壤中第2大优势菌群,其丰度在CK处理中最低为14.18%,水旱轮作模式明显增加了酸杆菌的丰度(p< 0.05),R-R、C-R、M-R和B-R分别较CK处理增加了62.36%、48.84%、33.48%和51.78%,表明水旱轮作的土壤环境更有利于酸杆菌门的生长。
在门分类水平还有部分细菌菌群的相对丰度也发生了显著变化。例如,放线菌门(Actinobacteria)、硝化螺旋菌门(Nitrospirae)和绿弯菌门(Chloroflexi)在CK、R-R、C-R、M-R和B-R中的相对丰度分别为1.10%、1.40%、1.55%、2.01%、1.62%;0.35%、0.75%、0.98%、0.75%、0.81%和7.61%、4.59%、5.33%、4.84%、4.96%。与CK相比,水旱轮作土壤放线菌门和硝化螺旋菌门相对丰度分别增加27.27%~82.73%和114.3%~180.0%。而绿弯菌门(Chloroflexi)相对丰度则减少29.96%~39.68%。
土壤细菌群落在属水平的分布也发生了改变(图4)。各水旱轮作处理中土壤GP1、GP3、GP6、GP18、Sideroxydans、u n c l a s s i f i e d A l p h a p r o t e o b a c t e r i a、u n c l a s s i f i e d B e t a p r o t e o b a c t e r i a、u n c l a s s i f i e d D e l t a p r o t e o b a c t e r i a、unclassified Rhodospirillaceae、unclassified Rhizobiales、Pseudolabrys、Bradyrhizobium、Rhizomicrobium、unclassified Chloroflexi、unclassif ied Anaerolineaceae、unclassified Bacteroidetes的相对丰度> 1%。其中酸杆菌门包含的菌属最多,GP1、GP3、GP6和GP18占全部菌属的9.79%~17.19%。在不同轮作处理中有一些丰度发生显著变化的属,例如GP1、亚硝化螺菌属(Nitrosospira)、慢生根瘤菌属(Bradyrhizobium)、Rhizomicrobiu m在CK处理中含量最低,水旱轮作后相对丰度分别增加61.77%~265.3%、67.76%~113.6%、4.78%~60.75%和99.18%~194.6%;铁氧化属细菌(Sideroxydans)相对丰度在CK处理中最高,轮作后相对丰度减少33.68%~57.85%。
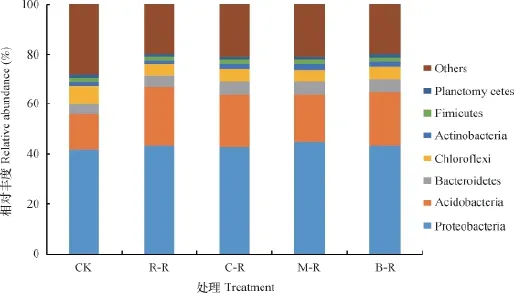
图2 各水旱轮作处理土壤细菌群落在门水平上的组成和相对丰度Fig. 2 Composition and relative abundance of the bacterial community at the phylum level in the soil relative to mode of the rotation
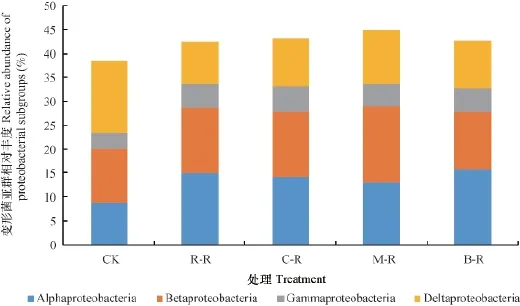
图3 各水旱轮作处理土壤变形菌亚群分布情况Fig. 3 Distribution of proteobacterial subgr oups in the soil relative to mode of the rotation
2.5 聚类分析
对样品进行聚类分析,如图5所示。样品可以分为2大类,第1类:CK和M-R;第2类:R-R、C-R和B-R。单季稻-冬闲和紫云英-水稻轮作之间土壤细菌群落结构无明显差异。玉米、蚕豆和油菜这3种旱作作物与水稻轮作对土壤细菌群落结构无明显影响。
2.6 环境因子对水旱轮作冷浸田水稻土壤细菌群落结构的影响
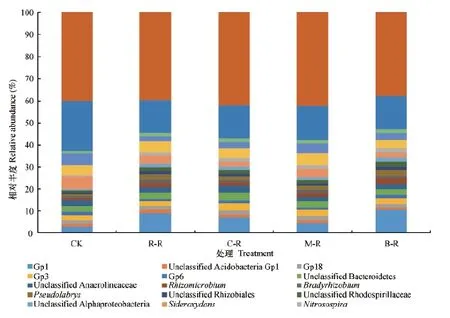
图4 各水旱轮作处理土壤细菌群落在属水平上的组成和相对丰度Fig. 4 Composition and relative abundance of the bacterial community at the genus level in the soil relative to mode of the rotation
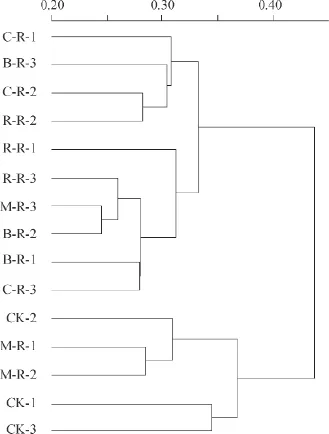
图5 不同水旱轮作处理的土壤细菌群落结构相似度树状图Fig.5 Dendrogram of hierarchical cluster analysis of the bacterial community in the soil relative to mode of the rotation
土壤理化因子和细菌群落多样性相关性分析见表3。OTU数目、Chao1指数和理化因子间有着密切的相关性。其中OTU数目与TP、AP呈显著负相关(p< 0.05);Chao1指数与TP和AP呈极显著负相关(p< 0.01);OTU数目、Chao1指数与TK呈显著正相关(p< 0.05)。用Spearman’s系数对土壤优势菌(门水平)、变形菌亚群和土壤理化性质进行相关性分析(表4)。结果显示α-变形菌的相对丰度与TP、pH呈极显著正相关(p<0.01);δ-变形菌门与TP、AP呈显著负相关(p< 0.05),与pH呈极显著负相关(p< 0.01);γ-变形菌门相对丰度与AP呈极显著正相关(p<0.01),与pH呈显著正相关(p< 0.05);酸杆菌门的相对丰度与TP呈显著正相关(p< 0.05),与pH呈极显著正相关(p< 0.01),与TK呈显著负相关(p< 0.05);绿弯菌门相对丰度与pH呈显著负相关(p< 0.05)。
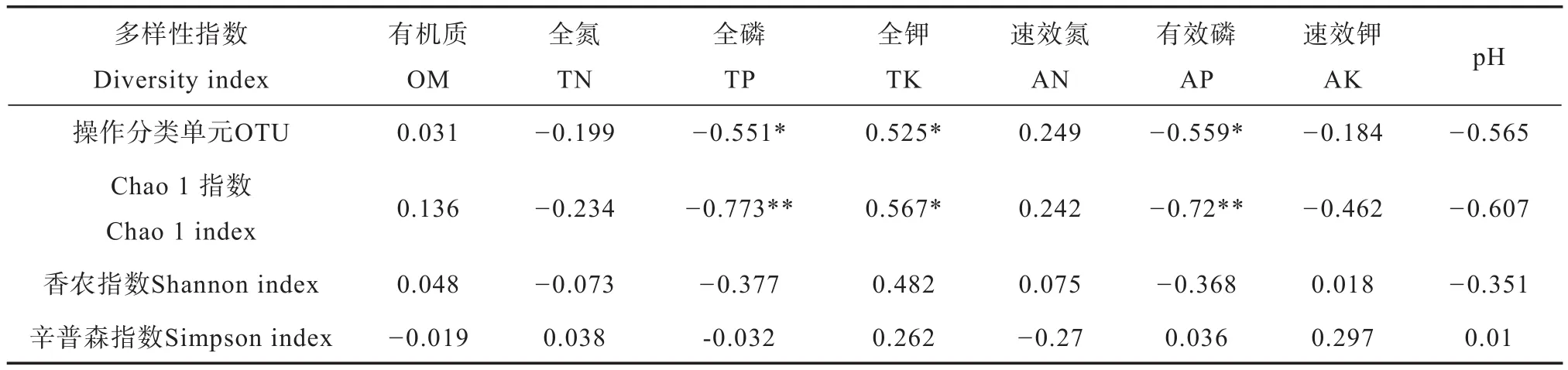
表3 土壤性质与细菌群落多样性指数的相关性Table 3 Relationships between soil properties and bacterial diversity index
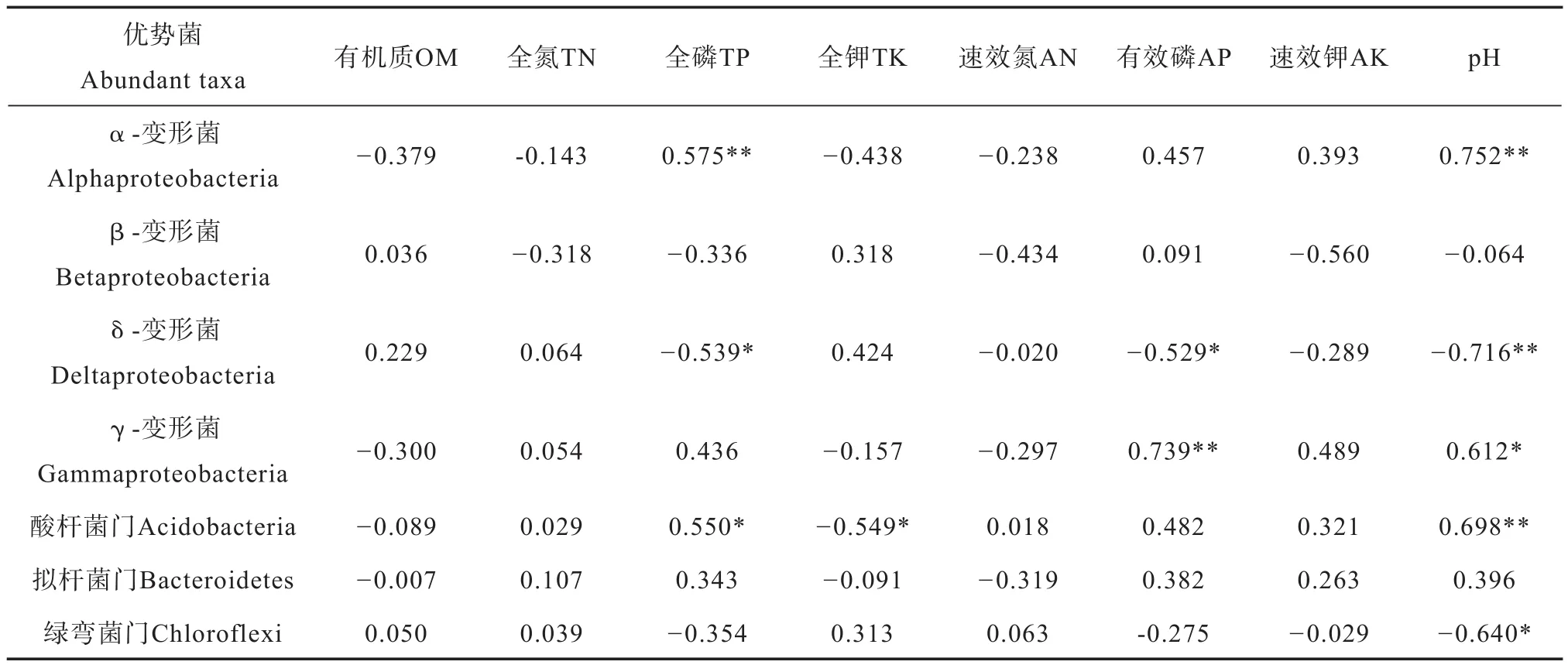
表4 土壤性质与细菌优势菌的相关性Table 4 Relationships between soil properties and dominant bacterial taxa (RA >3% in all samples)
通过CANOCO软件对环境因子和土壤细菌群落进行RDA分析。由图6可知,第一排序轴和第二排序轴分别解释了细菌群落变化的54.92%和10.75%,两者之和达65.67%,表明本研究选择的环境因子能较好地解释土壤细菌群落。M-R和CK处理位于一、四象限,B-R、C-R和R-R处理位于二、三象限。经过蒙特卡罗检验,土壤pH(F=7.9,P= 0.002)、AP(F= 6.2,P= 0.002)和TP(F= 5.2,P= 0.018)对细菌群落结构的影响达到显著水平。
3 讨 论
单季稻-冬闲(CK)处理水稻产量最低,水旱轮作后产量呈增加趋势:M-R< R-R< B-R< C-R。轮作增加水稻产量这一结论与Xuan等[11]的结果相一致。然而由于轮作作物种类和施入肥料的差异,水稻产量的增幅存在差异。C-R处理水稻产量最高为8 266 kg hm-2,较CK产量高44.12%。产量的增加可能与旱作期收获物带走的养分量低于施肥量和秸秆还田养分量有关[12]。水旱轮作后土壤部分理化因子也发生了变化。与CK相比,水旱轮作后土壤TP、AP、AK和pH明显增加,这可能是由于旱作植物秸秆还田后可以当做肥料使用的原因。值得注意的是,紫云英-水稻轮作处理中种植紫云英时没有施用氮肥,然而土壤TN和AN含量与其他轮作处理间并无显著差异,这是由于绿肥的高效固氮能力和快速生物积累特性造成的[19]。CK处理土壤pH最低,水旱轮作后pH明显增加,这在一定程度上缓解了土壤的酸化现象,这可能与旱作秸秆还田下盐基离子释放有关。
本研究采用高通量测序技术对冷浸田不同水旱轮作模式下土壤细菌群落多样性进行了分析研究。结果显示,与CK相比,水稻与紫云英、蚕豆、玉米和油菜轮作后土壤细菌的丰富度降低,各轮作处理间丰富度没有显著差异。水旱轮作后土壤细菌多样性指数与冬闲处理无显著差异(表2)。以上结果表明水稻产量与土壤的细菌多样性之间并没有明显的因果关系[11]。较低的土壤细菌多样性未必表示差的生态系统,较低的多样性也未必暗示着它们是不稳定或不健康的微生物群落[20]。
相比水稻-冬闲处理,水旱轮作并未显著改变冷浸田土壤的细菌群落结构,只是部分类别的细菌相对丰度发生变化。在门分类水平,土壤细菌以变形菌门为绝对优势菌,占细菌群落的41.61%~44.82%。酸杆菌门广泛存在于自然界的各种环境中,是土壤微生物的重要成员,约占土壤细菌类群的5%~46%[21]。本研究中酸杆菌门的相对丰度为18.92%~23.02%,仅次于变形菌门,这与Fang等[22]的研究相一致。土地种植方式的改变对土壤微生物群落结构会产生显著影响。例如,轮作后土壤变形菌的亚群分布发生了明显变化,α-变形菌和γ-变形菌从CK处理的8.67%、3.32%增加至轮作后的12.92%~15.79%和4.61%~5.37%。Rousk等[23]报道α-变形菌和γ-变形菌的相对丰度随着pH的增加而增多,本研究结果也显示轮作后土壤pH增加,同时α-变形菌和γ-变形菌的相对丰度也得到明显提升(表1和图3)。α-变形菌中的慢生根瘤菌属(Bradyrhizobium)在轮作土壤中丰度显著增加,它们是水稻生态系统中活跃的固氮细菌[24]。而δ-变形菌相对含量在CK处理中含量最高(14.95%),轮作后丰度明显降低(8.95%~11.29%)。水旱轮作后酸杆菌丰度明显增加,其相对含量与土壤全磷含量呈显著正相关(p< 0.05),而轮作处理(除M-R处理)能够显著增加土壤全磷含量。Eichorst等[25]报道酸杆菌能够降解复杂的碳化合物例如纤维素和木聚糖等。轮作处理中旱作植物秸秆还田增加了土壤中纤维素等复杂碳化合物的输入,导致酸杆菌的增多。同时本研究发现酸杆菌与土壤pH呈极显著正相关,而Mannisto[26]和Griffiths[27]等的研究结果表明酸杆菌丰度与pH呈显著负相关。也有研究表明,酸杆菌相对丰度与土壤pH相关性不显著[28]。由于一些酸杆菌的基因序列也在中性、甚至碱性的环境中被检测出来[29],所以酸杆菌相对含量和pH的关系还有待进一步研究。与CK相比,水旱轮作后土壤放线菌和硝化螺旋菌相对丰度明显增加。放线菌能够降解复杂的木质素[30]和纤维素[31]。旱作植物秸秆还田能够增加木质素和纤维素的输入,从而刺激了放线菌的生长。硝化螺旋菌可将亚硝酸盐氧化成硝酸盐,提高土壤氮素的利用率,从而促进水稻的生长,增加其产量。与CK相比,水旱轮作增加了慢生根瘤菌属以及亚硝化螺菌属的丰度,这些菌属与土壤氮循环(固氮作用和硝化作用第一步)均有着密切的联系。
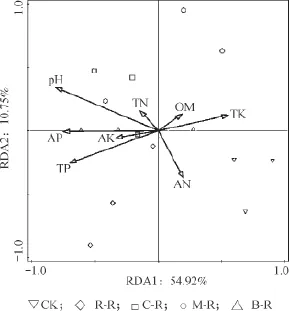
图6 土壤细菌群落结构和土壤理化因子的RDA分析Fig.6 Redundancy analysis (RDA) of soil bacterial community structure and soil properties
冷浸田土壤由于其自身的生态特征,使之区别于高产田。王秀呈[32]报道水稻-绿肥轮作下红壤水稻土细菌类群主要为变形菌门、酸杆菌门、放线菌门、厚壁菌门、拟杆菌门、绿弯菌门、疣微菌门、浮霉菌门以及芽单胞菌门。本研究中冷浸田土壤细菌主要类群与之类似,然而某些类别的细菌丰度存在明显差异。例如冷浸田轮作土壤放线菌丰度明显低于红壤水稻土,可能是由于放线菌一般是好气性微生物,而冷浸田土壤长期处于还原性条件,不利于放线菌的生长。
许多研究表明环境因子能够影响微生物群落结构[33-34]。本研究发现细菌的某些优势菌和变形菌亚群与土壤pH高度相关。许多研究已经证实土壤pH是影响细菌群落结构的重要因子[35-36]。此外,土壤的其他理化性质如TP、AP和细菌的某些优势菌和变形菌亚群也呈显著相关(表4)。例如,α-变形菌与土壤TP呈极显著正相关,这就解释了CK和M-R处理中含有较低丰度的α-变形菌。由RDA分析可知,土壤pH、全磷和有效磷是影响水旱轮作土壤细菌群落结构的主要因子。秦红等[37]研究结果也表明全磷和有效磷的含量是影响细菌群落结构的重要因素。B-R、C-R和R-R处理的土壤全磷和有效磷含量均显著高于CK和M-R处理。这可能是由于B-R、C-R和R-R轮作模式下磷肥的盈余(收获物带走的磷低于施肥量)高于CK和M-R处理[12],从而导致了土壤细菌群落结构的变化。
4 结 论
与冬闲对照相比,水旱轮作通过提高土壤全磷、有效磷、速效钾含量,缓解土壤酸化程度而增加水稻产量。水旱轮作土壤细菌丰富度降低,多样性指数与对照没有显著差异。变形菌门和酸杆菌门为研究区土壤中的优势细菌类群。轮作后酸杆菌、放线菌、硝化螺旋菌、慢生根瘤菌以及亚硝化螺菌等参与碳氮循环的菌群丰度显著增加。土壤pH、AP和TP是影响水旱轮作冷浸田土壤细菌群落分布的主要因子。
[ 1 ] Dickopp J,Kazda M,Čížková H. Differences in rhizome aeration ofPhragmitesaustralisin a constructed wetland. Ecological Engineering,2011,37(11):1647—1653
[ 2 ] 曾燕,黄敏,蒋鹏,等. 冷浸田条件下不同类型品种的表现和高产栽培方式研究. 作物研究,2010,24(3):140—144 Zeng Y,Huang M,Jiang P,et al. Studies on yield performance and high yielding cultivation methods of different types of cultivars in cold water paddy field(In Chinese). Crop Research,2010,24(3):140—144
[ 3 ] 柴娟娟,廖敏,徐培智,等. 我国主要低产水稻冷浸田养分障碍因子特征分析. 水土保持学报,2012,26(2):284—288 Chai J J,Liao M,Xu P Z,et al. Feature analysis on nutrient’s restrictive factors of major low productive waterlogged paddy soil in China(In Chinese).Journal of Soil Water Conservation,2012,26(2):284—288
[ 4 ] 龚子同,张效朴,韦启璠. 我国潜育性水稻土的形成、特性及增产潜力. 中国农业科学,1990,23(1):45—53 Gong Z T,Zhang X P,Wei Q F. The formation,characterization and potential of gleyic paddy soils in China(In Chinese). Scientia Agricultura Sinica,1990,23(1):45—53
[ 5 ] Costa R,Götz M,Mrotzek N,et al. Effects of site and plant species on rhizosphere community structure as revealed by molecular analysis of microbial guilds.FEMS Microbiology Ecology,2006,56(2):236—249
[ 6 ] Kent A D,Triplett E W. Microibal communities and their interactions in soil and rhizosphere ecosystems.Annual Review of Microbiology,2002,56(1):211—236
[ 7 ] Jacobsen C S,Hjelmsø M H. Agricultural soils,pesticides and microbial diversity. Current Opinion in Biotechnology,2014,27(5):15—20
[ 8 ] 张薇,魏海雷,高洪文,等. 土壤微生物多样性及其环境影响因子研究进展. 生态学杂志,2005,24(1):48—52 Zhang W,Wei H L,Gao H W,et al. Advances of studies on soil microbial diversity and environmental impact factors(In Chinese). Chinese Journal of Ecology,2005,24(1):48—52
[ 9 ] Yin C T,Jones K L,Peterson D E,et al. Members of soil bacterial communities sensitive to tillage and crop rotation. Soil Biology & Biochemistry,2010,42:2111—2118
[10] Navarro—Noya Y E,Gómez—Acata S,Montoya—Ciriaco N,et al. Relative impacts of tillage,residue management and crop—rotation on soil bacterial communities in a semi—arid agroecosystem. Soil Biology & Biochemistry,2013,65:86—95
[11] Xuan D T,Guong V T,Rosling A,et al. Different crop rotation systems as drivers of change in soil bacterial community structure and yield of rice,Oryzasativa. Biology and Fertility of Soils,2012,48(2):217—225
[12] 王飞,李清华,林诚,等. 冷浸田水旱轮作对作物生产及土壤特性的影响. 应用生态学报,2015,26(5):1469—1476 Wang F,Li Q H,Lin C,et al. Influences of paddy rice—upland crop rotation of cold—waterlogged paddy field on crops production and soil characteristics(In Chinese). Chinese Journal of Applied Ecology,2015,26(5):1469—1476
[13] 李清华,王飞,林诚,等. 水旱轮作对冷浸田土壤碳、氮、磷养分活化的影响. 水土保持学报,2015,29(6):113—117 Li Q H,Wang F,Lin C,et al. Effects of paddy—upland rotation on the nutrient activation of soil carbon,nitrogen and phosphorus in cold waterlogged paddy field(In Chinese). Journal of Soil and Water Conservation,2015,29(6):113—117
[14] 林海波,陈正刚,张钦,等. 不同耕作措施对冷浸田亚铁和水稻产量的影响. 广东农业科学,2015(8):1—4 Lin H B,Chen Z G,Zhang Q,et al. Effects of different tillage practices on ferrous and rice yield in cold waterlogged paddy field(In Chinese).Guangdong Agricultural Sciences,2015(8):1—4
[15] 鲁如坤. 土壤农化分析方法. 北京:中国农业科学技术出版社,2000 Lu R K. Analytical methods for soil and agrochemistry(In Chinese). Beijing:China Agricultural Science and Technology Press,2000
[16] Zhou J,Guan D W,Zhou B K,et al. Influence of 34—years of fertilization on bacterial communities in an intensively cultivated black soil in northeast China.Soil Biology and Biochemistry,2015,90:42—51
[17] Wang Q,Garrity G M,Tiedje J M,et al. Naïve bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy. Applied and Environmental Microbiology,2007,73(16):5261—5267
[18] Schloss P D,Gevers D,Westcott S L. Reducing the effects of PCR amplification and sequencing artifacts on 16S rRNA—based studies. PLoS ONE,2011,DOI:10.1371/journal.pone.0027310
[19] Lee C H,Park K D,Jung K Y,et al. Effect of Chinese milk vetch(AstragalussinicusL.)as a green manure on rice productivity and methane emission in paddy soil. Agriculture,Ecosystems and Environment,2010,138(3/4):343—347
[20] Shade A. Diversity is the question,not the answer.The ISME Journal,2017,11(1):1—6
[21] Ellis R J,Morgan P,Weightman A J,et al.Cultivation—dependent and independent approaches for determining bacterial diversity in heavy—metal contaminated soil. Applied and Environmental Microbiology,2003,69(6):3223—3230
[22] Fang Y,Wang F,Chen J J,et al. Microbial responses in a cold waterlogged paddy field to different distances from a drainage ditch. Chilean Journal of Agricultural Research,2017,77(1):87—94
[23] Rousk J,Baath E,Brookes P C,et al. Soil bacterial and fungal communities across a pH gradient in an arable soil. The ISME Journal,2010,4(10):1340—1351
[24] C h a i n t r e u i l C,G i r a u d E,P r i n Y,e t a l.PhotosyntheticBradyrhizobiaare natural endophytes of the African wild riceOryzabreviligulata. Applied and Environmental Microbiology,2000,66(12):5437—5447
[25] Eichorst S A,Kuske C R,Schmidt T M. Inf l uence of plant polymers on the distribution and cultivation of bacteria in the phylumAcidobacteria. Applied and Environmental Microbiology,2011,77(2):586—596
[26] Mannisto M K,Tiirola M,Haggblom M M. Bacterial communities in Arctic fields of Finnish Lapland are stable but highly pH—dependent. FEMS Microbiology Ecology,2007,59(2):452—465
[27] Griffiths R I,Thomson B C,James P,et al. The bacterial biogeography of British soils. Environmental Microbiology,2011,13(6):1642—1654
[28] Liu J J,Sui Y Y,Yu Z H,et al. Soil carbon content drives the biogeographical distribution of fungal communities in the black soil zone of Northeast China.Soil Biology & Biochemistry,2015,83:29—39
[29] Xiong J B,Liu Y Q,Lin X G,et al. Geographic distance and pH drive bacterial distribution in alkaline lake sediments across Tibetan Plateau. Environmental Microbiology,2012,14(9):2457—2466
[30] Lynd L R,Weimer P J,Zyl W H V,et al. Microbial cellulose utilization:Fundamentals and biotechnology.Microbiology and Molecular Biology Reviews,2002,66(3):506—577
[31] Pankratov T A,Ivanova A O,Dedysh S N,et al. Bacterial populations and environmental factors controlling cellulose degradation in an acidicsphagnumpeat. Environmental Microbiology,2011,13(7):1800—1814
[32] 王秀呈. 稻—稻—绿肥长期轮作对水稻土壤及根系细菌群落的影响. 北京:中国农业科学院,2015 Wang X C. The influence of long term rice—rice—green manure rotation on rice bulk soil and root—associated bacteria(In Chinese). Beijing:Chinese Academy of Agricultural Sciences,2015
[33] 沈冰洁,祝贞科,袁红朝,等. 不同种植方式对亚热带红壤微生物多样性的影响. 环境科学,2015,36(10):3839—3844 Shen B J,Zhu Z K,Yuan H C,et al. Effects of different plantation type on the abundance and diversity of soil microbes in subtropical red soils(In Chinese).Environmental Science,2015,36(10):3839—3844
[34] Jiang Y J,Liang Y T,Li C M,et al. Crop rotations alter bacterial and fungal diversity in paddy soils across East Asia. Soil Biology & Biochemistry,2016,95:250—261
[35] Lauber C L,Hamady M,Knight R,et al.Pyrosequencing—based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale. Applied and Environmental Microbiology,2009,75(15):5111—5120
[36] Chu H,Fierer N,Lauber C L,et al. Soil bacterial diversity in the Arctic is not fundamentally different from that found in other biomes. Environmental Microbiology,2010,12(11):2998—3006
[37] 秦红,李昌晓,任庆水. 不同土地利用方式对三峡库区消落带土壤细菌和真菌多样性的影响. 生态学报,2017,37(10):3494—3504 Qin H,Li C X,Ren Q S. Effects of different land use patterns on soil bacterial and fungal biodiversity in the hydro—fluctuation zone of the Three Gorges Reservoir region(In Chinese). Acta Ecologica Sinica,2017,37(10):3494—3504

