TLR4受体抑制剂对脂多糖诱导的小胶质细胞炎症因子的影响
陈超 杨炼红
炎症反应是中枢神经系统疾病的一个病理过程,小胶质细胞是其主要的免疫监视细胞。小胶质细胞的过度活化,使特定的炎症因子增多,从而导致中枢神经系统疾病[1-2]。免疫异常是中枢神经系统疾病的主要原因之一。脂多糖(Lipopolysacchairde,LPS)是革兰氏阴性细菌的细胞壁成分之一,是常用的小胶质细胞激活剂。当小胶质细胞被脂多糖激活后将释放大量的炎症介质,如白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α),从而导致中枢神经系统疾病的发生[3-4]。因此,抑制小胶质细胞的活化,减少炎症因子的分泌,将成为治疗中枢神经系统炎症性疾病的一种方法。正常条件下,Toll样受体(TLRs)在脑细胞内表达量很低,当在细胞受到损伤时TLRs表达迅速增加,并作用于下游信号分子,使编码炎症的相关分子及细胞因子的基因转录[5-6]。其中TLR4在小胶质细胞的激活及炎症诱导中起重要作用。TAK-242是TLR4受体的特异性抑制剂[7]。本实验通过脂多糖处理BV2细胞构建炎症细胞模型,并使用TAK-242预处理细胞,观察TLR4信号通路炎症因子的变化。
材料与方法
一、材料
BV2细胞株为本实验室刘军教授所赠、DMEM/F12培养基、胎牛血清、PBS、胰酶、双抗均购自美国Glibco公司;脂多糖购自美国Sigma公司;TAK-242购自美国MCE公司;CCK-8试剂盒购自日本同仁公司;Trizol、逆转录试剂盒Prime Script RT Master Mix和PCR扩增试剂SYBR Premix Ex Taq Ⅱ购于日本Takara公司;引物为华大基因合成,序列如下:TLR4 上游序列:5′-GGCACTGCATGTGACTTTCC-3′;TLR4下游序列:5′-CTCAGACTCGGCACTTAGCA -3′。MyD88上游序列:5′-CTGGCCTGAGCAACT AGGAC-3′;MyD88下游序列:5′-CGAGGAGGCATG TGTGTACT-3′。IL-1β上游序列:5′-AGAGCCCAT CCTCTGTGACT-3′;IL-1β下游序列:5′-GGAGCCT GTAGTGCAGTTGT-3′。IL-6上游序列:5′-CTGGT CTTCTGGAGTACCATAGC-3′;IL-6下游序列:5′-TGTGACTCCAGCTTATCTCTTGG-3′。内参β-actin上游序列:5′-TGAGCGCAAGTACTCTGTGTG-3′;内参β-actin下游序列:5′-CAGCTCAGTAACAGTCCGC CTA-3′。
二、BV2细胞的培养方法
复苏BV2细胞,用含10%的胎牛血清、1%的双抗的DMEM/F12培养基培养,置于37℃,5%CO2的恒温培养箱中进行常规培养,每24 h换液一次,待细胞长至80%左右按1∶10进行传代。将细胞以2×105/孔的密度接种于6孔板中,恒温培养箱常规培养24小时后显微镜下观察,当细胞密度在60%~70%时进行实验处理。
三、实验分组
1.CCK-8法检测细胞活力:(1)用不同浓度的TAK-242处理小胶质细胞,24 h后计算BV2细胞的存活率。(2)用不同浓度的TAK-242预处理BV2细胞,1 h后再加入脂多糖,24 h候计算细胞存活率。
2.qRT-PCR法检测细胞因子的mRNA表达:(1)探讨不同浓度的LPS对BV2细胞的影响:将BV2细胞分为4组,分别为空白(对照)组、LPS 0.1 μg/mL组、LPS 0.5 μg/mL组、LPS 1 μg/mL组。(2)探讨TAK-242预处理BV2细胞1 h后的影响:将BV2细胞分为4组,分别为空白(对照)组、TAK-242组、LPS组和TAK-242+LPS组。
四、CCK-8法检测细胞存活率
酶联免疫检测仪检测450 nm的吸光度值。细胞存活率=(加药组OD值-不加细胞组OD值)/(空白对照组OD值-不加细胞组OD值)×100%。
五、实时荧光定量PCR法
按常规方法使用Trizol提取细胞RNA,然后使用NanoDrop 2000分光度计(美国Thermo Scientific公司)测浓度,测量后进行逆转录为cDNA,再使用罗氏96荧光定量PCR仪(美国Roche Applied Science公司)进行荧光定量检测,获得各组CT值。基因结果通过2-△△Ct值进行比较。
六、统计学分析

结 果
一、不同浓度TAK-242对BV2细胞活力的影响
为了评估TAK-242对BV2细胞的毒性作用,用不同浓度的TAK-242处理BV2细胞24小时,CCK-8结果显示:低浓度的TAK-242(0、0.01、0.1、1 uM)作用时未明显影响细胞活力,但随着TAK-242浓度的增加(2、5、10 uM),细胞的活力下降。见图1。
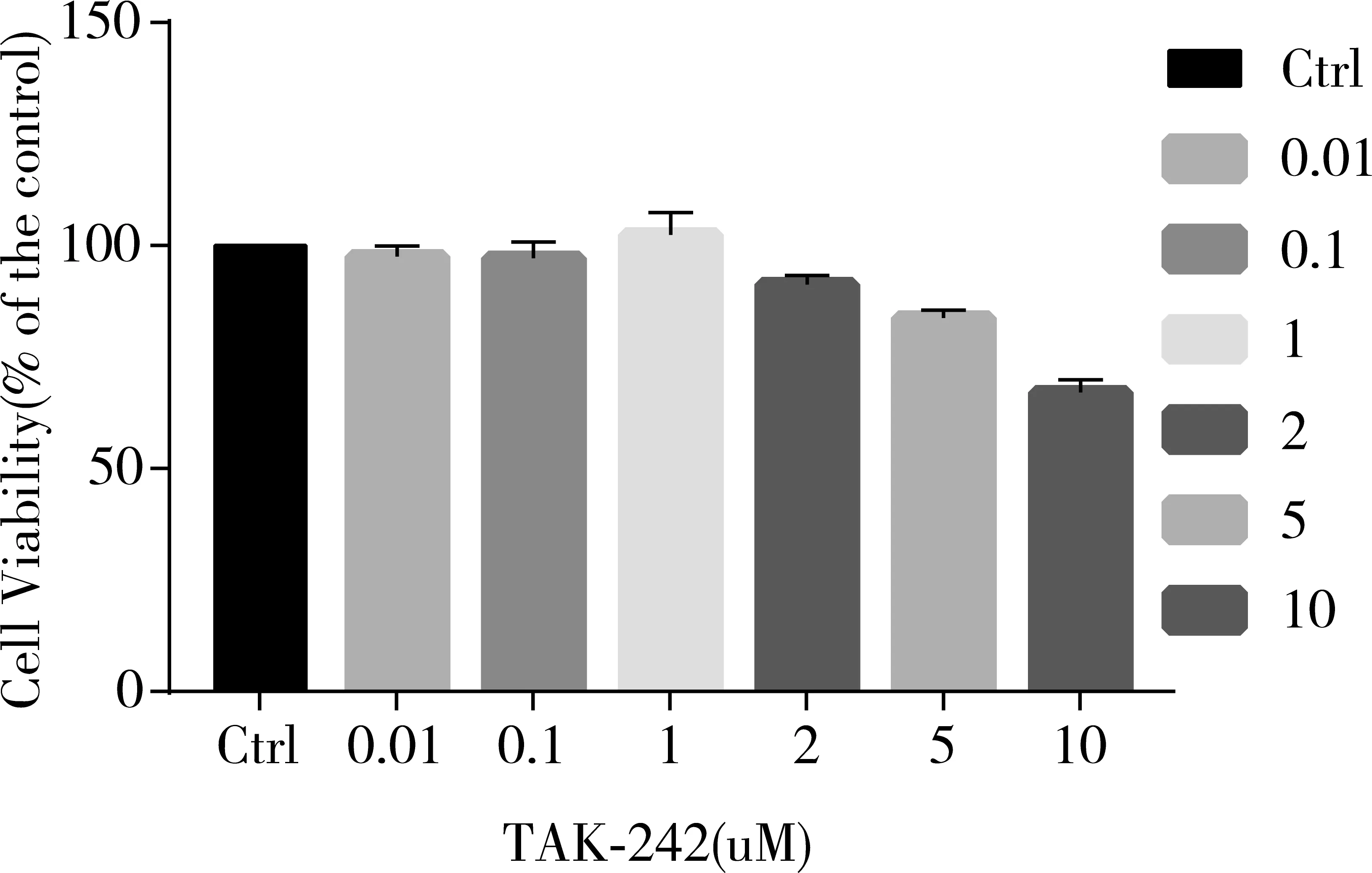
图1 CCK-8法检测不同浓度的TAK-242对BV2细胞活力的影响
二、TAK-242对LPS诱导的BV2细胞活力的影响
BV2细胞在TAK-242(0、0.01、0.1、1、2、5、10 uM)预处理1 h,然后加入1 μg/mL的LPS培养24 h。与空白组相比,LPS组细胞活力明显下降(P<0.05);与LPS组相比,低剂量TAK-242(0、0.01、0.1、1 uM)2预处理1 h后,细胞活力上升,且呈浓度依赖性(P<0.05)。因此TAK-242 1 uM用于后续实验。见图2。

注:a与空白对照组比较:P<0.05;b与LPS组比较:P<0.05。
图2CCK-8法检测TAK-242预处理BV2细胞活力的影响
三、不同浓度的LPS作用于BV2细胞后炎症因子mRNA表达情况
不同浓度的LPS(0.1、0.5、1 μg/mL)处理的实验组与空白对照组比较TLR4mRNA表达不同,差异具有显著性(P<0.05),且呈浓度依赖性。见图3。
四、TAK-242预处理后BV2细胞TLR4、MyD88、IL-1β、IL-6 mRNA表达情况
不同浓度的TAK-242预处理BV2细胞1 h后,再加入1 ug/mL的LPS培养24 h。与空白组比较,LPS组的TLR4、MyD88、IL-1β、IL-6 mRNA表达明显升高,差异具有显著性(P<0.05);与LPS组相比,TAK-242预处理1 h后,TLR4、MyD88、IL-1β、IL-6 mRNA表达下降,差异有统计学意义(P<0.05)。见图4-7。

注:与空白对照组比较:P<0.05。
图3荧光定量RCR法检测不同浓度的LPS作用于BV2后TLR4mRNA表达情况
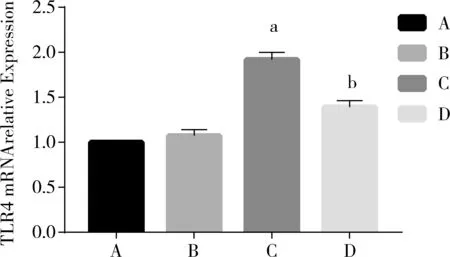
注:A为空白对照组;B为TAK-242组;C为LPS组;D为TAK-242预处理组;a与空白对照组比较:P<0.05;b与LPS组比较:P<0.05。
图4荧光定量RCR法检测各组细胞TLR4mRNA表达情况
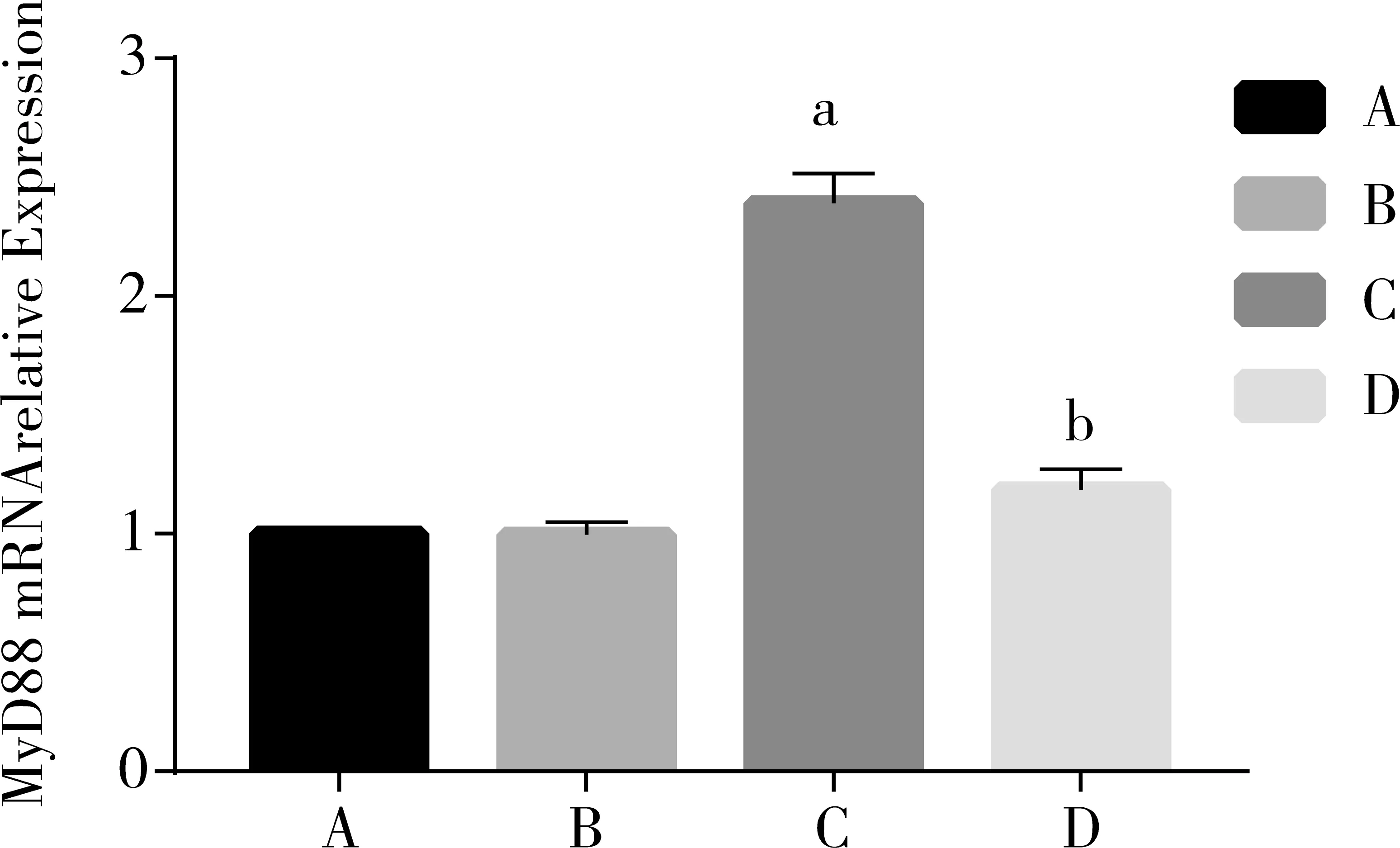
注:A为空白对照组;B为TAK-242组;C为LPS组;D为TAK-242预处理组;a与空白对照组比较:P<0.05。b与LPS组比较:P<0.05。
图5荧光定量RCR法检测各组细胞MyD88mRNA表达情况

注:A为空白对照组;B为TAK-242组;C为LPS组;D为TAK-242预处理组;a与空白对照组比较:P<0.05;b与LPS组比较:P<0.05。
图6荧光定量RCR法检测各组细胞IL-1βmRNA表达情况

注:A为空白对照组;B为TAK-242组;C为LPS组;D为TAK-242预处理组;a与空白对照组比较:P<0.05;b与LPS组比较:P<0.05。
图7荧光定量RCR法检测各组细胞IL-6mRNA表达情况
讨 论
癫痫是一组由大脑神经元异常放电所引起的,以短暂性中枢神经系统功能失调为特征的慢性脑部疾病,是神经内科的常见病多发病之一。流行病学资料显示,癫痫的年发病率为(50-70)/10万,年患病率为5%[8]。癫痫的反复发作,不仅严重的影响了患者的工作、学习和生活质量,也为其家庭带来了严重的负担[9-10]。既往主要研究神经元与癫痫的关系,近期越来越多的研究表明,小胶质细胞的炎症反应可能和癫痫的发生和发展相关[11-12]。癫痫的发病过程中伴随着免疫紊乱或异常,且TLR4/MyD88信号通路参与这一过程[13-14]。因此,我们希望通过研究TLR4/MyD88这一炎症信号通路来研究新的治疗方法,寻找新的药物,提高患者的生活质量、减轻家庭负担。
TLR是免疫系统中的重要分子之一,其主要是通过先天性免疫反应识别病原体[15]。目前主要有11个TLR家族成员被发现(TLR1-TLR11),但TLR4是最早被发现且研究较多的受体[16]。TLR4在中枢神经系统的神经元、小胶质细胞等细胞中均有表达,其中小胶质细胞表达最多[17]。TLR4通过两条通路发挥作用,一是髓样分化因子88(MyD88)依赖性通路,二是非依赖性通路,但是MyD88信号通路为其主要通路。MyD88是TLR4下游的一个重要接头分子,通过LPS的刺激,MyD88募集并激活IL-1受体激酶-4(IRAK-4)和TNF受体相关因子-6(TARAF-6)[18],进而激活丝裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK),并作用于核因子κB(NF-κB)调节下游的炎症因子转录,导致大量的炎症因子(如IL-1β、IL-6等)增加,产生炎症级联反应[19]。本研究使用LPS作用于BV2细胞,通过qRT-PCR法检测TLR4、MyD88、IL-1β、IL-6的mRNA表达情况,结果发现正常组上述因子表达量均较少;使用LPS刺激后因子的表达量明显增加,与正常对照组比较,差异有统计学意义(P<0.05)。
TAK-242是一种合成的小分子物质,主要作用于TLR4受体[20],通过抑制TLR4信号通路来减轻炎症反应。Uthra[21]在研究糖尿病视网膜病变时发现,高糖导致TLR4的表达增加,使用TAK-242后能减少炎症因子如IL-8、IL-1β、TNF-a等的表达。因此本次研究选用TAK-242作为TLR4受体抑制剂,与LPS组比较,加入TAK-242后,炎症因子的表达量较LPS组有不同程度的下降,差异有统计学意义(P<0.05)。
综上所述,本实验以体外培养的BV2小胶质细胞为研究对象,采用LPS刺激BV2细胞构建炎症反应模型,用不同浓度的LPS刺激BV2细胞,能通过上调TLR4信号通路,增加炎症因子IL-1β、IL-6的表达;TAK-242作为TLR4受体抑制剂可阻断TLR4信号通路,能使BV2细胞存活率提高,降低炎症因子IL-1β、IL-6的表达。因此,TAK-242对LPS诱导的炎症反应具有保护作用,其机制通过阻断TLR4-MyD88信号通路,使小胶质细胞的炎症因子表达减少,从而减轻小胶质细胞的炎症反应。本研究结论为TAK-242应用于中枢神经系统炎症反应的临床治疗提供了一定的依据,但仍需进一步确定临床治疗的安全性及有效性。
1Vezzani A.Epilepsy and inflammation in the brain:overview and pathophysiology[J].Epilepsy Curr,2014,14(1 Suppl):3-7.
2Walker L,Sills GJ.Inflammation and epilepsy:the foundations for a new therapeutic approach in epilepsy?[J].Epilepsy Curr,2012,12(1):8-12.
3Kim YS,Joh TH.Microglia,major player in the brain inflammation:their roles in the pathogenesis of Parkinson’s disease[J].Exp Mol Med,2006,38(4):333-347.
4Walker DG,Whetzel AM,Lue LF.Expression of suppressor of cytokine signaling genes in human elderly and Alzheimer’s disease brains and human microglia[J].Neuroscience,2015,302:121-137.
5Emsley HC,Appleton RE,Whitmore CL,et al. Variations in inflammation-related genes may be associated with childhood febrile seizure susceptibility[J].Seizure,2014,23(6):457-461.
6Choy M,Dubé CM,Ehrengruber M,et al.Inflammatory processes,febrile seizures,and subsequent epileptogenesis[J].Epilepsy Curr,2014,14(1 Suppl):15-22.
7Matsunaga N,Tsuchimori N,Matsumoto T,et al. TAK-242 (resatorvid), a small-molecule inhibitor of Toll-like receptor (TLR) 4 signaling, binds selectively to TLR4 and interferes with interactions between TLR4 and its adaptor molecules[J].Mol Pharmacol,2011,79(1):34-41.
8贾建平,陈生弟.神经病学[M].北京:人民卫生出版社,2013:297.
9Song P,Liu Y,Yu X,et al. Prevalence of epilepsy in China between 1990 and 2015:A systematic review and meta-analysis[J].J Glob Health,2017,7(2):20706.
10Nau AL,Mwape KE,Wiefek J,et al.Cognitive impairment and quality of life of people with epilepsy and neurocysticercosis in Zambia[J].Epilepsy Behav,2017,S1525-5050(17):30464-X.
11Wilcox KS,Vezzani A.Does brain inflammation mediate pathological outcomes in epilepsy?[J].Adv Exp Med Biol,2014,813:169-183.
12Devinsky O,Vezzani A,Najjar S,et al.Glia and epilepsy:excitability and inflammation[J]. Trends Neurosci,2013,36(3):174-184.
13Riazi K,Galic MA,Pittman QJ.Contributions of peripheral inflammation to seizure susceptibility:cytokines and brain excitability[J].Epilepsy Res,2010,89(1):34-42.
14Rodgers KM,Hutchinson MR,Northcutt A,et al.The cortical innate immune response increases local neuronal excitability leading to seizures[J].Brain,2009,132(Pt 9):2478-2486.
15Klein M,Obermaier B,Angele B,et al.Innate immunity to pneumococcal infection of the central nervous system depends on toll-like receptor (TLR) 2 and TLR4[J].J Infect Dis,2008,198
(7):1028-1036.
16Medzhitov R,Preston-Hurlburt P,Janeway C J.A human homologue of the Drosophila Toll protein signals activation of adaptive immunity[J].Nature,1997,388(6640):394-397.
17Wu Y,Li W,Zhou C,et al.Ketamine inhibits lipopolysaccharide-induced astrocytes activation by suppressing TLR4/NF-kB pathway[J].Cell Physiol Biochem,2012,30(3):609-617.
18Cohen P.The TLR and IL-1 signalling network at a glance[J].J Cell Sci,2014,127(Pt 11):2383-2390.
19Akira S,Uematsu S,Takeuchi O.Pathogen recognition and innate immunity[J].Cell,2006,124(4):783-801.
20Rice TW,Wheeler AP,Bernard GR,et al.A randomized,double-blind,placebo-controlled trial of TAK-242 for the treatment of severe sepsis[J].Crit Care Med,2010,38(8):1685-1694.
21Rajamani U,Jialal I.Hyperglycemia induces Toll-like receptor-2 and -4 expression and activity in human microvascular retinal endothelial cells:implications for diabetic retinopathy[J].J Diabetes Res,2014,2014:790902.

