缺血处理对大鼠缺血再灌损伤性压疮的保护作用
镇艳 王华军 易伟民
压疮是由于局部组织长期受压,血液循环障碍,局部组织营养缺乏而致的软组织溃烂和坏死。其防治是世界医学的难题。及时减压是预防压疮长期以来的 “金标准”[1]。然而,组织缺氧产生的氧自由基会加重局部组织细胞和组织的损伤,也就是缺血再灌注损伤[2]。目前,大量研究表明缺血预处理(ischemic preconditioning,IPC)和缺血后处理(ischemic postconditioning,I-postC)在脏器及骨骼肌的再灌注损伤中有显著的保护作用[3],但关于IPC和I-postC及缺血联合处理(ischemic preconditioning+ischemic postconditioning,IPC+I-postC)对压疮缺血再灌注损伤作用尚未见有报道,三种缺血处理方法参与压疮缺血再灌注性损伤的关系尚不清楚。本研究采用内源性治疗手段调节自身免疫技术,通过动物造模形成缺血再灌注性压疮,模拟临床上IPC、I-postC及IPC+I-postC的干预方法,通过检测压疮发生早期血清氧自由基的含量,阐明不同缺血处理方法在SD大鼠缺血再灌注损伤性压疮预防中的保护效果,探讨IPC和I-postC及IPC+I-postC对压疮微循环缺血再灌注损伤是否同样具有保护作用,比较三种缺血处理方法对SD大鼠皮肤及皮下组织在肉眼及血清氧自由基方面的损伤情况,探讨氧自由基参与压疮发生的机理。为临床压疮的预防和处理提更充分和科学依据。
材料与方法[4]
一、材料
1.实验动物:健康雄性SD大鼠100只,SPF级,体重220~250 g,中山大学动物实验中心提供,常规分笼饲养于安静室温环境,动物在新环境中熟悉1周后进行实验。
2.主要仪器:BX50-OLYMPUS光学显微镜、离心机、超净工作台、电子称、HARRIS INC超低温冰箱(-70℃)、空气压缩机、相机、外科手术器械一套。
3.主要试剂:磷钨酸苏木素染色试剂盒,NO测定试剂盒、MDA测定试剂盒、DAB显色试剂盒、SOD测定试剂盒、4%戊二醛固定液、10%水合氯醛、4%多聚甲醛固定液、高锰酸钾,草酸,Mallory磷钨酸苏木素染料,、ECL试剂盒心铀,蛋白marker。
二、方法
1.压疮造模:在大鼠腹腔注射10%水合氯醛(400 mg/kg剂量)进行麻醉。减去腿部毛发约2 cm×2 cm的面积,暴露大腿股薄肌部位。将大鼠俯卧及固定四肢,将压力接触面垂直作用于大鼠大腿股薄肌处,连接空气压缩机与压力汽缸,412.5 mmHg(1 mmHg=0.133 kPa)压力下持续加压2 h。见图1-1。
2.动物模型分组:将100只SD大鼠平均随机分为5组,每组20只。(1)对照组(S组):用10%水合氯醛麻醉大鼠,2 h后处死取血。(2)缺血再灌注组(IR组):麻醉大鼠,将大鼠俯卧及固定四肢,持续施压2 h,解压2 h后处死取血。(3)预处理组(LPC组):麻醉大鼠,将大鼠俯卧及固定四肢,连续三个循环局部压迫/解压,每次10 min,然后再持续施压2 h,解压2 h后处死取血。(4)后处理组(I-postC组):麻醉大鼠,将大鼠俯卧及固定四肢,持续施压2 h,解压后即刻行连续三个循环局部压迫/解压,每次10 min,然后恢复血流灌注2 h后处死取血。(5)联合处理组((IPC+I-postC组):麻醉大鼠,将大鼠俯卧及固定四肢,连续三个循环局部压迫/解压,每次10 min,然后再持续施压2 h,解压后即刻行连续三个循环局部压迫/解压,每次10 min,然后移开压力接触面,血流恢复灌注2 h后处死取血。

图1-1 大鼠压疮造模
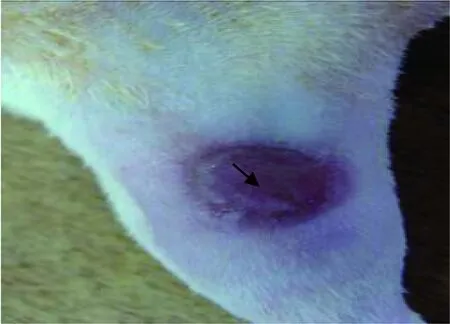
图1-2 大鼠造模出现的Ⅰ期压疮
3.肉眼观察大鼠受压部位皮肤压疮的发生率及分度:根据美国压疮学会最新的压疮分类标准,通过肉眼观察受压部位皮肤颜色、形态学及完整性变化,将其分为Ⅰ度、Ⅱ度、Ⅲ度、Ⅳ度压疮[5]。
4.测定血清中SOD活力、MDA含量、NO含量:处死大鼠,取腹主动脉3 mL血液置入Ep管中,经3 600 r/min的速度离心10 min后取血清,-70℃冰箱保存待用。用722型分光光度计,根据试剂盒操作规程分别采用氧化酶法检测血清中超氧化物歧化酶(SOD)、硫代巴比妥酸染色法测丙二醛(MDA)、硝酸还原酶法测一氧化氮(NO)的水平。
三、统计学分析
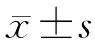
结 果
一、各组大鼠压疮发生情况
每组大鼠均未出现Ⅱ度及以上的压疮,但除S组外,其他各组局部皮肤肉眼观察Ⅰ期压疮发生率均为100%。按α=0.05检验水准,S组、IR组、IPC组、I-postC组及IPC+I-postC组压疮发生的总体分布不同或不全相同。两两比较发现,按α′=0.008检验水准,S组与其它各组的差异有统计学意义,除S组外,IR组、IPC组、I-postC组、IPC+I-postC组两两比较的差异无统计学意义。
二、各组大鼠压疮发生率比较
两两比较发现,按α′=0.008检验水准,S组与其它各组的差异有统计学意义,除S组外,IR组、IPC组、I-postC组、IPC+I-postC组两两比较的差异无统计学意义(表1)。
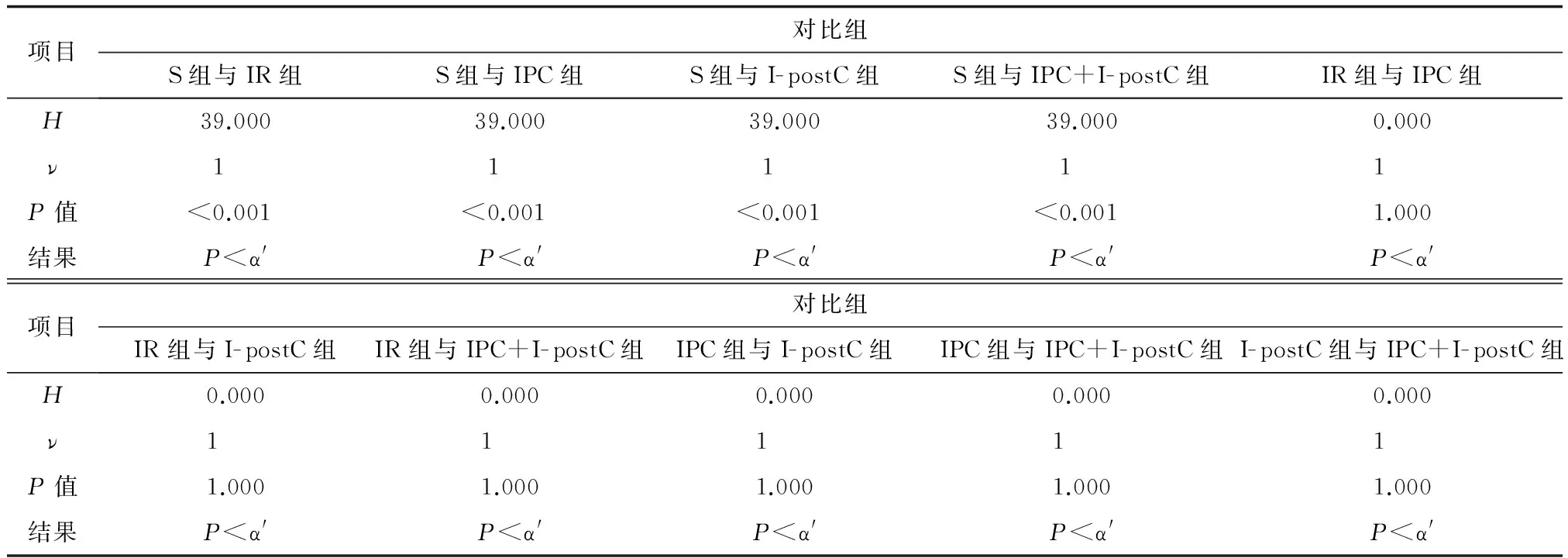
表1 5组大鼠受压部位皮肤压疮发生率两两比较(α′=0.05/6=0.008)
注:S组为对照组,IR组为缺血再灌注组,LPC组为预处理组,I-postC组为后处理组,IPC +I-postC组为联合处理组
三、各组压疮大鼠血清中SOD活力、MDA和NO的水平
对每组大鼠血清中SOD活力、MDA和NO的含量比较发现,按α′=0.008检验水准,差异有统计学意义(表2)。
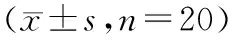
表2 5组大鼠血清SOD活力、MDA、NO
注:S组为对照组,IR组为缺血再灌注组,LPC组为预处理组,I-postC组为后处理组,IPC +I-postC组为联合处理组;SOD为氧化酶法检测血清中超氧化物歧化酶,MDA为硫代巴比妥酸染色法测丙二醛,NO为硝酸还原酶法测一氧化氮;各组比较:P<0.05
讨 论
压疮的预防重于治疗,大多数压疮临床上是可以预防的,当人体的皮肤通过自身调整提高了局部压力耐受性[6],没有及时翻身的长期卧床病人也不会发生压疮。Barry Golden以猪建立压疮模型发现长时间受压后组织可出现一定的适应性[7]。通过反复短暂的压力刺激,延长间隔翻身时间,可促进了毛细血管的开放和增生,增强皮肤毛细血管承受压力的能力[8]。以上研究为缺血再灌注性压疮早期处理提供了一定的理论基础。缺血处理通过轻度的缺血应激作用激活,调节机体内源性保护机制,从而加强皮肤及皮下组织对缺血再灌注损伤的抵抗力[9]。
本研究结果显示,IPC组与其他各组比较,MDA、NO含量稍高于S组,低于IR组,SOD活性低于S组,高于RI组;两两比较有统计学差异。说明LPC可能通过减轻缺血后微血管床的闭塞对血管进行保护,也可能与IPC可缓解缺血再灌损伤引起的组织中高氧状态有关。
研究表明[10-11],IPC产生的少量自由基可启动内源性的保护机制,减少在缺血再灌注过程中因线粒体受损大量自由基的产生,减轻对机体组织氧化应激损伤,从而保护了缺血组织,有效缓解了压疮缺血再灌注性损伤,为临床压疮的防护提供了可靠的理论依据。
研究表明,缺血后处理也是一种有效的内源性保护机制,与缺血预处理具有类似的作用[12]。其面对的是已缺血组织,是从建立一种更有效的再灌注角度出发,旨在处理和挽救己缺血组织,最大程度的减轻再灌注损伤,对减少缺血氧自由基的生成方面具有重要的联系。I-postC相比IPC,因作用于再灌注过程,避免了缺血发生的不可预知性,在临床中的运用更具有价值。研究结果发现I-post组与其他各组两两比较,SOD活性、NO、MDA含量稍低于S组,高于IR组,I-post组与S组、I-post组与RI组有统计学差异,I-post组与LPC组、I-post组与LPC+I-post组无统计学差异;这些数据说明,在I-post组实验血清氧自由基的含量显著低于IR实验组。此现象说明,通过I-post组的保护作用可有效减轻压疮缺血再灌注损伤,缺血后处理可以减轻氧自由基的爆发产生。
本研究中,5组实验大鼠血清中SOD活性均高于RI组,MDA、NO的含量均低于RI组,说明在肢体受压后有大量的脂质过氧化反应的产物和氧自由基产生,血清中SOD活力和MDA含量存在负性相关。本实验证明,再灌注损伤导致的氧自由基的损伤是可以干预的,从而提示我们可以从减轻组织自由基损伤的角度预防缺氧再灌注损伤对细胞的结构和功能的破坏。与RI组比较,IPC组、I-postC组和IPC+I-postC组血清MDA、NO含量明显降低,SOD活性明显增高(P<0.05)。IPC组与I-postC组、I-postC组与IPC+I-postC组的氧自由基的指标差异无统计学意义。实验结果显示,RI组、IPC组、I-postC组和IPC+I-postC组的MDA、NO含量均明显高于S组,SOD活性显著低于S组。说明除S组外,其他四组均存在缺血再灌注损伤。血清中NO的较对照组显著增高,这可能与在缺血再灌注期,组织内可爆发生成大量的超氧阴离子自由基,而导致细胞膜脂质过氧化和细胞其它成分发生氧化损伤有关。
总之,缺血处理在压疮的形成过程中起到重要作用,且IPC组、I-postC组和IPC+I-postC组三种缺血处理方法具有近似等同的效果,均对大鼠缺血再灌注损伤性压疮具有保护作用。
1Black J,Baharestani MM,Cuddigan J,et al.National pressure ulcer advisory panel’s updated pressure ulcer staging system[J].Adv Skin Wound Care,2007,20(5):269-274.
2Keelaghan E,Margolis D,Zhan M,et al.Prevalence of pressure ulcers on hospital admission among nursing home residents transferred to the hospital[J].Wound Repair Regen,2008,16(3):331-336.
3单妙航,卢婉娴.护理专案降低ICU高危压疮患者压疮发生率的效果观察[J].护理学报,2014,21(12):6-7.
4王华军,黄惠根,镇春,等.不同缺血处理方法对大鼠压疮细胞凋亡的影响[J].热带医学杂志,2011,11(12):1369-1370.
5Zweier JL,Talukder MA.The role of oxidants and free radicals in reperfusion injury[J].Cardiovas Res,2006,70(2):181-90.
6王彩凤,巫向前.压疮形成机制研究进展[J].护理学杂志,2007,12(1):74-77.
7Jan YK,Brienza DM,Geyer MJ,et al.Wavelet-based spectrum analysis of sacral skin blood flow response to alternating pressure[J].Arch Phys Med Rehabil,2008,89(1):137-45.
8蔡福满,姜丽萍,杨晔琴,等.氧自由基损伤在压疮形成中的作用机制实验研究[J].护理学杂志,2008,23(14):12-14.
9王华军,黄惠根.缺血后处理对压疮大鼠血清超氧化物歧化酶活力、丙二醛及一氧化氮含量的影响[J].新医学,2014,45(1):24-27.
10赵晶,白云.自由基相关疾病研究进展[J].生物学教学,2003,28(4):6-8.
11李瑞华,阚世廉,李津.骨骼肌缺血再灌注损伤研究进展[J].中国中西医结合外科杂志,2017,23(4):459-461.
12王华军,镇艳,徐加加,等.缺血预处理对大鼠压疮缺血再灌注损伤保护作用的实验研究[J].热带医学杂志,2013,11(13):1338-1340.

