应用流式细胞技术分选单核细胞亚群不同预富集方法的探讨*
杨红艳,焉力方,王如刚,周 欣
(1.北京市预防医学研究中心,北京 100020;2.武警天津市总队第六支队,天津 300402;3.武警后勤学院附属医院心脏医院,天津 300162)
单核细胞是调节免疫应答的主要细胞,其表型和功能具有异质性,单核细胞的不同亚群参与了不同疾病的发生发展[1,2]。流式细胞术是20世纪60年代末发展起来的技术,其在免疫学的研究中起到了重要的作用[3],尤其是分选技术的建立,为获取目标细胞提供了强有力的技术平台。因此,流式细胞分选术可以作为不同亚群单核细胞功能学和组学研究的重要手段。其中样本的预富集方法对于分选的纯度和速度等起着举足轻重的作用,常用方法主要有红细胞裂解法[4]、羟乙基淀粉(hydroxyethy1 starch,HES)离心沉淀法[5]和Ficoll密度梯度离心[6]等。几种预富集方法各有利弊,尚未有研究对其进行比较。因此,本研究拟从细胞活力、细胞回收率、单核细胞分群情况等方面加以比较,从而寻找一种便于建立简便、快捷而又高效的单核细胞流式分选技术的样本预富集方法。
1 材料和方法
1.1实验材料和试剂采集15例健康志愿者外周静脉血3 ml。抗CD14- 异硫氰酸荧光素(fluorescein isothiocyanate,FITC),mIgG2a- FITC,抗CD16- 藻红蛋白(phycoerythrin,PE),mIgG1- PE,抗CD86- PE- Cy5和mIgG2b- PE- Cy5等抗体均购自Biolegend公司;Ficoll分离液购自Sigma公司;Flow- CountTMFluorospheres(Flow- CountTM荧光微球)购自Beckman公司,其他试剂均为国产分析纯。
1.2方法
1.2.1抗体标记后裂解红细胞(Method 1):50 μl血先加入单核细胞亚群抗体混合液(CD14- FITC 4 μl,CD16- PE 6 μl,CD86- PE- Cy5 3 μl及Staining Buffer 12 μl);室温避光孵育15 min,然后加入600 μl红细胞裂解液,避光孵育10 min;最后上机前加入50 μl Flow- countTM荧光微球。
1.2.2抗体标记前裂解红细胞(Method 2):500 μl外周血首先加入10 ml红细胞裂解液,室温孵育10 min后离心(250 g,10 min);弃上清,加入1 ml磷酸缓冲液(phosphate buffer saline,PBS)重悬细胞,离心(250 g,10 min),弃上清;50 μl Staining Buffer重悬;细胞计数后加入抗体混合液(CD14- FITC,CD16- PE,CD86- PE- Cy5及Staining Buffer),避光孵育15 min,最后上机前加入50 μl Flow- countTM荧光微球并充分混匀。
1.2.3羟乙基淀粉离心沉淀法(Method 3):500 μl全血与6 mg/dl的羟乙基淀粉按照1∶4的比例混匀,37℃静置1 h,取上清,离心(250 g,10 min);1 ml PBS洗涤2次;其余步骤同1.2.2。
1.2.4Ficoll密度梯度离心法(Method 4):取一个无菌离心管,先加入比重为1.077g/cm3的Ficoll溶液500 μl,然后缓慢加入稀释后的全血(500 μl全血+500 μl Hank’s液),离心(250 g,30 min);小心吸取中间白膜层(外周血单个核细胞),PBS洗涤2次,弃上清;其余步骤同1.2.2。
1.2.5台盼蓝染色计数法检测细胞活力:分别取Method 2,Method 3和 Method 4方法制备的单细胞悬液,与0.4 mg/dl台盼蓝溶液按9∶1混合均匀,3 min内用血细胞计数板分别计数活细胞和死细胞,每个样本计数3次,取平均值,计算细胞活力。细胞活力(%)=活细胞总数/(活细胞总数+死细胞总数)×100%。
1.2.6流式细胞仪检测:FITC,PE,PE- Cy5三色荧光染料经488 nm激发光激发后,分别产生波长为525,572,675 nm的荧光,分别用Cytomics FC 500流式细胞仪的FL1,FL2和FL4三个通道收集荧光信号。使用前向散射光(FSC)和侧向散射光(SSC)二维散点图(dot plot)初步显示外周血各群细胞,流式细胞术分析的设门策略详见本实验室前期工作[7]。

2 结果
2.1细胞活力检测镜下观察,活细胞光亮无色,死细胞被台盼蓝染成蓝色且细胞发暗、无光泽。几种方法所得的细胞,细胞活力均在95%以上。
2.2人外周血流式细胞分析检测单核细胞及亚群流式细胞仪分析结果见图1。其中A,B,C图圈定的细胞群为单核细胞,E,F,G图圈定的细胞群为单核细胞三个亚群的分布情况。结果显示,与Method 1相比,Method 2和Method 4均能显示外周血单核细胞亚群分布情况,而Method 3没有明显细胞分群,故此种方法不适合用于流式细胞分选技术的样品预富集。

图1 单核细胞亚群的流式分析图
2.3不同预富集方法的单核细胞绝对计数流式细胞分析结果显示,同一个志愿者,等量外周血,与Method 1相比, Method 2检测的单核细胞数目与其差异无统计学意义(24 602±7 207 vs 24 458±6 347,P>0.05),而Method 4检测的单核细胞则明显减少,差异有统计学意义(24 602±7 207 vs 6 576±3 231,P<0.05)。
2.4不同预富集方法获取样本的流式分选上机检测结果分别采集1 ml外周血,按照上述步骤处理,分选所需抗体及获取单核细胞计数见表1。流式细胞分选结果显示:与Method 1相比,Method 2获取的单核细胞数量无明显差异,但其所需抗体量仅为前者的1/30;而Method 4获取的单核细胞数量则明显减少,仅为其他方法的25%左右。
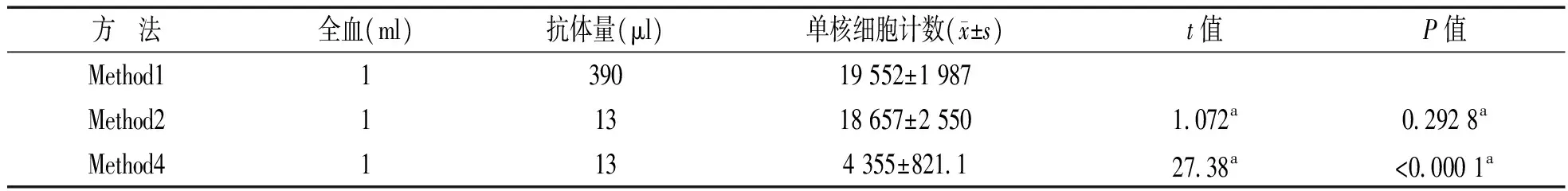
表1 不同预富集方法流式分选时获取的单核细胞计数及抗体量
注:a代表与Method 1比较。
3 讨论
单核细胞由骨髓中的造血干细胞分化而来,骨髓中的单核细胞成熟后进入外周血,构成了外周血中吞噬细胞的主要组成成分[1]。单核细胞能吞噬细菌、异物等,并参与机体的免疫反应。单核细胞具有迁移性,当机体受到抗原刺激时,在趋化因子的作用下,能够吞噬、吞饮和受体介导的方式将抗原摄入细胞内,并发挥杀伤作用。2010年国际免疫学会命名委员会依据单核细胞表面标记物和流式细胞术对人类和鼠类单核细胞亚群进行命名,人类单核细胞主要分为3个亚群:经典型(CD14++CD16-单核细胞)[Mon l];中间型(CD14++CD16+单核细胞)[Mon 2];非经典型(CD14+CD16++单核细胞)[Mon 3],不同亚群具有不同的生理和病理生理学作用,其中具有促炎症表型的Mon2亚群在心血管疾病病理生理学过程中发挥的作用备受关注[2]。
目前,单核细胞的相关研究已成为当前免疫学研究的重点和热点。传统方法分离单核细胞需要反复离心清洗,且操作繁琐,对分离试剂的要求高。近年来,随着流式分选技术的应用,基于细胞的大小及胞内颗粒度等特征,对单核细胞进行流式分选,得到较高纯度的单核细胞亚群。而在流式分选技术中,样本的预富集处理尤其重要。目前流式分选的样本预富集方法很多,各有自身的优缺点。本课题小组分别先采用红细胞裂解法(Method 2)、羟乙基淀粉离心沉淀法(Method 3)和Ficoll密度梯度离心法(Method 4)预富集样本,以抗体加入后再裂解红细胞(Method 1)作为对照,然后分别用流式细胞仪进行分析和分选。我们采用定量的方法,将三种方法分别与Method 1进行了对比研究,力求在不影响细胞活力、数量及形态的前提下,找到一种预富集的最佳方法。结果发现,Method 2,即用红细胞裂解液裂解获取白细胞,再加入抗体孵育能达到后期流式分选的要求,不仅细胞的回收率与Method 1接近,而且能有效的减少抗体用量,缩短上机时间,故此方法可以用于少量临床血液样本进行流式细胞分选出不同亚群的单核细胞,为深入研究单核细胞与疾病之间的关系提供了良好的技术平台。
参考文献:
[1]Jakubzick CV,Randolph GJ,Henson PM.Monocyte differentiation and antigen- presenting functions[J].Nature Reviews Immunology,2017,17(6):349- 362.
[2]Ziegler- Heitbrock L.Blood monocytes and their subsets:established features and open questions[J].Frontiers in Immunology,2015(6):423.
[3]李玲,魏大鹏,张平,等.流式细胞术检测外周血白细胞内的磷酸化STAT3[J].现代检验医学杂志,2011,26(3):96- 98.
Li L,Wei DP,Zhang P,et al.Detecting the tyrosine phosphorylated of STAT3 in white blood cells of human peripheral blood by flow cytometry[J].Journal of Modern Laboratory Medicine,2011,26(3):96- 98.
[4]Einwallner E,Subasic A,Strasser A,et al.Lysis matters:red cell lysis with FACS lyse affects the flow cytometric enumeration of circulating leukemic blasts[J].Journal of Immunology Methods,2013,390(1/2):127- 132.
[5]史艳利,高岭,张宪伟,等.羟乙基淀粉沉降法制备外周血富白细胞血浆的条件优化[J].浙江临床医学,2015,17(7):1204- 1205.
Shi YL,Gao L,Zhang XW,et al.Optimization of preparation of peripheral blood leukocytes in plasma by hydroxyethyl starch sedimentation[J].Zhejiang Clinical Medical Journal,2015,17(7):1204- 1205.
[6]Maqbool M,Vidyadaran S,George E,et al.Optimisation of laboratory procedures for isolating human peripheral blood derived neutrophils[J].Medical Journal of Malaysia,2011,66(4):296- 299.
[7]Ji WJ,Lu RY,Liu JX,et al.The influence of different anticoagulants and time- delayed sample processing and measurements on human monocyte subset and monocyte- platelet aggregate analyses[J].Cytometry Part B Clinical Cytometry,2017,92(5):371- 379.

